CBF冷信号通路基因在热处理诱导的香蕉抗病性中的作用
2018-05-11张昭其庞学群王海波
李 璐, 张昭其, 庞学群, 王海波
(1.华南农业大学生命科学学院,广东广州 510642; 2.华南农业大学园艺学院,广东广州 510642; 3.广东食品药品职业学院,广东广州 510520)
热处理是提高果蔬抗冷性的最有效采后处理之一,热处理主要通过诱导CBF冷信号通路基因表达增强进而提高香蕉果实的抗冷性[1-2]。病害是热带亚热带果蔬贮运保鲜中存在的主要问题之一,值得注意的是,热处理也能够大大提高香蕉的抗病性。我们推测,热处理在诱导抗冷性和抗病性方面可能具有共同的机理。因此,研究CBF冷信号通路基因在热处理诱导香蕉果实抗病中的作用,将有助于进一步了解采后香蕉果实抗病机理。研究表明,热处理能有效提高采后果实的抗病性。例如,60 ℃ 30~60 s的热水浸泡处理能显著地降低加利福尼亚桃、油桃、李子等水果褐斑病发生率[3]。热处理也可有效抑制苹果、梨果实贮藏过程中病虫害及腐烂的发生[4],使其在长期的低温冷藏过程中仍然保持较好的贮藏品质。庞学群等进一步研究发现,将香蕉果实进行热处理后恢复至室温一段时间再接种外源炭疽菌孢子,发现热处理后的恢复对于诱导果实的抗病性具有较好效果[5]。在冷信号途径的研究过程中发现,CBF类基因作为冷信号通路的关键调控基因在提高植物抗冷性中起重要作用。模式植物上的研究表明,低温转录因子CBF调控的信号传导途径可能是诱导植物抗冷性提高的最重要途径,即ICE-CBF-COR通路。CBF是该途径中基因表达的“主开关”,受ICE调控的CBF转录因子能够特异结合启动子中含有CRT/DRE(C-repeat/dehydration responsive element)的顺式元件,可以激活下游一系列冷调节基因COR的表达,从而提高拟南芥等植物的抗寒性[6-9]。Peng等研究发现,高温和低温均能诱导CBF冷应答途径相关基因的表达[10]。4 ℃低温诱导了蝴蝶兰PaCBF1在4 h开始表达,24 h达到最高峰。在拟南芥中过表达PaCBF1,诱导了AtCOR6.6和RD29a表达的增强。考虑到热处理可同时诱导采后香蕉果实的抗病性和抗冷性,CBF类基因在采后香蕉果实抗病诱导过程中是否起到一定的作用还不清楚,需要进一步研究证实。热水处理能否通过CBF冷应答途径从而提高香蕉果实的抗病性,目前尚无报道。本试验着重在于探索CBF冷信号基因通路对病害胁迫的响应,探讨热处理是否能通过CBF途径途径增强采后香蕉果实的抗病性,研究CBF冷信号通路的相关基因在热水处理诱导香蕉抗病性中的作用。
1 材料与方法
1.1 材料及处理
本试验所使用的试验材料为香蕉品种“巴西”(Musaspp. cv. Cavendish),购自于广东省广州市南沙区香蕉园,采收饱满度及成熟度为70%~80%的青硬绿熟香蕉,在果园进行初步落梳处理后立即运回实验室,挑选大小均匀、无病虫害及机械损伤的香蕉果指。先用清水对挑选后的香蕉果指进行清洗,再用浓度为0.1%漂白粉溶液和0.05%咪鲜胺溶液各浸泡5 min,晾干备用。
热处理(hot water dipping,HWD):将上述香蕉果实分为3份,其中1份浸入热水处理机(体积为400 L)中,温度为 52 ℃,时间为3 min,取出晾干,并接种炭疽病菌孢子,用聚乙烯薄膜袋(厚度0.03 mm)包装后放入(20±2) ℃恒温箱中贮藏,作为热处理+接种处理组。另外2份香蕉果实在25 ℃水中浸泡3 min后,取出晾干,其中1份接种炭疽病菌孢子,用聚乙烯薄膜袋(厚度0.03 mm)包装后放入(20±2) ℃恒温箱中贮藏,作为接种处理组;将剩余的1份香蕉果实直接用聚乙烯薄膜袋(厚度0.03 mm)包装后放入(20±2) ℃恒温箱中作为对照组。每处理70个香蕉果指,重复3次。在0 h、3 h、5 d、8 d、12 d、14 d、16 d取样备用。
炭疽病菌接种处理:炭疽病菌种由华南农业大学园艺学院采后科学与技术系提供,菌种在马铃薯葡萄糖琼脂平板培养基(PDA)上培养7 d后在超净工作台中用无菌水和刷子刷下粉红色的孢子,在显微镜下观察并用血球计数板计算孢子浓度,然后再用无菌水将孢子液稀释到2×105CFU/mL的浓度。将配制好浓度的炭疽病菌接种到经过常温自来水浸泡过3 min的香蕉果指上,用接种针在香蕉果指的侧面刺3个等距离的小孔,小孔的深度约1 mm,直径约1 mm,间距约5 cm,用吸水纸吸去果皮表面的乳液,将10 μL悬浮孢子液滴入小孔中,接种面朝上放置于塑料筐中,再用聚乙烯薄膜袋(厚度 0.03 mm)包装。
1.2 测定方法
1.2.1 实时荧光定量引物设计 从香蕉基因组数据库(http://banana-genome.cirad.fr/)中搜索并挑选CBF冷信号通路中的6个相关基因序列(表1),设计实时荧光定量引物,验证后备用。

表1引物序列
1.2.2 实时荧光定量PCR(qRT-PCR) 实时荧光定量PCR使用仪器为BIO-RAD CFX9600,采用TOYOBO THUNDERBIRD SYBR®qPCR Mix进行Real-time PCR扩增。qRT-PCR反应体系(20 μL)包括10 μL SYBR-Green PCR Master Mix,0.25 μL上游(10 μmol/L)和0.25 μL下游引物(10 μmol/L),2 μL稀释的cDNA以及7.5 μL ddH2O。反应条件为:95 ℃ 3 min;95 ℃ 10 s,59 ℃ 10 s,72 ℃ 20 s,循环数为40。为了确认产物的质量和引物的特异性,在溶解曲线中分析了产物的Tm(分析溶解温度为65~95 ℃)。利用基因Actin1[11]作为内参基因。所有的qRT-PCR反应根据内参基因Actin1进行Ct值校准,目的基因的相对表达水平利用公式2-ΔΔCt进行计算,重复3次。
1.2.3 病斑的测定 以病斑扩展垂直2个方向的平均宽度计算病斑大小(mm)[5]。
1.2.4 脯氨酸的测定 测定方法主要参照Demiral等的实验方法[12],略有改动。
1.2.4.1 试剂 2.5%酸性茚三酮溶液、3%磺基水杨酸、冰乙酸、甲苯。
1.2.4.2 绘制标准曲线 分别配制1~10 μg/mL之间的6个点制作标准曲线,取2 mL标准溶液加2 mL 3%磺基水杨酸、2 mL冰乙酸和4 mL 2.5%茚三酮,沸水浴显色30~60 min,冷却。加4 mL甲苯萃取,静置后取甲苯相测定 520 nm 下的吸光度(以甲苯为空白对照;D520 nm大小在0.2~0.8之间为佳,若值太高则可以用甲苯适当稀释),依据脯氨酸含量和相应吸光度绘制标准曲线。
1.2.4.3 样品的测定 脯氨酸的提取:取香蕉果皮0.5 g,5 mL 3%磺基水杨酸提取,沸水浴10 min,冷却。5 000 r/min离心10 min,取上清液待测。
测定:取2 mL上清液,加2 mL水,下面步骤同绘制标曲方法一致。然后根据下式计算脯氨酸含量:
单位鲜质量样品中脯氨酸含量(μg/g)=2.5C/m。
式中:C为根据标曲得出样品溶液中脯氨酸浓度(μg/mL),m为样品质量(g),2.5表示溶液体积为2.5 mL。
1.2.5 数据处理 采用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 热处理对采后香蕉果实病斑发展的影响
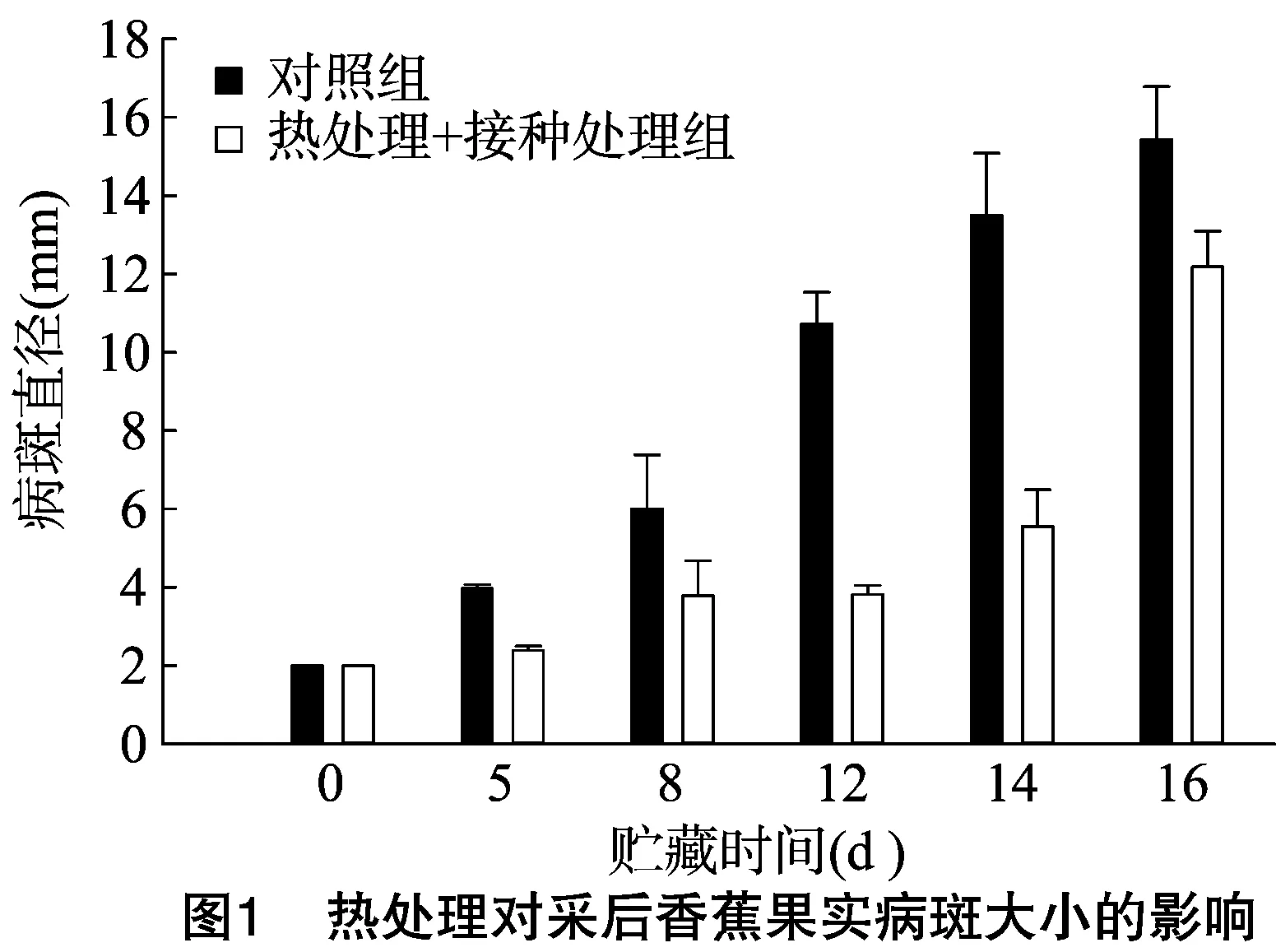
由图1可见,采后香蕉果实在0 d时接种炭疽病菌种,接种病斑直径为2 mm。随着贮藏时间的推移,无论是对照组还是热处理+接种组,所接种的病斑直径均呈逐渐增大的趋势,12 d后病斑明显增大。在0~14 d,热水处理+接种组的病斑发展缓慢,明显低于对照组,但在16 d时病斑发展呈现出暴发的症状。可见,与对照组相比,热处理能较好地诱导采后香蕉果实的抗病性。
2.2 热处理对采后香蕉果实脯氨酸含量的影响
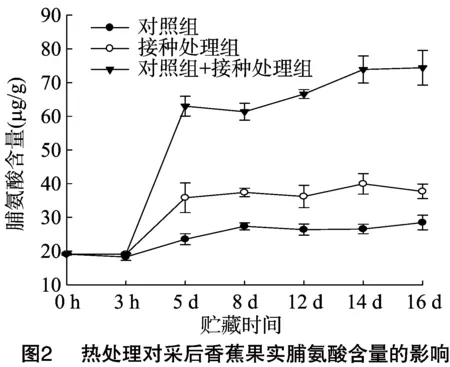
由图2可见,对照组的脯氨酸含量在3 h变化基本不大,在5 d后脯氨酸含量开始上升;与对照相比,热处理诱导了香蕉果实脯氨酸含量的提高,约提高70%左右,热处理果实接种后进一步提高了脯氨酸含量,约是对照的3倍左右。
2.3 热处理对香蕉果实MaICE表达的影响
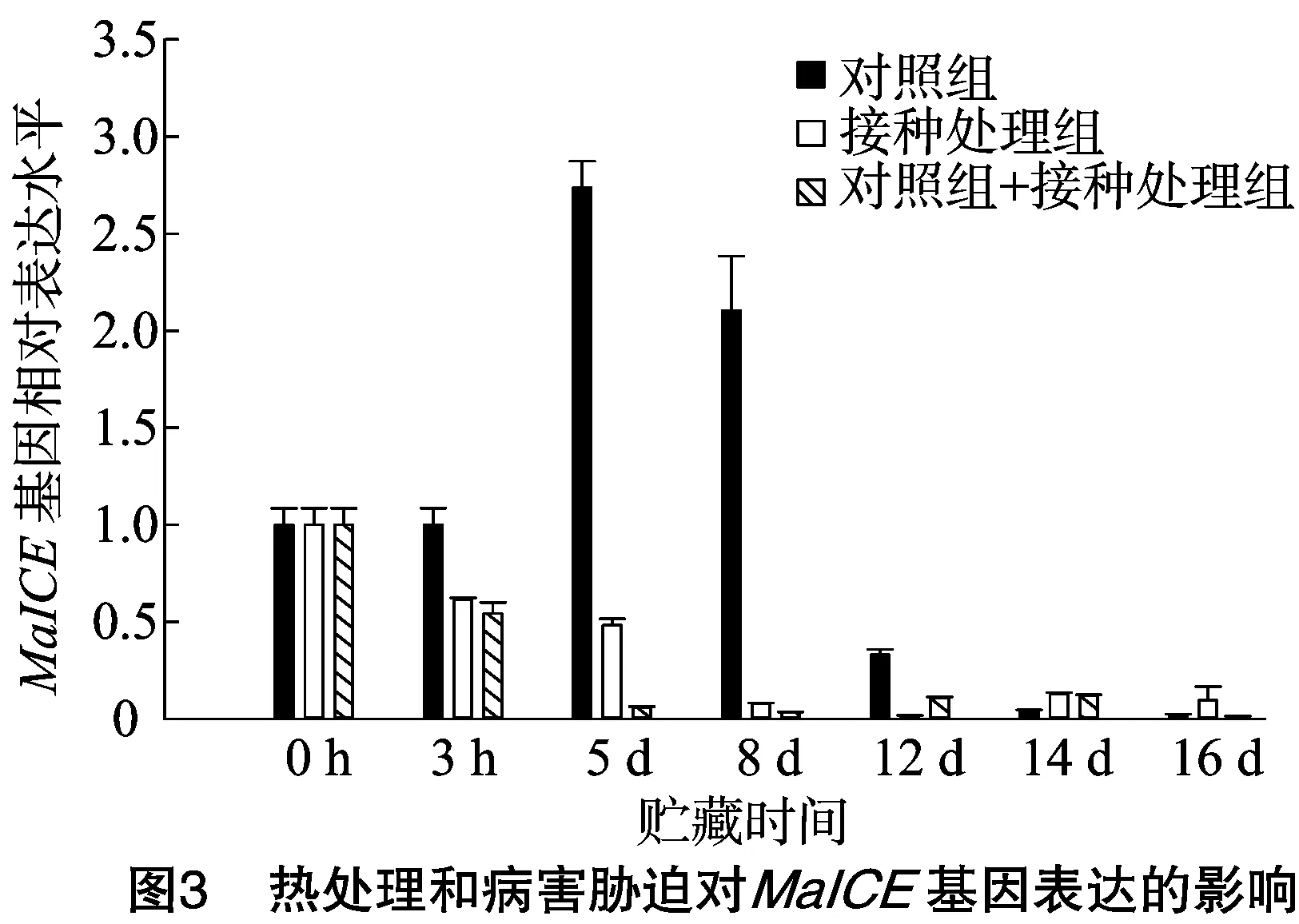
由图3可知,香蕉果实在常温贮藏16 d,对照的MaICE基因表达逐渐升高,在5 d时出现峰值,之后呈现下降趋势。果实接种处理和热处理果实接种后的MaICE基因表达则一直呈现下降趋势。在8 d时分别比对照组低了约90%和95%。结合病情指数(图1)热处理能够明显减轻病害暴发,但病害胁迫和热处理诱导的抗病效果下调了MaICE基因的表达,推测该基因可能与病害响应相关。
2.4 热处理对香蕉果实DREB类基因表达的影响
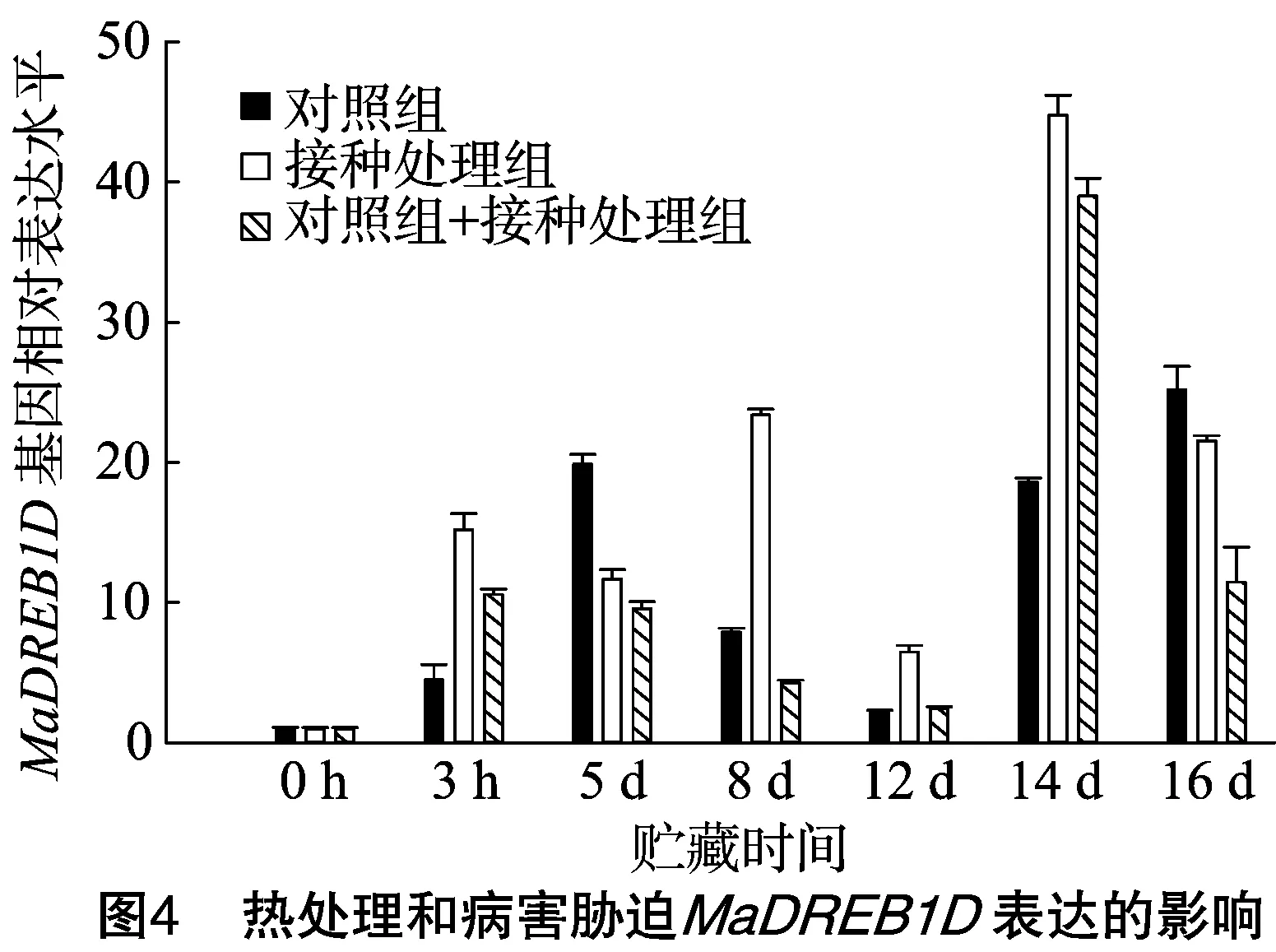
由图4可知,对照组中MaDREB1D基因在常温贮藏5 d和16 d时有2个表达高峰,且在16 d时表达量较高;果实接种后在常温贮藏14 d时有1个表达高峰,约为对照组的2.2倍;热处理果实接种后在3 h、5 d处有较高的表达量,并且在后期14~16 d又有持续较高的表达量,在14 d时有1个表达高峰,约为对照组的2倍。对比MaDREB1D基因表达量可知,对照组在5~8 d表达量持续较高,同时在后期14~16 d表达量亦较高,推测与果实后熟有关;明显病症出现前,该基因在果实接种组比热处理果实接种组表达高,后期各处理表达都提高了大约1倍。可以推测病害胁迫诱导了MaDREB1D基因的表达。
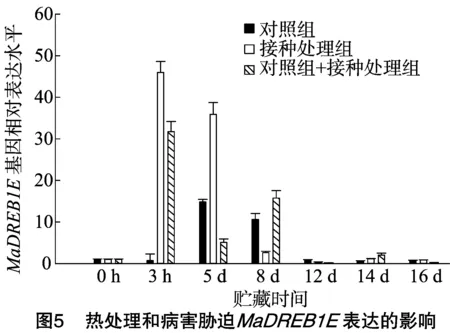
由图5可知,在对照组常温贮藏中MaDREB1E基因表达在5~8 d时达到1个高峰,之后呈现下降的趋势;与对照组相比,果实接种后在常温贮藏中MaDREB1E基因表达在3 h时达到1个高峰,表达量提高了50倍左右,之后呈现下降趋势;热处理果实接种后对于MaDREB1E基因表达同样在3 h处有1个表达高峰,表达量提高了30倍左右,之后的8 d也有1个表达高峰期,接着呈现下降趋势。从0~3 h基因表达可以推测病害胁迫或者接种机械伤诱导了MaDREB1E基因表达;从对照组在5~8 d表达量的提高分析也可能是贮藏过程中病害胁迫诱导了MaDREB1E基因表达。
由图6可知,对照组在常温贮藏5 d时有1个表达高峰;与对照组相比,果实接种后在常温贮藏过程中表达量整体呈现平稳上升趋势,在16 d时提高了25倍左右;热处理果实接种后3 h开始MaDREB1G基因表达处于较高的水平,并在8 d时达到表达高峰,到16 d时提高了20倍左右。可知,果实接种组和热处理果实接种组均诱导了MaDREB1G基因表达的上调,这可能与贮藏过程中香蕉的病害胁迫有关。热处理接种组的基因表达整体上高于果实接种组,可以推测在后期的贮藏过程中病害胁迫对于MaDREB1G基因表达有很强的诱导作用,同时MaDREB1G基因对热处理诱导的抗病性也有一定的响应。

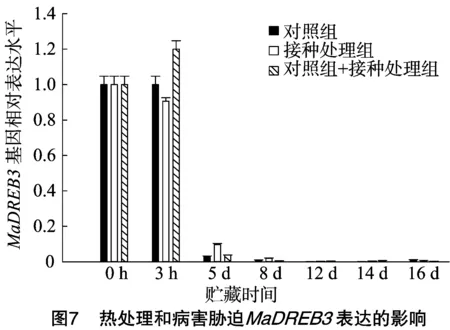
由图7可知,对照组在常温贮藏下MaDREB3基因表达量呈现逐渐下降的趋势;与对照组相比,果实接种后在常温贮藏下MaDREB3基因表达量也呈现逐渐下降的趋势,无明显差异性;热处理果实接种后在3 h有1个表达高峰,之后一直呈现下调趋势,也无明显的差异性。可以推测,病害对MaDREB3基因表达没有诱导作用,MaDREB3基因对热处理诱导的抗病性没有响应。
2.4 热处理对香蕉果实MaCOR413表达的影响
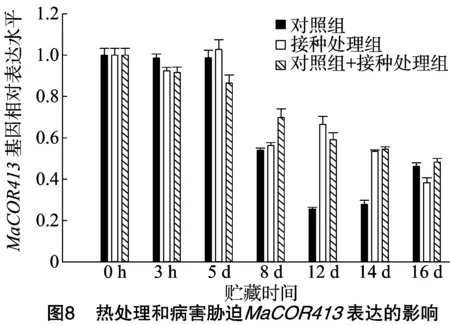
由图8可知,对照组在常温贮藏下MaCOR413基因表达量呈现逐渐下降的趋势。与对照组相比,果实接种组和热处理果实接种组在常温贮藏下MaCOR413基因表达量也同样呈现逐渐下降的趋势。对比基因表达量的趋势,果实接种组和热处理果实接种组在8~14 d表达量略高于对照组,但二者整体呈现下调趋势,且无明显差异性,可以推测病害和热处理诱导的抗病性在8 d以后对MaCOR413基因表达有明显的诱导作用。
3 讨论与结论
热处理常被用于香蕉、芒果等热带水果的采后处理[13-14],可以显著提高它们的抗冷和抗病能力[1,15],然而,香蕉等水果的抗冷诱导机制是否与抗病诱导机制相关目前尚不清楚。本试验通过比较热处理对采后香蕉果实病斑大小和脯氨酸含量的影响,并同时分析了抗病诱导过程中诱导CBF冷信号通路基因的表达规律,表明热处理可抑制炭疽病的发生,并发现抗病诱导与冷信号通路基因具有一定的关系。由于热处理能够提高采后芒果果实抗冷性蛋白的含量[16],同时也能够诱导采后香蕉果实DREB/CBF类转录因子基因表达产生抗冷性,但是在热处理提高采后香蕉果实抗病性的同时是否也能够诱导DREB/CBF类转录因子基因表达目前还不清楚。
脯氨酸含量的升高可以减轻桃果实、小麦等果实的冷害胁迫[17-18]。本研究结果表明,热处理诱导的香蕉果实抗病性可以明显降低接种炭疽病菌后的病斑直径和促进脯氨酸含量的升高,表明热处理提高了香蕉果实的抗病力和抗胁迫能力。DREB/CBF类转录因子即干旱应答元件结合蛋白质/C-重复序列结合子,是AP2/EREBP转录因子家族的一个亚家族,拥有保守的AP2结构域,能够特异性地与抗逆基因启动子区域的DRE/CRT顺式作用元件相结合,在干旱、低温和高盐等非生物胁迫条件下调节一系列下游逆境应答基因的表达,是植物逆境适应中的关键性调节因子[19]。DREB/CBF类转录因子在识别冷诱导响应元件,干旱以及植物抵抗非生物胁迫过程中具有非常重要的作用[20-21]。然而,对于DREB/CBF类转录因子能否通过热处理诱导的冷信号途径进一步提高植物的抗病害能力,目前还不太清楚。有研究表明,对于DREB/CBF类转录因子的转基因大豆植物,在干旱和水分正常的条件下,对生长在土壤中的疫霉菌、镰刀菌、木霉菌、自生固氮菌等土壤中的真菌菌落和菌落直径并没有显著的影响[22]。在茄子抗青枯病研究中,通过研究DREB/CBF类转录因子表明,也没有抗青枯病防御应答反应[23]。有关研究表明,热处理可以激活香蕉果实中与抗逆性相关的酶活,诱导抗逆性相关基因的表达,进而提高采后香蕉果实的抗冷性[24-25]和抗病性[5],本试验的结果中热水处理诱导能够提高采后香蕉果实抗病能力与之相类似。
冷信号通路基因对病害胁迫时有部分基因产生了响应。通过分析可知MaDREB1D、MaDREB1E、MaDREB1G基因对病害胁迫和热处理后接种炭疽病菌有一定的响应,基因表达量在3 h处有所提高,然而并不是所有冷信号通路的基因表达量都呈现上调趋势。MaDREB1D基因在病害胁迫贮藏3 h时有一个瞬时响应,之后的贮藏期间都基本上是高表达的状态。同样,MaDREB1E基因在接种炭疽病菌后的3 h、5 d时产生了瞬间高表达的响应,之后的贮藏过程中却并没有高表达量的响应,推测可能是病害虽然诱导了冷信号通路基因MaDREB1E的前期响应,基因表达量有所提高,但并没持续保持基因的高表达来响应病害的诱导。对于MaDREB1G基因而言,接种炭疽病菌后,并没及时地响应病害胁迫的诱导,基因表达与对照差异不大,随着后期贮藏时间的延长,到了12 d时,MaDREB1G基因有了持续比对照组较高的表达量。可以推测MaDREB1G基因前期不受病害胁迫的诱导,后期响应了病害胁迫的诱导。到了贮藏后期,病害的暴发对采后香蕉果实的伤害起到了主要作用,此时热处理诱导的MaDREB1G基因表达上调对病害暴发有一定的抑制作用。由此可知,病害胁迫和热处理后接种炭疽病菌对冷信号通路基因的表达都有促进作用。
综上所述,热处理可以提高采后香蕉果实的抗病能力。病害胁迫对CBF冷信号通路基因MaDREB1D、MaDREB1E、MaDREB1G、MaCOR413的表达有一定的增强作用,推测CBF冷信号通路基因可能在一定程度上参与了热处理诱导的抗病性提高。有关冷信号相关基因在热处理提高采后香蕉果实抗病性中的作用还需要进一步研究探索。
参考文献:
[1]王海波,李 璐,苏新国,等. CBF冷应答途径基因在热处理诱导的香蕉果实抗冷性中的作用[J]. 中国农业科学,2016,49(14):2763-2771.
[2]魏俊燕,赵 佳,赵仕琪,等. 植物ICE1-CBF冷反应通路的激活与调控研究进展[J]. 生物技术通报,2015,31(6):8-12.
[3]Karabulut O A,Smilanick J L,Crisosto C H,et al. Control of brown rot of stone fruits by brief heated water immersion treatments[J]. Crop Protection,2010,29(8):903-906.
[4]Bai J H,Mielke E A,Chen P M,et al. Effect of high-pressure hot-water washing treatment on fruit quality,insects,and disease in apples and pears[J]. Postharvest Biology and Technology,2006,40(3):207-215.
[5]庞学群,黄雪梅,李 军,等. 热水处理诱导香蕉采后抗病性及其对相关酶活性的影响[J]. 农业工程学报,2008,24(2):221-225.
[6]Chen Y,Chen Z,Kang J,et al. AtMYB14 regulates cold tolerance inArabidopsis[J]. Plant molecular biology reporter,2013,31(1):87-97.
[7]Wu L,Zhou M,Shen C,et al. Transgenic tobacco plants over expressing cold regulated protein CbCOR15b fromCapsellabursa-pastorisexhibit enhanced cold tolerance[J]. Journal of plant physiology,2012,169(14):1408-1416.
[8]Hadi F,Gilpin M,Fuller M P. Identification and expression analysis ofCBF/DREB1 andCOR15 genes in mutants ofBrassicaoleraceavar.botrytiswith enhanced proline production and frost resistance[J]. Plant Physiology and Biochemistry,2011,49(11):1323-1332.
[9]周亚奎,陈旭玉,郑服丛. 香蕉炭疽病生物防治研究进展[J]. 中国农学通报,2008,24(4):328-331.
[10]Peng P H,Lin C H,Tsai H W,et al. Cold response inPhalaenopsisaphroditeand characterization of PaCBF1 and PaICE1[J]. Plant and Cell Physiology,2014,55(9):1623-1635.
[11]Chen L,Zhong H,Kuang J,et al. Validation of reference genes for RT-qPCR studies of gene expression in banana fruit under different experimental conditions[J]. Planta,2011,234(2):377-390.
[12]Demiral T,Turkan I. Comparative lipid peroxidation,antioxidant defense systems and proline content in roots of two rice cultivars differing in salt tolerance[J]. Environmental and Experimental Botany,2005,53(3):247-257.
[13]欧利叶,彭永宏,李 玲,等. 热空气处理对香蕉果实生理变化的影响[J]. 园艺学报,1998,25(2):36-39.
[14]季作梁,洪汉军,张昭其. 热处理对芒果冷害及生理生化基础的影响[C]. 中国农学会农产品加工分会论文集. 北京:中国农业大学出版社,1998:373-376.
[15]黄雪梅,刘明津,张昭其,等. 香蕉果实采后诱导抗病性的初步研究[J]. 食品科学,2006,27(3):224-227.
[16]朱世江,季作梁,张昭其,等. 热处理提高采后杧果抗冷性与蛋白质含量变化的关系[J]. 园艺学报,2003,30(2):198-200.
[17]陈翠莲,马平福. 抗冷性不同的小麦、水稻品种脯氨酸含量的比较试验[J]. 华中农业大学学报,1989,8(2):176-179.
[18]陈智智. 脯氨酸对减轻桃果实冷害的作用及其机理研究[D]. 南京:南京农业大学,2012:19-22.
[19]李科友,朱海兰. 植物非生物逆境胁迫DREB/CBF转录因子的研究进展[J]. 林业科学,2011,47(1):124-134.
[20]Yamaguchi-Shinozaki K,Shinozaki K. A novel cis-acting element in anArabidopsisgene is involved in responsiveness to drought,low-temperature,or high-salt stress[J]. Plant Cell,1994,6(2):251-264.
[21]Thomashow M F. Plant cold acclimation:freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Biology,1999,50(1):571-599.
[22]曹 阳,丁 伟,李新海,等. 转DREB3基因抗旱大豆对土壤微生物群落及有益微生物的影响[J]. 东北农业大学学报,2011,42(1):17-20.
[23]邵欣欣. 茄子ERF转录因子表达分析及参与抗青枯病的初步研究[D]. 广州:暨南大学,2016:47-50.
[24]陈建业,贺立红,蒋跃明,等. 热处理提高香蕉果实耐冷性与苯丙氨酸解氨酶的分子细胞学机制研究[C]. 中国园艺学会第八届青年学术讨论会暨现代园艺论坛. 上海:上海交通大学出版社,2008:1.
[25]Wang H,Zhang Z,Xu L,et al. The effect of delay between heat treatment and cold storage on alleviation of chilling injury in banana fruit[J]. Journal of the Science of Food and Agriculture,2012,92(13):2624-2629.
