山葵组培中抗褐化剂的筛选及其对增殖和生长的影响
2018-05-10刘香江吴红芝
刘香江, 杨 丽, 吴红芝
(云南农业大学,云南昆明 650201)
山葵[Wasabijaponica(Miquel)Matsum]别称山嵛菜,为十字花科山嵛菜属多年生草本半阴生植物,原产于中国和日本,是一种名贵珍稀的香辛蔬菜,其浓辛辣味郁,具有利尿、清热、发汗、解毒、杀菌、增进食欲、预防血栓、抑制癌细胞生长等功效,被誉为“绿色黄金”,在日本、东南亚国家及港澳台地区深受欢迎,是一种重要的出口创汇蔬菜[1-2]。目前,山葵主要采用种子和分株繁殖,但繁殖速度慢、品性易退化,而山葵组织培养技术可为山葵快速繁殖、复壮提供技术支持[3]。
褐化是由于植物材料在组织培养过程中受到伤害,体内分泌的酚类物质在酚氧化酶作用下被氧化成褐色的醌类物质[4],而醌类物质对植物材料产生毒害作用,影响其生长和分化,严重时导致组织死亡。在山葵组培快繁试验中发现,山葵是一种对外界环境刺激特别敏感的植物,不适合的光照、温度、湿度、激素等外界因子都会对山葵生长造成影响,使其褐化,尤其在夏季最为严重。因此,解决山葵组培中的褐化问题是山葵组织培养的关键技术之一。目前,有关山葵组织培养的研究多集中在愈伤组织的诱导、苗的增殖、生根、复壮等,除刘琴研究认为山葵的褐化现象会严重影响愈伤组织诱导的成功率[5]外,有关其褐化的控制鲜见报道。本试验以继代培养的山葵无菌苗为材料,通过在培养基中添加不同浓度的8种抗褐化剂,观察统计山葵无菌苗褐化指数、增殖系数、生长情况等,筛选出既能较好地控制组培苗褐化,又不影响其生长的抗褐化剂类型及其适宜浓度,以期能较好地解决山葵组织培养过程中的褐化问题。
1 材料与方法
1.1 试验材料
本试验于2016年在云南农业大学园林园艺学院组培室进行,供试山葵品种为岛根3号,以山葵继代培养获得的丛生芽为试验材料。
1.2 试验方法
选取生长良好,且长势一致的丛生芽接种到继代培养基MS+0.25 mg/L 6-BA+0.05 mg/L NAA+0.5 mg/L KT+蔗糖30 g/L+琼脂6.25 g/L(pH值为6.0)上,培养基中分别添加活性炭(AC)、聚乙烯吡咯烷酮(PVP)、L-半胱氨酸、柠檬酸、抗坏血酸(维生素C)、二硫苏糖醇(DTT)、硝酸银(AgNO3)、硫代硫酸钠(Na2S2O3)8种抗褐化剂,编号及使用浓度见表1,以不添加任何抗褐化剂的处理为对照。每处理接种10瓶,每瓶接种4株苗,每株苗3个芽,重复3次。每隔30 d统计1次褐化指数[6]、增殖系数和组培苗生长情况,共观察记录90 d。培养条件为温度(16±1)℃,光照时间12 h/d、光照度7 200 lx。根据山葵组培苗褐化颜色,将山葵褐化程度分为无、浅、中、较深、深、最深共6级,分别用0、1、2、3、4、5表示,则褐化指数计算公式为:褐化指数=∑(褐化级别×相应褐化级别的株树)/(调查总株树×5)×100%。增殖系数计算公式为:增殖系数=(调查当日总芽数-接种芽数)/接种芽数。组培苗生长情况根据肉眼观察,调查叶的大小、叶色、茎粗细、是否有黄叶这4个指标。
1.3 数据统计分析
采用Excel 2010、SPSS软件对试验数据进行统计,采用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 不同抗褐化剂对山葵组培苗褐化的控制效果
由表1可见,继代培养第1个月时,山葵组培苗褐化程度相对较轻且缓慢,除DTT 0.035 g/L处理显著高于对照(P<0.05)外,其他处理间差异不显著;继代培养第2个月时,不同抗褐剂对山葵组培苗的抗褐化效果表现出一定差异,除活性炭处理和AgNO32个低浓度处理没有出现褐化外,其他处理均出现不同程度的褐化,其中,仅Na2S2O32.000 g/L处理的组培苗褐化指数显著高于对照(P<0.05);继代培养第3个月时,不同抗褐化剂的整体抗褐化效果依次为AgNO3>活性炭>维生素C>DTT>柠檬酸>PVP>L-半胱氨酸>清水>Na2S2O3,其中,AgNO33个浓度处理的组培苗褐化指数为0,抗褐化效果显著优于对照(P<0.05),抗褐化效果相对最好,活性炭抗褐化效果次之,3个浓度处理中,0.200、0.800 g/L处理的组培苗褐化指数为0,低浓度的PVP、L-半胱氨酸、维生素C、DTT及高浓度的柠檬酸也表现出较好的抗褐化效果,但均没能完全消除褐化;继代培养第3个月时,L-半胱氨酸0.200 g/L、维生素C0.025 g/L、Na2S2O32.000 g/L处理抗褐化效果相对较差,与对照相比,甚至加剧了山葵组培苗的褐化,而高浓度的Na2S2O3处理虽然褐化指数相对较低,但出现大部分植株死亡的现象。此外,本试验中发现,AgNO30.025 g/L 处理在山葵组培苗继代培养第2个月时出现褐化现象,而在第3个月时褐化现象消失,这可能是由于山葵在密闭容器中或受伤后产生乙烯[7],乙烯的大量积累会使山葵组培苗发生褐化,而AgNO3作为一种褐化抑制剂,其主要作用是抑制乙烯的产生[8],银离子通过竞争性结合位于细胞膜上的乙烯受体蛋白,以阻止或降低乙烯的作用[9],从而防止褐化,而山葵继代培养第2个月时,产生的乙烯量相对较大,AgNO3抑制乙烯的速度比不上产生褐化的速度。

表1不同抗褐化剂处理对山葵组培苗褐化的控制效果
注:同列数据后不同小写字母表示处理间差异显著(P<0.05)。
2.2 不同抗褐化剂对山葵组培苗增殖的影响
由图1可见,除PVP 2.000 g/L处理(B1)外,山葵组培苗从继代培养第1个月到第3个月,每个处理的增殖系数呈增加趋势,第1个月增殖速率相对较快,第2个月相对最快,第3个月趋于缓慢;山葵组培苗继代培养到第3个月时,PVP、L-半胱氨酸、柠檬酸、维生素C、DTT、AgNO3处理的组培苗增殖系数多明显高于对照,而活性炭、Na2S2O3处理的组培苗增殖系数均明显低于对照;随使用浓度的上升,活性炭、Na2S2O3处理的山葵组培苗增殖系数呈逐渐下降趋势,说明高浓度活性炭、Na2S2O3使山葵组培苗的增殖分化受到抑制;DTT处理的增殖系数相对最高,继代培养第3个月时,0.020 g/L DTT处理的增殖系数高达6.45;增殖系数最低的为Na2S2O3处理,Na2S2O310.000 g/L处理时增殖系数仅为0.20;山葵组培苗继代培养3个月,不同抗褐化剂处理的组培苗增殖系数高低依次为DTT>柠檬酸>L-半胱氨酸>AgNO3>PVP>维生素C>清水>活性炭>Na2S2O3。
2.3 不同抗褐化剂对山葵植株生长的影响
由表2可见,山葵组培苗继代培养到第3个月,活性炭处理的植株长势相对最好,叶色油绿有光泽,且叶较大,茎秆粗壮,无黄叶出现,其次是PVP、DTT、AgNO3处理;Na2S2O3处理的长势相对最差,随试验浓度的升高,出现大量黄叶,并迅速死亡。试验发现,到第3个月时,大部分处理出现黄叶、植株衰老现象,这可能是由于培养基中的营养物质已不能满足山葵生长需求,因此,培养到第2个月时是山葵组培苗转瓶的最佳时机。
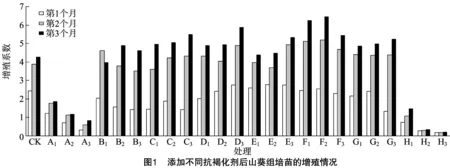

表2不同抗褐化剂处理3个月时的山葵生长情况
3 结论与讨论
在植物组织培养过程中,不管是木本植物还是草本植物,褐化现象普遍存在,多数学者认为这主要是由多酚氧化酶(PPO)作用于其底物酚类物质而引起的,PPO催化酚类化合物形成醌和水,醌再经非酶促聚合,形成对植物材料产生毒害作用的褐色物质[10]。在组织培养过程中,添加抗褐化剂是控制褐化现象发生的常见方法,而最理想的抗褐化剂是既能控制褐化又不影响植物的正常生长[11]。本试验发现,山葵是一种对外界环境条件较敏感、易褐化的植物,在使用经筛选、适宜山葵增殖和生长培养基的基础上进行抗褐化剂及其使用浓度筛选,以排除不良生长环境对山葵组培苗的干扰。试验结果表明,硝酸银处理的抗褐化效果相对最好,且对山葵增殖和生长有较好的促进作用;活性炭抗褐化效果仅次于AgNO3,且随试验浓度升高,抗褐化效果增强,这与郝克伟的研究结果[12]一致;活性炭处理的山葵植株长势相对最好,茎秆粗壮,叶色油绿有光泽,且随试验浓度的升高,植株长势越来越好,但增殖系数下降,这与刘真华等的研究结果[13-14]一致,说明活性炭浓度升高在增强植株长势的同时,也抑制了芽的分化;低浓度维生素C处理的抗褐化效果相对较好,山葵植株长势良好,但增殖系数相对较低;DTT处理增殖系数相对最高,植株长势较好,低浓度处理有一定的抗褐化效果,但不能完全消除褐化现象;柠檬酸处理增殖系数相对较高,植株长势较好,但抗褐化效果一般;PVP处理植株长势较好,但增殖系数和抗褐化效果一般;L-半胱氨酸处理增殖系数相对较高,植株长势较好,但抗褐化效果相对较差;Na2S2O3处理不仅抗褐化效果相对最差,增殖系数相对最低,且植株长势也最差,这与张俊琦等的研究结果[10,15]相似,而与刘真华等的研究结果[13]不一致,这可能是由于研究材料不同或本研究中Na2S2O3使用浓度相对较高所致,低浓度Na2S2O3是否有较好的抗褐化效果还须进一步探索。
同一种抗褐化剂不同浓度之间,虽然浓度梯度相差较小,但抗褐化效果、增殖系数和长势之间却存在很大差异。试验表明,随活性炭浓度的升高,抗褐化效果、植株长势增强,而增殖系数急剧下降;低浓度L-半胱氨酸、维生素C处理和高浓度处理抗褐化效果差异明显,低浓度处理取得较好的抗褐化效果,而高浓度处理加重了山葵的褐化程度,但高浓度处理对山葵增殖和生长却没有抑制作用,反而有所促进;低浓度Na2S2O3处理加重山葵组培苗的褐化程度,高浓度处理虽未加重其褐化程度,却出现大部分植株枯黄死亡。因此,为达到抗褐化效果、增殖和长势之间的平衡,在筛选适宜的抗褐化剂基础上,明确其适宜浓度必不可少。综合抗褐化效果、增殖系数及生长情况,AgNO3处理抗褐化效果相对最好,山葵组培苗增殖系数相对较高,植株长势也较好,可作为山葵组培过程中克服褐化产生的理想抗褐化剂,其中0.025 g/L AgNO3处理效果相对最好,山葵组培苗继代培养3个月时的褐化指数为0,增殖系数达到5.22,且茎秆粗壮、叶大、叶色深绿,植株生长状况良好。
参考文献:
[1]何天祥,蔡光泽,郑传刚,等. 山葵栽培技术[J]. 耕作与栽培,2004(5):53-54.
[2]吴 震,李式军,王广东. 我国发展山葵产业的前景和对策[J]. 中国农学通报,2000,16(2):45-46.
[3]王 颖,刘仁祥,聂 琼,等. 不同防褐剂对烟草愈伤组织培养褐化现象的抑制效应[J]. 贵州农业科学,2012,40(1):26-27.
[4]李 萍,成仿云,张颖星. 防褐剂对牡丹组培褐化发生、组培苗生长和增殖的作用[J]. 北京林业大学学报,2008,30(2):71-76.
[5]刘 琴. 山葵(WasabijaponicaMatsum)组培快繁的关键技术研究[D]. 南京:南京农业大学,2002.
[6]罗晓芳,田砚亭,姚洪军. 组织培养过程中PPO活性和总酚含量的研究[J]. 北京林业大学学报,1999,21(1):92-95.
[7]Kumar V,Parvatam G,Ravishankar G A. AgNO3-a potential regulator of ethylene activity and plant growth modulator[J]. Electronic Journal of Biotechnology,2009,12(2):1-15.
[8]吕宗友,苏衍菁,赵国琦,等. 不同防褐化措施对苏丹草愈伤诱导以及抗褐化的效果研究[J]. 草业学报,2011,20(3):174-181.
[9]Goh C J,Ng S K,Lakshmanan P,et al. The role of ethylene on direct shoot bud regeneration from mangosteen (GarciniamangostanaL) leaves cultured in vitro[J]. Plant Science,1997,124(2):193-202.
[10]张俊琦,罗晓芳. 牡丹组织培养中褐化的发生原因与防止方法的研究[J]. 沈阳农业大学学报,2006,37(5):720-724.
[11]张艳丽,刘秀贤,王 雁,等. 滇牡丹愈伤组织继代培养中的褐化防治[J]. 中南林业科技大学学报,2011,31(2):77-81.
[12]郝克伟. 乌头愈伤组织诱导中抗褐化剂的筛选[J]. 现代农业科技,2008(12):21-22.
[13]刘真华,葛 红,郭绍霞,等. 蝴蝶兰组织培养中的褐化控制研究[J]. 园艺学报,2005,32(4):732-734.
[14]肖莉杰,王丽艳,闵 丽,等. 玉米成熟胚愈伤组织诱导及褐化控制研究[J]. 玉米科学,2011,19(4):37-42.
[15]饶慧云,邵祖超,柳海宁. 抗褐化剂对葡萄愈伤组织继代培养过程中酚类物质,相关酶及其基因表达的影响[J]. 植物生理学报,2015,51(8):1322-1330.
