尿促性素的提取及其生物活性研究
2018-05-09,,,,
, , , ,
(1.济南大学-山东省医学科学院 医学与生命科学学院, 山东 济南 250022; 2. 山东省医药生物技术研究中心, 山东 济南 250062)
人绝经期促性腺激素(human memopausal gonadotropin,HMG),又名尿促性素(menotropins),是一种糖蛋白促性腺激素,包含比例约为1∶1的卵泡刺激素(follicle-stimulating hormone,FSH)和黄体生成素(luteinizing hormone,LH)2种组分,由脑垂体前叶分泌,可以从绝经期或绝经后妇女的新鲜尿液中提取得到[1]。
尿源HMG属于FSH类第一代药物,能够控制卵泡的成熟与排卵[2]。经过多年的临床实践,已经证明了HMG治疗不孕不育安全有效,常作为辅助生殖领域的促排卵药物;此外,还有治疗女性闭经[3]、月经不调、男性生殖细胞质量低下[4]等作用。
根据山东某生物制品公司的生产经验,尿源HMG粗品的提取生产,受制于尿源质量的限制,不同地区的尿源提取得到的HMG粗品生物活性不尽相同。同时,临床应用的尿促性素为高比活原料药所制,因而相关制药企业由生物制品厂收购的粗品还需经过多步色谱纯化,从而去除其中无效用杂质和病毒。HMG粗品中含有的杂质部分容易胀裂色谱柱,更会增加介质的使用量,所以在进入色谱纯化步骤前,需要通过部分沉淀法去除大量此类杂质[5-10]。
本文中初步研究丙酮对HMG粗品的进一步提纯,建立HMG中间体提纯方法,并测定、比较采自不同地区的样品的HMG中间体免疫效价及生物活性,以期为提高HMG中间体的活性及尿液资源的选择性开发提供指导。
1 材料与仪器
1.1 实验动物
Sprague Dawley大鼠,SPF级,雌性, 体质量45~55 g, 出生21~23 d, 山东省济南朋悦实验动物繁育有限公司提供。
1.2 尿源
分别于临沂、济宁、济南、泰安、德州5个尿源地,收集当天绝经期前后妇女的新鲜尿液;每个尿源地随机选取3个居民区收集;每个居民区随机选取30个提供者进行收集,用于HMG提取实验。研究已经征得当地居民同意,属自愿行为,同时要求提供者身体健康。
1.3 试剂与仪器
试剂:注射用绒促性素(human chorionic gonadotrophin,HCG),1 000 U·Vial-1,151004,上海丽珠制药有限公司;尿促性素标准品,247 FSH U·Vial-1,150524,中国食品药品检定研究所;FSH酶联免疫吸附测定试剂盒,RN55008,Biocheck;苏木精-伊红染色试剂盒,上海碧云天生物技术有限公司;牛血清白蛋白,Sigma;高岭土,石家庄长利矿产品有限公司;其他均由国药试剂公司提供。
仪器:真空干燥器,四川蜀玻(集团)有限责任公司;UV-5100型紫外可见分光光度计,上海元析仪器有限公司;Synergy HT型号酶标仪,香港基因有限公司;GNP-9050BS-Ⅲ隔水式恒温培养箱,上海新苗医疗器械制造有限公司;R135型轮转石蜡切片机,湖北泰维科技实业有限公司。
2 实验
2.1 HMG中间体的提纯
2.1.1 HMG粗品的提取
取尿液50 L,以200目(孔径约75 μm)滤网过滤,醋酸调节pH为4.0~4.5,以10 g/L的比例加入高岭土,以300 r/min转速持续搅拌2 h,抽滤收集高岭土;加入3 L蒸馏水重悬后,氨水调节pH为11.0~11.4,以300 r/min转速持续搅拌2 h后,抽滤收集洗脱液[11];重复上述步骤,将高岭土继续进行二次洗脱;合并2次洗脱液,以醋酸调节pH为8.5,以300 r/min转速搅拌1 h,静置3 h后, 抽滤去除杂蛋白。 各地区分别收集当天尿液混匀后取一批尿液, 共3批尿液, 按照上述步骤同时进行提取; 其中, 临沂各居民区分出部分尿液,略过提纯步骤,用醋酸调pH为4.3~4.8后,直接加入3倍预冷丙酮沉淀得粗品,HMG粗品沉淀收集方式与HMG中间体沉淀的收集方式相同。以此步骤获取的HMG粗品作为提纯实验组的对照。
2.1.2 HMG中间体的提纯
向合并收集的洗脱液内补加乙酸铵至洗脱液含质量分数10%的乙酸铵后,再加入1.5~2.5倍体积的预冷10%(体积分数)的乙酸铵-丙酮溶液, 搅拌后4 ℃静置8 h, 抽滤除去低溶解度的杂蛋白,得到抽提液,以醋酸调节pH为4.3~4.8,加入1.5~2.5倍体积的预冷丙酮,300 r/min充分搅拌20 min后,4 ℃静置8 h。 取硅藻土作为助滤剂铺设在抽滤漏斗上,无水丙酮润湿后,压实并抹平表面,抽滤收集沉淀,在抽滤完成后立刻向抽滤漏斗内加入300 mL无水丙酮,以抽滤的方式,借助无水丙酮完成脱水操作,脱水重复进行3次。用药匙小心刮取硅藻土表面的HMG中间体沉淀,在五氧化二磷真空干燥箱中进行干燥后即得含硅藻土的HMG中间体,-20 ℃保存备用。
2.2 HMG中间体及粗品蛋白含量测定
分析天平准确称取上述HMG中间体或HMG粗品100.0 mg,以50 mL磷酸盐缓冲溶液溶解,以10 000 r/min转速离心分离后去除内含的硅藻土,取上清备用, 采用考马斯亮蓝(Bradford)法, 按表1制作标准曲线, 进行蛋白浓度测定, 如样品的吸光值超过0.66,须进行稀释后测定。
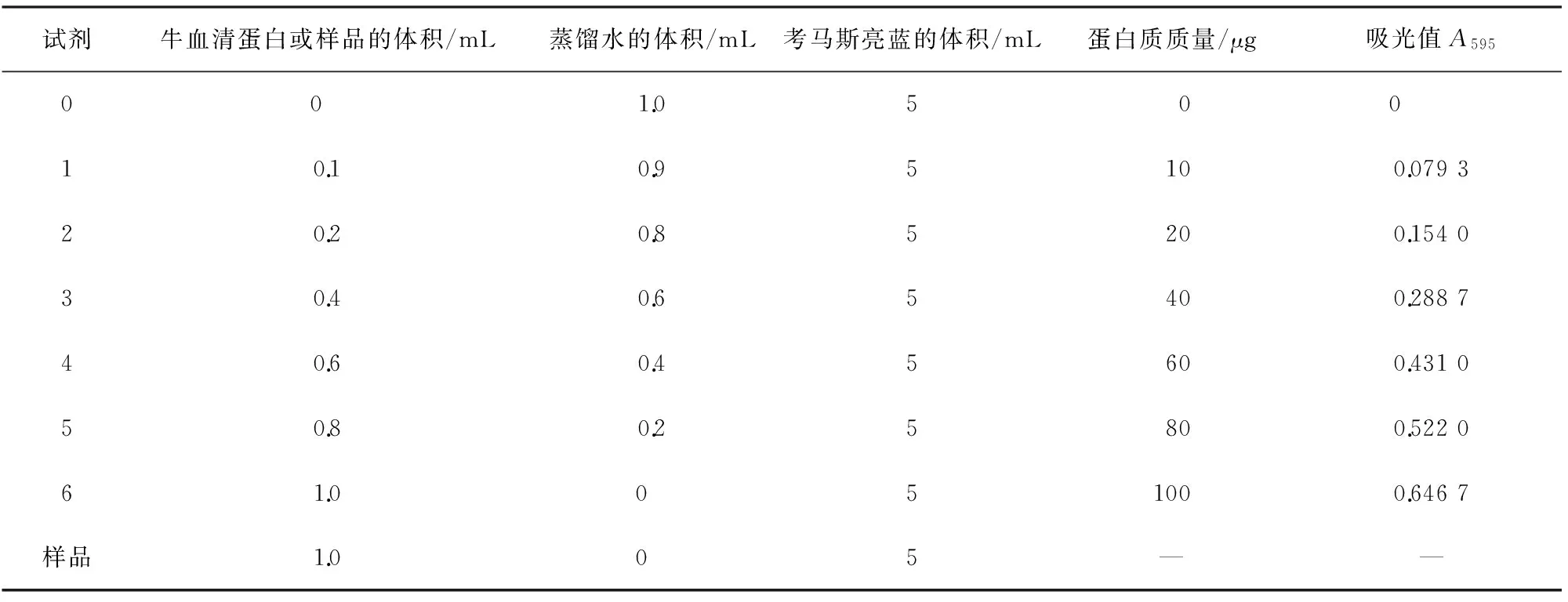
表1 蛋白标准曲线的制作及样品蛋白浓度测定
2.3 HMG中间体及粗品的免疫效价测定
按照酶联免疫吸附测定试剂盒说明书进行操作,在波长450 nm处测定反应体系吸光值,并计算结果。实际测定中设3个复孔,结果取平均值。
2.4 HMG中间体及粗品生物活性测定
2.4.1 溶液配制
标准(待测)HMG溶液配制:以含32 IU/mL HCG的生理盐水-牛血清白蛋白溶液作为溶媒,溶解HMG标准品、粗品或中间体,配制估计效价分别为1.25、2.5、5 IU/mL的低、中、高剂量HMG溶液;实验中以不含HMG的溶媒作为空白剂量组注射液,含标准HMG溶液作为对照组注射液,HMG粗品或中间体溶液作为实验组注射液。
全部的溶液均采用孔径0.22 μm的滤膜进行除菌过滤,存储待用,其中的HMG中间体及粗品待测液,各地分别由3个居民区提取的HMG中间体或粗品粉末等量均匀地溶解于溶媒得到,即5个地区共准备5份待测液,并采用孔径0.22 μm滤膜除菌过滤。
2.4.2 实验设计
将198只大鼠,适应性喂养3 d后,按照1个空白剂量组、3个对照组、18个实验组,共22组,每组9只,进行随机分组。
2.4.3 数据收集处理
按照每只大鼠每天0.4 mL的量,每天固定同一时间,连续3 d,进行颈部皮下注射。最后一次注射24 h后,处死大鼠,称取整只体质量(精确到0.001 g),摘取双侧卵巢,剥除附着的组织,吸干附着的水分,称取双侧卵巢质量(精确到0.001 g)。计算每10 g大鼠体质量的双侧卵巢质量[12-14]。
采用《中国药典(2015)》的方法,以每10 g大鼠体质量的双侧卵巢质量为反应值Y,按照生物检定法中的量反应平行线测定法计算效价。具体计算分析使用BS 2000软件。
2.5 给药后大鼠卵巢组织形态学观察
大鼠卵巢摘取后, 以体积分数为10%的福尔马林固定液固定24 h, 再流水冲洗24 h, 经常规脱水、 浸蜡、 包埋后, 4 μm厚度精度切片, 60 ℃烤片4 h。 常规脱蜡水化后(显微镜掌控), 苏木素染色20~30 min, 体积分数为1%的浓盐酸-无水乙醇溶液分化2 s, 蒸馏水反蓝,伊红染液染色10 min,无水乙醇脱水,二甲苯透明,稍晾干后中性树胶封片观察[15-16]。
2.6 统计学处理
所有数据经过SPSS 22.0版本的统计分析软件处理采用单因素方差分析,用均数±标准差(x±s)表示。
3 结果与讨论
3.1 HMG中间体及粗品溶液的蛋白含量
蛋白浓度标准曲线如图1所示,标准曲线方程Y=0.006 4X+0.018 8,r2=0.994 4,吸光值A595代入方程计算,结果见表2。

图1 蛋白含量测定标准曲线表2 各地尿促性素中间体及粗品的平均蛋白含量

样品来源项目蛋白浓度/(mg·L-1)蛋白含量/mg临沂 1456.12±67.7272.81济宁 1429.74±68.5171.49济南 1096.41±97.0654.82泰安 1204.10±88.3560.21德州 1465.64±93.2773.28粗品对照1105.41±94.3355.27
3.2 HMG中间体及粗品的免疫效价和生物活性
作免疫效价测定标准曲线如图2所示,曲线方程Y=0.016 16X+0.029 63,r2=0.996 8,吸光值A450代入计算可得免疫效价。HMG中间体及粗品的免疫效价与生物活性测定结果见表3。

图2 免疫效价测定标准曲线
实验测定结果显示, 提取的HMG中间体, 来自济南的样品的免疫效价最高, 其他4地的含量在0.9~1.1 IU/mg之间; 同样, 来自济南的样品的HMG中间体生物活性也最高,临沂、 济宁两地的次之; 同时, 除临沂外,其他4地样品的HMG中间体生物活性均低于免疫效价。与HMG粗品相比,经过提纯的HMG中间体,免疫效价与生物活性均有明显提高。本文中的生物活性测定结果的可信限率均低于45%,实验误差也符合《中国药典(2015)》的相关规定。
3.3 经HMG中间体注射卵巢形态学变化
肉眼观察,空白组大鼠卵巢色泽红润,表面无囊状扩张的卵泡;相对于空白组,随着HMG剂量的增加,实验组突出于卵巢表面的囊状卵泡逐渐增加,同时卵巢的整体大小、质量也都在逐渐增加,以高剂量组尤为明显。苏木精-伊红染色法(HE)染色显微镜下观察,如图3—4所示。空白组可见卵巢组织内处于各个发育时期的卵泡以及一定数量的黄体;颗粒细胞排列有序,卵泡膜细胞、间质细胞未见增生。对于实验组和对照组,随着HMG剂量的增加,同一放大倍数下可见,卵泡的大小显著增加,呈现多囊性扩张;各发育阶段卵泡、黄体数量减少,颗粒细胞层数减少到1~3层,同时,部分较大卵泡中卵母细胞或放射冠消失;卵泡膜细胞增生,卵泡膜增厚。

表3 各地尿促性素中间体及粗品的免疫效价及生物活性
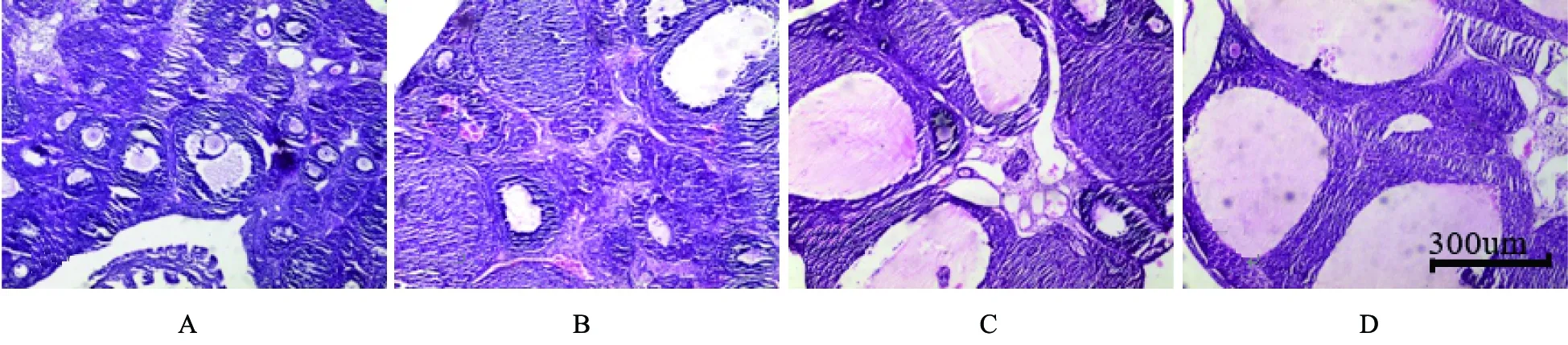
注:A为空白组; B—D分别对应低、中、高剂量对照组。图3 卵巢形态学变化(HE-染色,X40)

注:A1—A3,临沂(低中高剂量组);B1—B3,济宁(低中高剂量组);C1—C3,济南(低中高剂量组);D1—D3,泰安(低中高剂量组);E1—E3,德州(低中高剂量组)。图4 卵巢形态学变化(HE-染色,X40)
4 结论
对比传统的尿促性素粗品提取工艺,经过丙酮二级提纯处理的尿促性素中间体质量有明显提高。
对比原尿免疫效价、尿促性素中间体免疫效价和生物活性能够发现,原尿的免疫效价较高的尿源,提取所得的尿促性素中间体免疫效价和生物活性相对也较高;另外,尿促性素中间体免疫效价普遍高于生物活性,相对的差值在0.10~0.36之间,鉴于免疫效价检测的高效率和低成本,生产上完全可用尿促性素免疫效价对产品的质量进行估计、监控,也可为上游尿促性素粗品的供应链厂家减少生产成本。
不同地区提取的尿促性素中间体,均以严格统一的工序进行提取,所以彼此间免疫效价、生物活性差异应是源于各地人群尿液中FSH含量的差异,通俗来讲,即尿源质量良莠不齐,这就要求生产上严格把控尿液的来源,以期控制最终成品的质量。而人群尿液中FSH含量的差异,可能是生活环境、饮食习惯的不同所致。
大鼠的卵巢组织HE染色观察,实验组经尿促性素中间体溶液注射的大鼠卵巢形态明显改变,与尿促性素标准品对照组的形态改变一致,卵巢整体变大、质量增加,也验证了生物测定法的测定指标的有效性。同时,卵巢内卵泡的改变也与相关文献报道一致[15-16],并随中间体含量的增加而愈发明显。
参考文献:
[1] KANG S, ZHAO X W, WANG N, et al. Gonadotropin preparations: past, present, and future perspectives [J]. Fertility & Sterility, 2008, 90(5):13-20.
[2] 刘金钏, 彭贵子, 卢智俊, 等.重组人促卵泡激素研究进展[J]. 中国药科大学学报, 2013, 44(3):283-288.
[3] CHECK J H. Minimal and natural stimulations for IVF[M]//WU B. Advances in Embryo Transfer. Rijeka: InTech, 2012: 37436-37442.
[4] 徐璐, 熊国保, 胥杜娟, 等.少弱精症的中西医治疗现状与进展 [J]. 现代诊断与治疗, 2009, 20(2):82-85.
[5] 王丽, 施晓春, 刘翠珍, 等. 乙酸铵提纯尿促性素的方法: 10598002.6[P]. 2012-12-30.
[6] 张富源, 殷小崴, 赵梦喆, 等. 一种尿促性素的提纯方法: 10778613.2[P]. 2015-11-13.
[7] 张样柏.一种从人尿中提取促性腺激素的方法: 10362136.7[P]. 2014-07-28.
[8] 刘乃山, 刘君, 刘翠珍.一种高效价尿促性素的提取及纯化方法:10832517.1[P].2015-11-26.
[9] 刘乃山, 刘君, 葛翠凤, 等. DEAE柱层析提纯尿促性素的技术方法: 10648024.3[P].2013-11-27.
[10] BALANIAN L, CANCELA M, WOLFENSON C, et al. A process for obtaining hmg-up (human menopausal gonadotropin with ultra-purity grade) and a composition free of contaminants: WO, 177751[P]. 2015-5-21.
[11] DONINI P, PUZZUOLI D, MONTEZEMOLO R. Purification of gonadotrophin from human menopausal urine [J]. Acta Endocrinologica, 1964, 45(3):321-328.
[12] 国家药典委员会. 中华人民共和国药典: 4部[S]. 北京: 中国医药科技出版社, 2015: 171-172.
[13] 李湛军, 李心欣, 梁成罡. 促卵泡激素体内生物活性测定及其各国药典方法比较[J]. 药物分析杂志, 2014, 101(4):727-732.
[14] 吴彦霖, 张媛, 唐黎明, 等. 第4批人绝经尿促性腺素(HMG)国家标准品的协作标定[J]. 药物分析杂志, 2016, 36(8): 1487-1494.
[15] 孔凡静. MicroRNA在PCOS大鼠模型卵巢中的表达[D]. 武汉: 华中科技大学, 2011.
[16] 郭洪胜. PCOS动物模型及PCOS患者CYP19、GATA-4、FSHR基因表达的初步研究[D].广州: 南方医科大学, 2010.
