基于光谱和气味特征信息的霉变大米无损检测
2018-05-09赵天霞魏颖琪
沈 飞 张 斌 刘 潇 黄 怡 赵天霞 魏颖琪
(江苏高校现代粮食流通与安全协同创新中心;江苏省高校粮油质量安全控制及深加工重点实验室;南京财经大学食品科学与工程学院,南京 210023)
大米是稻谷经清理、砻谷、碾米、成品整理等工序后制成的成品,相较于有稻壳保护的稻谷,大米更易受霉菌侵染而霉变。大米霉变不仅造成粮食损失及品质下降,其菌落代谢产生的黄曲霉毒素、伏马菌素等真菌毒素更是给人畜健康带来严重的威胁[1-4]。因此,实现大米霉变的早期快速鉴定尤为重要。
目前,谷物霉变的检测方法主要有荧光染色法[5]、干片培养法[6]、微生物酶活性法[7]、高效液相色谱法[8]、免疫层析法[9]等。然而,这些传统的霉变检测方法普遍较为繁琐、耗时,难以满足现场实时检测的需求。以近、中红外光谱和电子鼻分析技术为代表的无损分析技术,具有无需样品预处理、测定时间短、不使用化学试剂、可同时测定多种目标参数等优点,在谷物霉菌侵染快速鉴定方面获得了越来越广泛的应用。
Fu等[10]利用近红外光谱结合PCA、 LDA和PLS-DA数据处理方法对向日葵的霉变状况及货架期进行了分析,其中PLS-DA霉变识别模型的判别准确度最高,可达到100%。Wang等[11]利用近红外光谱结合PLS、ANN方法对健康大豆和受真菌感染大豆进行了区分,发现神经网络模型的分类准确度要高于PLS,验证集总体准确率达94.6%。Du等[12]利用中红外光谱技术对感染白粉病的树莓样品进行识别,发现健康树莓叶片和染病叶片的光谱特征存在显著差异。殷勇等[13]利用电子鼻对玉米霉变程度进行了分析,发现多特征值组合的鉴别效果优于单特征值,使用3个特征值时鉴别效果最佳,正确率达96%以上。
为进一步探索近、中红外光谱与电子鼻分析技术的应用潜力,比较不同方法用于粮食样品检测的优劣,本研究以大米为研究对象,分析其受霉菌感染所产生的特征光谱和气味信息,结合多元统计分析方法,建立大米受不同霉菌侵染种类及侵染程度的同步检测模型,并比较不同技术所建模型性能的差异,以期为实现粮食样品霉菌状态的快速识别和早期预警提供参考。
1 材料与方法
1.1 实验材料及样品处理
福临门新鲜粳米样品(产地:江苏)购自当地超市,放于4℃冷藏储存备用。选择4种谷物中常见产真菌毒素标准菌株:黄曲霉3.17、黄曲霉3.3950、寄生曲霉3.3950、赭曲霉3.6486(中国北京北纳创联研究院),将菌株培养后制成浓度约105CFU/mL霉菌的孢子菌液备用。
将大米经80 ℃、2h热烘灭菌处理,测定样品初始水分含量,加无菌水将样品水分调节至20%,密封于4 ℃冷藏2 d平衡水分。将大米样品分为150份进行菌液接种,每份准确称取150 g。每种菌液接种30份大米样品,在每份大米样品表面接种5 mL相应菌液,余30份大米样品作为对照组并加入5 mL无菌水,搅拌均匀后将大米分别放置不同的人工气候箱中并于28 ℃、80%RH的储藏10 d。
1.2 实验仪器
MB3600型傅里叶变换近红外光谱仪:加拿大Quebec公司;InGaAs光电检测器:加拿大ABB-Bomem公司;Tensor27型傅里叶变换红外光谱仪:德国Bruker公司;ZnSe衰减全反射附件:美国Pike公司;Fox 3000型电子鼻:法国Alpha MOS公司。
1.3 方法
1.3.1 近、中红外光谱采集
样品从接种霉菌起,选取时间节点0、2、4、7、10 d,随机选取受4种霉菌侵染大米各6份,并从对照组中随机选取6份进行光谱和气味信息采集。为了使霉菌分布更加均匀,采用高速万能粉碎机将每份样品磨成粉状,过40目筛,样品放入密封袋中于4 ℃冷藏备用。在检测前将冷藏的样品置于室温下约1 h直至样品达到室温。
运用MB3600型傅里叶变换近红外光谱仪和InGaAs 光电检测器采集样品近红外光谱信息。扫描波数范围为12 000~4 000 cm-1,分辨率为4 cm-1,扫描次数为64次,样品重复扫描3次,采集模式为漫反射。运用Tensor27型傅里叶变换中红外光谱仪45 ℃ ZnSe 衰减全反射附件( ATR )采集样品的中红外光谱信息。取约1 g样品置于ATR 附件的ZnSe 晶体上,以空气为背景进行检测,样品重复扫描3次。扫描波数范围为4 000~600 cm-1,分辨率为4 cm-1,扫描64次。
1.3.2 电子鼻信号采集
取5.00 g样品于20 mL顶空瓶中,每个样品6个平行。电子鼻检测器参数条件,载气流速:150 mL/min,采样体积:1 mL,采样速度:1 mL/s,采样时间:60 s,采样频率:1次/s,保温室温度:60 ℃,保温时间:120 s,振荡速度:500 r/min。
1.3.3 样品霉菌菌落总数测定
在不同储藏时间节点,从受每种霉菌感染的6份样品中随机选取2份样品进行霉菌菌落总数的测定,参照国标GB/T 4789.15—2010进行测定。
1.4 实验数据处理
采用TQ Analyst v 6.2.1 和SPSS v16.0软件对大米的光谱和电子鼻气味信息数据进行分析处理。通过主成分分析PCA、线性判别分析LDA建立定性区分模型,运用交互验证、外部验证法和判别正确率等指标对模型性能进行综合评价。
2 结果与分析
2.1 大米样品中菌落总数的变化
受4种不同霉菌侵染大米样品中平均菌落总数变化如图1所示。结果表明,随储藏时间增加,大米霉变程度不断加深。由图1可知,4种霉菌在0~4 d时生长较为平缓,此时的霉菌生长处于延滞期并需要适应新的环境。但在4~10 d时,随着储藏时间的增加,大米中霉菌生长处于对数期,霉菌菌落总数呈较快的递增趋势,到后期大米样品已发生严重霉变,4种霉菌生长速度整体差异不大。
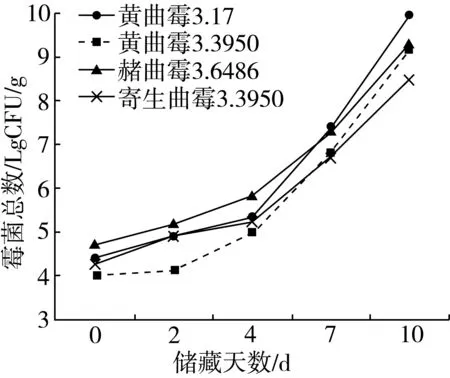
图1 受4种霉菌感染大米样品中霉菌菌落总数变化趋势
2.2 近红外和中红外光谱分析

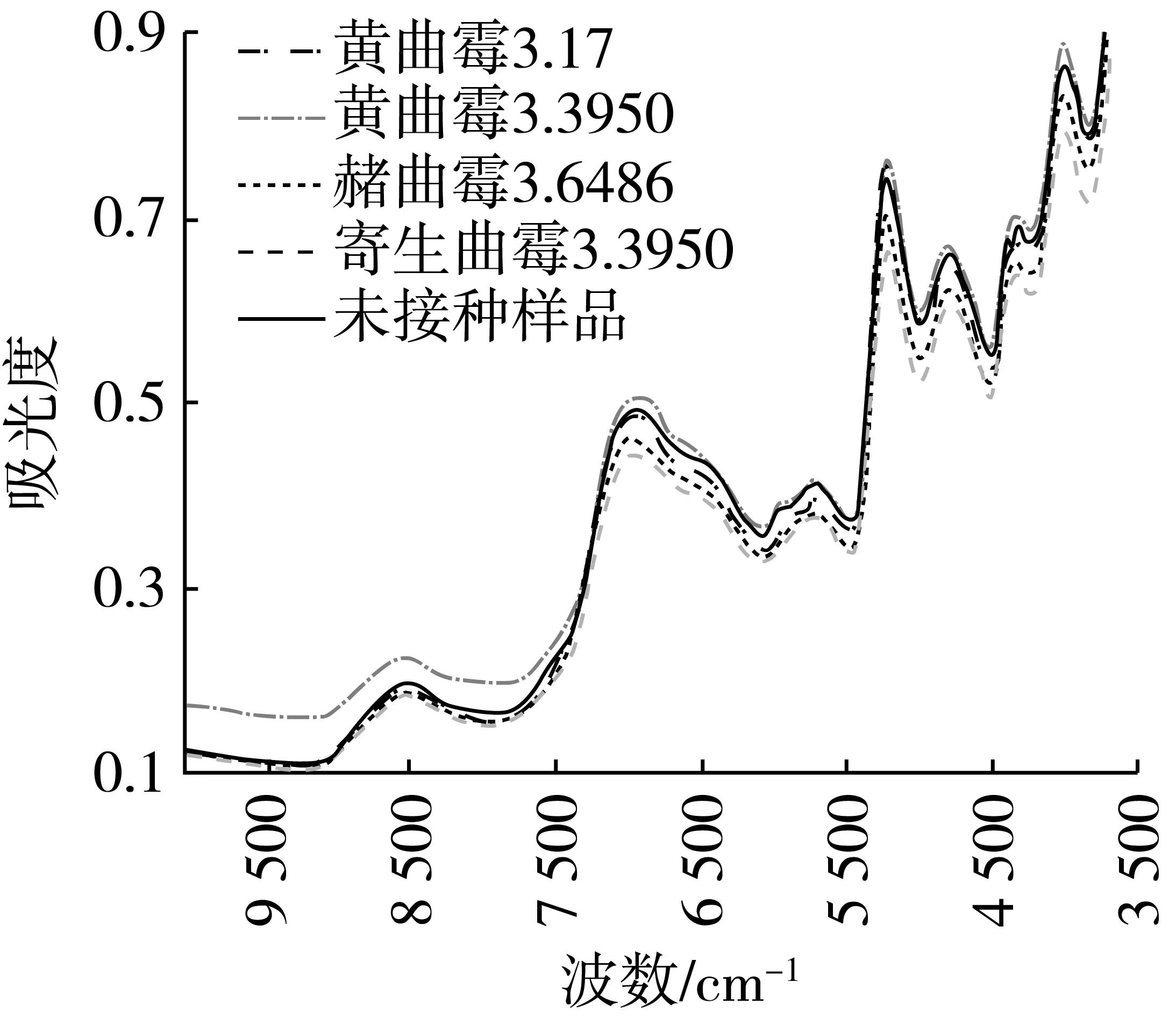
图2 受4种有害霉菌侵染大米样品的近红外原始光谱图

图3 受4种有害霉菌侵染大米样品的中红外原始光谱图
接种不同霉菌大米在4 000~600 cm-1波段范围内中红外光谱整体也较为相似(图3),但光谱吸收值同样存在一定差异。其中3 290 cm-1处对应于水分子中—OH的拉伸振动,霉菌生长过程需要水分参与,由图可知不同霉菌样品对水分影响较大。1 600~1 555 cm-1附近对应于氨基酸中的COO的伸缩振动,而1 640和1 538 cm-1附近则与蛋白质C—N伸缩振动有关。观察可知,感染霉菌样品在这两处发生了较为明显变化。原因可能在于霉菌中的水解酶导致大米蛋白质发生水解反应。其中,寄生曲霉组吸光度最小,赭曲霉次之,黄曲霉的吸光度最大,可能是寄生曲霉对蛋白质的消耗较大,黄曲霉对蛋白质的消耗较少,还需要进一步研究。900~1 300 cm-1波段处吸收主要由淀粉引起[18-20]。霉菌生长代谢所需要的能量主要通过水解淀粉等糖类物质提供,因而不同霉菌对光谱特征产生不同影响。
2.3 电子鼻响应信号分析
图4为大米样品在10 d的电子鼻响应信号雷达图。由图4可知,受不同霉菌侵染大米的电子鼻原始信号整体较为相似,但存在一定差异。观察可知,传感器T30/1、P10/1、P10/2、P40/1对于受不同霉菌侵染的大米产生的挥发性物质最为敏感,传感器T70/2、PA/2较敏感。根据各传感器特性分析可知[21],受不同霉菌侵染的大米产生碳氢化合物、芳香族化合物、有机胺等挥发性物质存在一定差异,观察可得,传感器P10/1、P10/2、P40/1对感染黄曲霉3.17和赭曲霉3.648 6大米最敏感,而感染黄曲霉3.395 0大米敏感度较低。总之,不同霉菌代谢产生的挥发性气味特征差异为电子鼻的分析检测提供了可能。
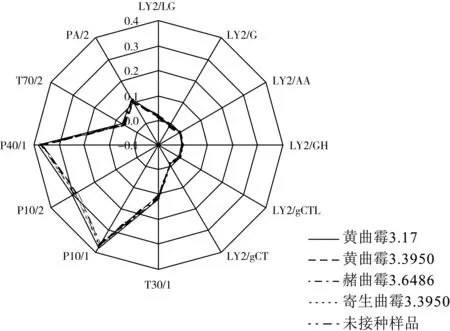
图4 受4种有害霉菌感染大米样品的电子鼻信号雷达图
2.4 主成分分析结果
基于近红外、中红外光谱和电子鼻信号的大米样品在不同储藏阶段(不同霉变程度)的主成分得分图如图5所示。总体而言,不同霉变程度大米样品在主成分得分图上区别并不十分显著,表明霉菌感染引起的变化可能十分复杂,不同霉菌生长代谢所产生的物理、化学和气味变化可能存在相互干扰。
仔细观察可知,不同霉变程度样品的近、中红外光谱的主成分数据点分布存在一定规律:在0、2 d数据点分布较为集中且存在部分重叠,均处于右侧位置,可能因为大米刚受霉菌侵染,短期内并没有很大变化;4 d数据点分布分散且与7 d有部分重叠,这可能是因为霉菌在接种之后已适应环境开始生长;7、10 d数据点分布较为分散且相互有重叠,主要位于中间和偏右侧位置,这可能与霉菌的不同生长状况有关。电子鼻信号的主成分数据点分布优于近/中红外光谱:0、2 d数据点分布集中且相邻,位于上面偏右位置,这可能是因为大米受霉菌侵染初期霉菌生长较缓,产生的气味物质相似;4 d数据点分布较广且分散,但鲜有重叠,这可能是因为霉菌已适应环境开始生长,产生不同的挥发性物质;7 d数据点分布较为集中,位于中部右侧,与其他时间节点均有少量重叠,这可能是因为这一时段霉菌大量繁衍,霉菌处于不同的生长状况,产生的气味物质有所相似;10 d时数据点分布集中,位于下方右侧。

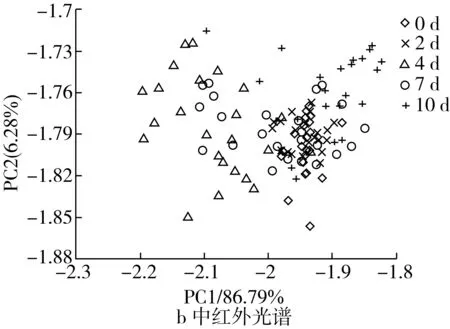
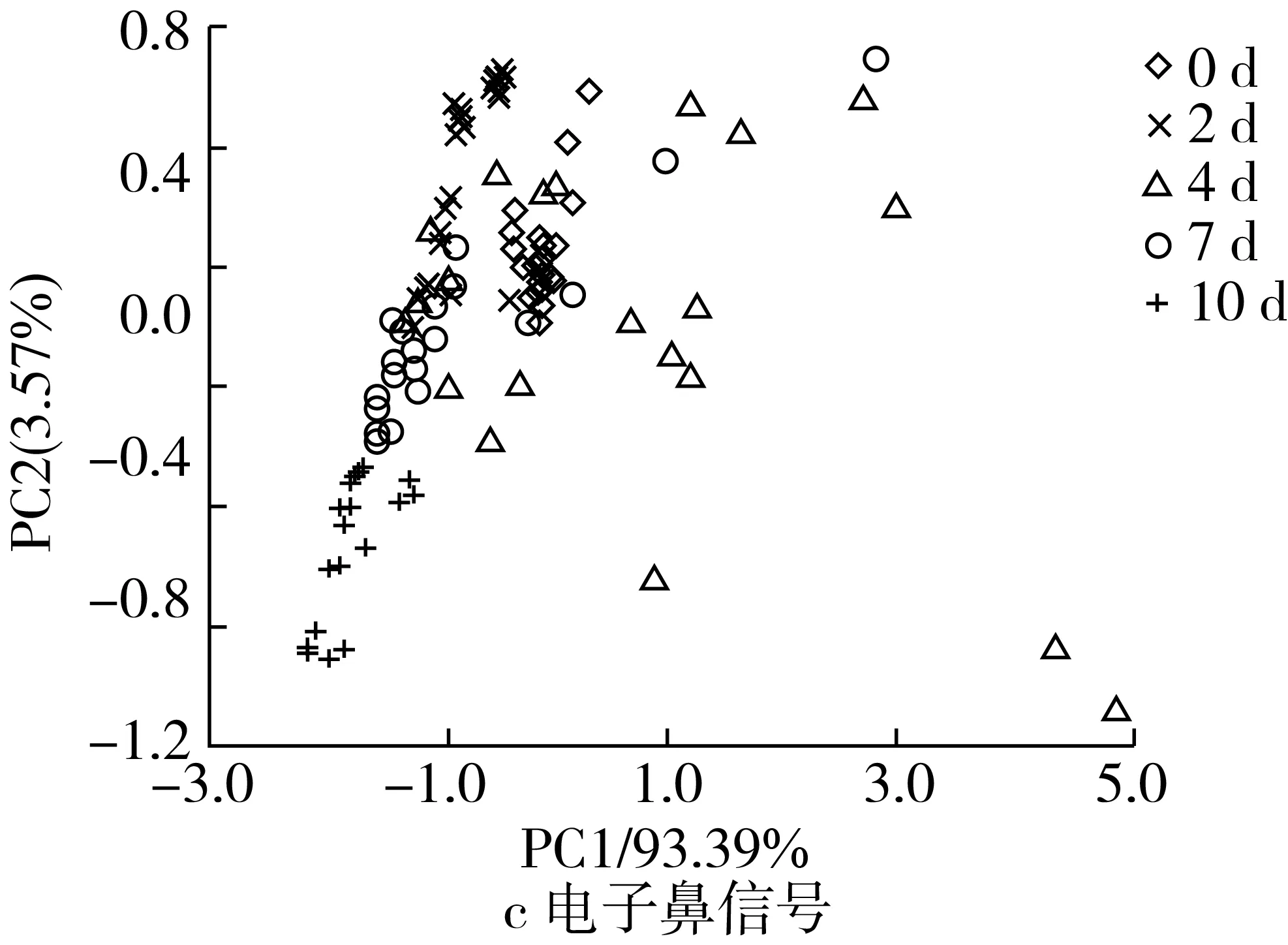
图5 不同霉变程度大米样品的主成分分析结果
2.5 判别分析结果
2.5.1 受不同霉菌感染大米样品LDA模型判别分析结果
运用从主成分分析中提取的前10个主成分得分建立LDA判别模型。从空白和每种菌株感染样品中随机选取2/3样品建立模型,其余1/3样品用于验证。将所有样品划分为空白和受4种霉菌感染共5类,表1为不同储藏阶段空白与受4种不同有害霉菌感染大米样品的判别结果。由表1可知,3种方法建模集的整体判别正确率较高,达98.0%以上,表明不同霉菌与其所产生的光谱和气味信息存在较高相关性。预测集中,近红外和中红外判别错误率较高,且主要集中在前期(0和2 d),主要由于在大米感染霉菌初期,霉菌活动引起的光谱差异还未显著。到感染后期,样品光谱存在较大差异,正确率达90%以上。电子鼻方法的预测精度最高,整体准确率为92.0%,表明霉菌代谢产生的挥发性成分差异比光谱信息更加显著。结果表明,虽然本研究中所接种的霉菌均为曲霉菌株,但其代谢所产生的光谱和气味信息存在一定差异,可实现不同菌属的有效区分。

表1 大米样品受4种不同有害霉菌感染的LDA模型的建立与验证结果
2.5.2 不同储藏阶段大米样品LDA模型判别结果
根据储藏时间的不同,将大米样品划分为5个霉变阶段。表2为不同霉变阶段大米样品的LDA模型判别统计结果。总体而言,在对受单一霉菌感染大米样品的霉变状态进行快速识别时,近红外、中红外和电子鼻技术均取得了较高的精度。建模集的正确率均达到100%,预测集中,仅个别样品出现误判,表明基于光谱和气味信息进行霉变状态快速分析具有可行性。对受4种霉菌感染的大米霉变状态进行分析时,由于不同霉菌之间产生的相互干扰,模型性能有所下降。预测集中,在近红外光谱所建模型中,40个样品有8个被误判,导致其正确率仅为80.0%。由于中红外光谱法能获得样品间的细微信息,其模型性能有所提升,达87.5%。相反,基于气味信息的电子鼻分析技术取得了较优的分析精度。在不同霉菌感染所产生的气味干扰中,对大米霉变程度获得了95.0%的预测精度,表明电子鼻在大米霉变程度的快速识别中可能更加可靠。

表2 接种不同有害霉菌的样品在不同储藏时间DA模型的建立与验证结果
3 结论
本研究利用近红外、中红外和电子鼻无损分析技术,对受不同霉菌感染的大米样品在储藏期内的光谱和气味信息进行了检测分析,并结合多元统计分析方法建立了大米有害霉菌侵染种类与霉变程度的同步识别方法。主成分分析结果显示在储藏期间大米样品的光谱和气味信息变化存在一定规律,不同霉变状态样品能够得到区分。运用线性判别分析分别对侵染单一霉菌的大米样品及全部样品进行建模。其中,电子鼻技术对大米受不同霉菌感染及霉变状态的识别率分别达到92.0%和95.0%,近红外光谱为86.0%和80.0%,中红外光谱为86.0%和87.5%,表明利用光谱和气味信息实现大米霉变的快速早期识别具有可行性,电子鼻技术在霉变大米气味特征识别方面更具优势,有实际应用潜力。
[1]李科静. 大米中霉菌的微波杀菌工艺及机理研究[D]. 长春:吉林大学, 2015
LI J K. Study on microwave sterilization technology and mechanism of mould in rice [D].Changchun:Jilin University, 2015
[2]GHOLAMPOUR AZIZI I, GHADI H, ROUHI S. Ochratoxin A analysis in rice samples of different cities of Mazandaran (a province in Northern Iran)[J]. Nutrition and Food Science, 2014, 44(3): 223-229
[3] KIM S A, LEE M K, PARK T H, et al. A combined intervention using fermented ethanol and supercritical carbon dioxide to control Bacillus cereus and Bacillus subtilis in rice [J]. Food Control, 2013, 32(1): 93-98
[4]张强. 基于近红外光谱技术的稻谷中霉菌和毒素检测研究[D]. 哈尔滨:东北农业大学, 2015
ZHANG Q. Detection of fungi and toxins in paddy rice based on near-infrared spectroscopy [D].Haerbin:Northeast Agricultural University, 2015
[5] KOUICHI T, NOBUYASU Y, TAKASHI B, et al. Rapid enumeration of low numbers of moulds in tea based drinks using an automated system [J]. Food Microbiology, 2011, 145(1): 365-369
[6] TERAMURA H, USHIYAMA M, OGIHARA H. Journal of Microbiological Methods, 2015, 109: 16-19
[7]蔡静平. 储粮微生物活性及其应用的研究[J]. 中国粮油学报, 2004, 19(4): 76-79
CAI J P. Studied on microbe activity of stored grains and its application[J]. Journal of the Chinese Cereals and Oils Association, 2004, 19(4): 76-79
[8]朱臻怡, 宋欢, 冯民, 等. 花生及其制品中多种霉菌毒素残留同时测定方法[J]. 化学分析计量, 2012, 21(6): 40-43
ZHU Z Y, SONG H, FENG M, et al. Method for the simultaneous determination of various mycotoxins residues in peanut and its products [J]. Chemical Analysis and Meterage, 2012, 21(6): 40-43
[9]王晶, 张鹏, 张艺兵, 等. 免疫亲和层析净化荧光光度法快速测定酱油及醋中黄曲霉毒素 [J].中国食品卫生杂志, 2003, 15(5): 412-414
WANG J, ZHANG P, ZHANG Y B, et al Determination of aflatoxins in soy sauce and vinegar by fluorometry coupled with immunoaffinity column [J]. Chinese Journal of Food Hygiene, 2003, 15(5): 412-414
[10]FU H, JIANG D, ZHOU R, et al. Predicting mildew contamination and shelf-life of sunflower seeds and soybeans by fourier transform near-infrared spectroscopy and chemometric data analysis [J]. Food Analytical Methods, 2017, 10(5): 1597-1608
[11] WANG D, DOWELL F E, RAM M S, et al. Classification of fungal-damaged soybean seeds using near-infrared spectroscopy [J]. International Journal of Food Properties, 2004, 7(1): 75-82
[12] DU C, ZHOU J. Fouriertransform mid-infrared photoacoustic spectroscopy for presymptomatic detection of powdery mildew infection inRubuscorchorifoliusL[J]. Spectroscopy Letters, 2015, 48(8): 610-615
[13]殷勇, 郝银凤, 于慧春. 基于多特征融合的电子鼻鉴别玉米霉变程度[J]. 农业工程学报, 2016, 32(12):254-260
YIN Y, HAO Y F, YU H C, et al. Identification of corn mildew degree by electronic nose based on multi-feature fusion [J]. Journal of Agricultural Engineering, 2016, 32(12) :254-260
[14]李静萍, 谢邦昌. 多元统计分析方法与应用[M]. 北京:中国人民大学出版社,2005
LI J P, XIE B C. Multivariate statistical analysis method and its application [M]. Beijing: Renmin University Press,2005
[15]黄瑞娟. 红外光谱技术在食品检测中的应用[J]. 现代测量与实验室管理,2015(1):9-14
HUANG R J. Application of infrared spectroscopy technology in food detection[J]. Modern Measurement and laboratory management, 2015(1):9-14
[16]陆婉珍. 现代近红外光谱分析技术 [M]. 北京:中国石化出版社,2006
LU W Z. Modern near infrared spectroscopy technology [M]. Beijing: China Petrochemical Press, 2006
[17]HELM D, LABISCHINSKI H, NAUMANN D. Elaboration of a procedure for identification of bacteria using Fourier-Transform IR spectral libraries: a stepwise correlation approach [J]. Journal of Microbiological Methods, 1991, 14(2): 127-142
[18]HELM D, LABISCHINSKI H, NAUMANN D. Elaboration of a procedure for identification of bacteria using Fourier-Transform IR spectral libraries: a stepwise correlation approach [J]. Journal of Microbiological Methods, 1991, 14(2): 127-142
[19]NIE M, ZHANG W Q, XIAO M, et al. FT-IR spectroscopy and artificial neural network identification ofFusariumspecies[J]. Journal of Phytopathology, 2007, 155(6):364-367
[20]HELL J, PRÜCKLER M, DANNER L, et al. A comparison between near-infrared (NIR) and mid-infrared (ATR-FTIR) spectroscopy for the multivariate determination of compositional properties in wheat bran samples [J]. Food Control, 2016, 60: 365-369
[21] 沈飞, 吴启芳, 魏颖琪, 等. 谷物霉菌挥发性物质的电子鼻与GC-MS检测研究[J]. 中国粮油学报, 2016, 31(7): 148-152,156
SHEN F, WU Q F, WEI Y Q, et al. Electronic nose and GC-MS detection of volatile substances produced by mould strains [J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(7): 148-152,156.
