利用酶法测定稻米支链淀粉精细结构
2018-05-09周慧颖欧阳林娟彭小松朱昌兰陈小荣傅军如边建民胡丽芳贺浩华贺晓鹏
周慧颖 欧阳林娟 彭小松 朱昌兰 陈小荣 傅军如 边建民 胡丽芳 贺浩华 贺晓鹏
(江西农业大学农学院作物生理生态与遗传育种教育部重点实验室;双季稻现代化生产协同创新中心,南昌 330045)
支链淀粉作为稻米胚乳最主要的组分,是稻米品质和淀粉理化特性的主要决定因素[1-3]。支链淀粉的精细结构包括平均链长(CL)、平均外部链长(ECL)、平均内部链长(ICL)、A∶B值(每条B链上所具有的A链数目)、链长和链长分布等参数[4]。目前对稻米支链淀粉精细结构的研究主要是利用凝胶层析法、荧光糖电泳法(基于毛细管电泳、基于测序仪)等测定支链淀粉的链长和链长分布[5-7]。利用酶法测定支链淀粉结构是采用β-淀粉酶、异淀粉酶、普鲁兰酶这3种酶对支链淀粉进行酶解,从而获得β-淀粉酶水解率、CL、ECL、ICL、A∶B值等支链淀粉结构参数,这些参数可更好地反映支链淀粉的精细结构。已有研究利用酶法对葛根[8]、银杏[9]及慈姑[10]的支链淀粉结构进行了测定,而在水稻中利用酶法测定支链淀粉的结构鲜见报道。此外,前人在利用酶法测定葛根、银杏及慈姑的支链淀粉结构的具体过程中,酶解反应条件存在一定差异,如在测定β-淀粉酶水解率时采用的β-淀粉酶用量分别是500、500、325 U,测定A∶B值时采用的异淀粉酶用量分别是2、80、80 U,且对酶解的最佳反应时间没有明确。本试验对酶法测定稻米支链淀粉精细结构的酶解反应条件进行了摸索和优化,以期对稻米支链淀粉结构的测定和特性的研究提供参考。
1 材料和方法
1.1 材料和仪器
籼稻品种为昌恢121、南京11、桂朝2号、昌恢T025;粳稻为宁粳1号、常粳06-3、武育粳7号、日本晴。昌恢121、昌恢T025为江西农业大学育成的恢复系材料,其他品种均引自南京农业大学。同期成熟种子收获后晒干,存放3个月以上,用精米机充分研磨成精米后进一步磨成米粉,采用贺晓鹏等[11]的方法进行支链淀粉的分离和纯化,得到纯支链淀粉粉末后密封保存。
β-淀粉酶(EC 3.2.1.2)、普鲁兰酶(EC 3.2.1.41)、异淀粉酶(EC 3.2.1.68):Sigma-Aldrich公司。
SCINO-CT410旋风式样品磨:瑞典FOSS公司;TU-1810D紫外可见分光光度计:北京普析公司。
1.2 β-淀粉酶酶解反应条件的优化及稻米支链淀粉β-淀粉酶水解率的测定
每个供试品种取5 mL离心管4个,加入纯化的支链淀粉0.1 g分散于5 mL浓度为0.02 mol/L,pH 5.0的醋酸缓冲溶液中,分别加入300、400、500、600 U的β-淀粉酶,同时加入1~2滴甲苯防止微生物生长,37 ℃水浴保温约48 h后,将反应液沸水浴灭酶25 min,冷却后测定体系中的还原力(麦芽糖当量),以还原力不再增加的最低酶用量为优化酶用量。每个样品重复测定3次。
每个供试品种取5 mL离心管1个,加入纯化的支链淀粉0.1 g分散于5 mL浓度为0.02 mol/L,pH 5.0的醋酸缓冲溶液中,加入优化酶用量的β-淀粉酶,同时加入1~2滴甲苯防止微生物生长,37 ℃水浴保温,测定4 h至60 h不同反应时间点酶解反应所产生的还原力,以还原力不再增加的最短时间为优化反应时间。每个样品重复测定3次。
在酶用量和反应时间优化的基础上,测定反应体系中的总糖和还原力,重复3次,以不加酶的样品同样处理作为对照,计算稻米支链淀粉β-淀粉酶水解率:
β-淀粉酶水解率=还原力(麦芽糖当量)×100/总糖 (麦芽糖当量)
1.3普鲁兰酶反应条件的优化及稻米支链淀粉CL、ECL、ICL的测定
每个供试品种取5 mL离心管4个,称取22 mg纯支链淀粉,加入浓度为0.05 mol/L, pH 5.0的醋酸缓冲液5 mL,充分混匀后加入2、4、6、8 U的普鲁兰酶,液面以1~2滴甲苯防止微生物生长,37 ℃水浴保温约24 h后,将反应液沸水浴灭酶20 min,冷却后测定体系中的还原力,以还原力不再增加的最低酶用量为优化酶用量。每个样品重复测定3次。
每个供试品种取5 mL离心管1个,称取22 mg纯支链淀粉,加入浓度为0.05 mol/L, pH 5.0的醋酸缓冲液5 mL,充分混匀后加入优化酶用量的普鲁兰酶,同时加入1~2滴甲苯防止微生物生长,37 ℃水浴保温,测定4 h至32 h不同反应时间段内酶解反应所产生的还原力,以还原力不再增加的最短时间为优化反应时间。每个样品重复测定3次。
在酶用量和反应时间优化的基础上,测定反应体系中的总糖和总还原力,重复3次,以不加酶的样品同样处理作为对照计算CL,同时根据所测定的β-淀粉酶水解率可以计算出支链淀粉的ECL和ICL。
CL=产物中的总糖(葡萄糖当量)/产物中的总还原力(葡萄糖当量)
ECL=CL ×β-淀粉酶水解率+2.0
ICL=(CL-ECL)-1.0
1.4 β-淀粉酶和普鲁兰酶酶解温度的确定
根据所购β-淀粉酶和普鲁兰酶的质检报告,β-淀粉酶和普鲁兰酶的推荐反应温度分别为20 ℃和25 ℃,杜先锋等[8]、敖自华等[9]采用β-淀粉酶、普鲁兰酶进行水解反应时,采用的反应温度均为37 ℃。为此,在β-淀粉酶和普鲁兰酶酶用量和反应时间优化的基础上,设置20、37 ℃和25、37 ℃两种温度,测定不同品种在两种反应温度下酶解产生的还原力,明确β-淀粉酶和普鲁兰酶酶解反应的最佳温度。每个样品重复测定3次。
1.5 支链淀粉A∶B值酶解反应条件的优化及测定
将测定β-淀粉水解率时的最终反应液加入3倍体积无水甲醇,冰浴30 min后6 000 r/min离心5 min,倾去上清液,加入75%的甲醇冲洗沉淀,37 ℃恒温干燥后用研钵磨成细粉,获得支链淀粉β-极限糊精。称取5 mg β-极限糊精粉末于2 mL离心管中,加入200 μL蒸馏水,沸水浴中加热搅拌10 min后,加入浓度为0.04 mol/L,pH 4.5的醋酸缓冲液,再次置沸水浴中加热搅拌10 min,冷却至室温,制成1 mg/mL的β-极限糊精溶液。
每个供试品种取2 mL离心管5个,量取β-极限糊精溶液1 mL,首先分别加入2、10、50、100、150 U的异淀粉酶进行第一步脱支水解,37 ℃水浴保温,24 h后将反应液置沸水浴中25 min灭酶,冷却后测定反应液中的还原力,以还原力不再增加的最低酶用量为异淀粉酶优化酶用量。每个样品重复测定3次。
每个供试品种取2 mL离心管1个,量取β-极限糊精溶液2 mL,加入优化酶用量的异淀粉酶,同时加入1~2滴甲苯防止微生物生长,37 ℃水浴保温,测定4 h至32 h不同反应时间段内酶解反应所产生的还原力,以还原力不再增加的最短时间为优化反应时间,此时反应液中的还原力为C1。每个样品重复测定3次。
在异淀粉酶用量和反应时间优化的基础上,每个供试品种取2 mL离心管4个,取异淀粉酶水解后的反应液 1 mL,再次分别加入0.6、0.8、1、1.2 U的普鲁兰酶第二步脱支水解,37 ℃水浴保温,24 h后将反应液置沸水浴中25 min灭酶,冷却后测定反应液中的还原力,以还原力不再增加的最低酶用量为普鲁兰酶优化酶用量。每个样品重复测定3次。
在异淀粉酶用量和反应时间优化的基础上,每个供试品种取2 mL离心管1个,取异淀粉酶水解后的反应液1 mL,向每个供试品种的体系中加入优化酶用量的普鲁兰酶,测定4 h至32 h不同反应时间点酶解反应所产生的还原力,以还原力不再增加的最短时间为优化反应时间,此时反应液中的还原力为C2,每个样品重复测定3次。
根据测定的C1、C2可计算出稻米支链淀粉的A∶B值:
C1=B+0.5A
C2=B+A
2 结果与分析
2.1稻米支链淀粉β-淀粉酶水解率测定的最适反应条件
2.1.1 β-淀粉酶水解率测定的最适酶用量
图1为8种稻米支链淀粉分别加入300、400、500、600 U β-淀粉酶的反应体系37 ℃酶解48 h后的还原力(麦芽糖当量)测定结果。从图1中可以看出,随着酶用量的增加,反应体系中的还原力相应增大,当酶用量为500 U时开始,体系中的还原力基本保持恒定,随后酶用量的增加体系中的还原力不再增大。可见,对于0.1 g的稻米支链淀粉,测定β-淀粉酶水解率时β-淀粉酶的最适酶用量为500 U,与测定葛根、银杏支链淀粉β-淀粉酶水解率的酶用量(500 U)相同[8-9],大于测定慈姑支链淀粉β-淀粉酶水解率的酶用量(325 U)[10]。
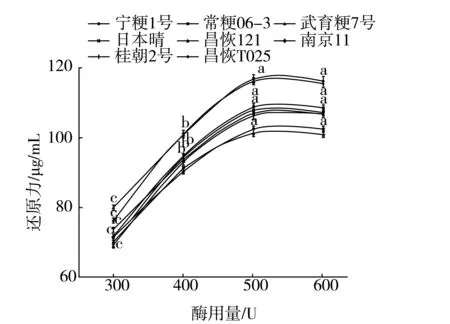
注:数据为平均值,短线表示均方差,不同小写字母代表处理间达显著差异水平(P<0.05),余同。图1 稻米支链淀粉β-淀粉酶水解率测定时β-淀粉酶用量与还原力生成的关系
2.1.2 β-淀粉酶水解率测定的最适反应时间
图2为8种稻米支链淀粉加入β-淀粉酶500 U,37 ℃水浴酶解后,4 h至60 h不同反应时间点酶解反应体系中还原力(麦芽糖当量)的测定结果。从图2中可以看出,随着酶解反应时间的增加,不同品种支链淀粉的水解程度均相应增大,水解初期,还原力增加较快,而后逐渐缓慢,当反应时间达到48 h后开始,反应体系中所产生的还原力基本上达到一个平稳值,水解程度达到最大,随后还原力不再而增加。可见,对于0.1 g的稻米支链淀粉,测定β-淀粉酶水解率时的最适酶解时间为48 h。

图2 稻米支链淀粉β-淀粉酶水解率测定时酶解反应时间与还原力生成的关系
2.1.3 β-淀粉酶水解率测定的最适反应温度
图3为8种稻米支链淀粉分别在20、37 ℃两种水浴温度下(酶用量500 U,反应时间48 h)的还原力的测定结果。从图3中可以看出,反应体系温度为37 ℃时,8个品种的还原力均大于20 ℃时的还原力。可见,对于0.1 g的稻米支链淀粉,测定β-淀粉酶水解率时的最适反应温度为37 ℃。

图3 稻米支链淀粉β-淀粉酶水解率测定时不同反应温度下的还原力
2.2 稻米支链淀粉链长测定的最适反应条件
2.2.1 CL测定的最适酶用量
图4为8种稻米支链淀粉分别加入2、4、6、8 U普鲁兰酶的反应体系37 ℃酶解24 h后的还原力(葡萄糖当量)的测定结果。从图4中可以看出,随着酶用量的增加,反应体系中的还原力相应增大,当酶用量为4 U时开始,体系中的还原力基本保持恒定,随后酶用量的增加体系中的还原力不再增大。可见,对于22 mg的稻米支链淀粉,测定CL时的普鲁兰酶最适酶用量为4 U,与测定银杏支链淀粉CL的酶用量(4 U)相同[9],大于测定慈姑支链淀粉CL的酶用量(3 U)[10]。

图4 稻米支链淀粉CL测定时普鲁兰酶用量与还原力生成的关系
2.2.2 CL测定的最适反应时间
图5为8种稻米支链淀粉加入普鲁兰酶4 U,37 ℃水浴酶解后, 4 h至32 h不同反应时间点内酶解反应体系中还原力(葡萄糖当量)的测定结果。从图5中可以看出,随着酶解反应时间的增加,不同品种支链淀粉的水解程度均相应增大,当反应时间达到24 h后开始,反应体系中所产生的还原力基本上达到一个平稳值,水解程度达到最大,随后还原力不再增加。可见,对于22 mg的稻米支链淀粉,测定CL时的最适酶解时间为24 h。
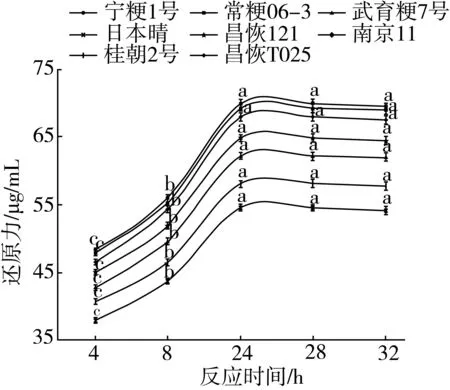
图5 稻米支链淀粉CL测定时酶解反应时间与还原力生成的关系
2.2.3 CL测定的最适反应温度
图6为8种稻米支链淀粉在25、37 ℃两种水浴温度下(酶用量4 U,反应时间24 h)的还原力测定结果。从图6中可以看出,反应体系温度为37 ℃时,8个品种的还原力均大于25 ℃时的还原力。可见,对于22 mg的稻米支链淀粉,测定CL时的最适反应温度为37 ℃。
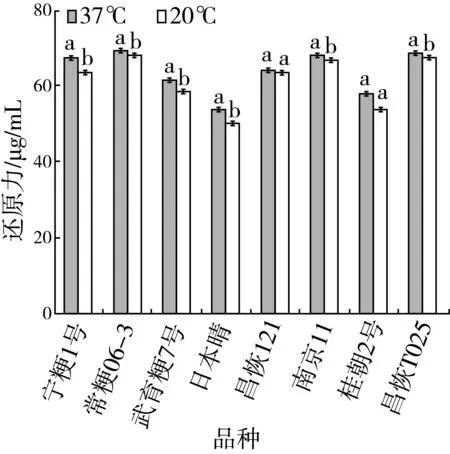
图6 稻米支链淀粉CL测定时不同反应温度下的还原力
2.3 A∶B值最适反应条件的优化及测定
2.3.1 A∶B值测定时异淀粉酶的的最适酶用量
图7为8种稻米β-极限糊精溶液分别加入2、10、50、100、150 U异淀粉酶的反应体系37 ℃酶解24 h后的还原力(葡萄糖当量)测定结果。从图7中可以看出,随着酶用量的增加,反应体系中的还原力相应增大,当酶用量为100 U时,体系中的还原力基本保持恒定,随后酶用量的增加体系中的还原力不再增大。可见,对于1 mL浓度为1 mg/mL的稻米β-极限糊精溶液,测定A∶B值时异淀粉酶的最适酶用量为100 U,高于测定银杏、慈姑支链淀粉的酶用量(80 U)和葛根支链淀粉的酶用量(2 U)[8-10]。

图7 稻米支链淀粉A∶B测定时异淀粉酶用量与还原力生成的关系
2.3.2 A∶B值测定时异淀粉酶的最适反应时间
图8为8种稻米β-极限糊精溶液加入异淀粉酶100 U,37 ℃水浴酶解后,4 h至32 h不同反应时间点酶解体系中还原力(葡萄糖当量)的测定结果。从图8中可以看出,随着酶解反应时间的增加,不同品种支链淀粉的水解程度均相应增大,当反应时间达到24 h后开始,反应体系中所产生的还原力基本上达到一个平稳值,水解程度达到最大,随后还原力不再增加。可见,对于1 mL浓度为1 mg/mL的β-极限糊精溶液,测定A∶B值时的最适酶解时间为24 h。

图8 稻米支链淀粉A∶B值测定时异淀粉酶酶解反应时间与还原力生成的关系
2.3.3 A∶B值测定时普鲁兰酶的最适酶用量
图9为8种稻米异淀粉酶水解反应液再次分别加入0.6、0.8、1、1.2 U普鲁兰酶进行第二步脱支水解,反应体系37 ℃酶解24 h后的还原力(葡萄糖当量)测定结果。从图9中可以看出,随着酶用量的增加,反应体系中的还原力相应增大,当酶用量为1 U时,体系中的还原力基本保持恒定,随后酶用量的增加体系中的还原力不再增大。可见,对于1 mL异淀粉酶水解后的反应液,测定A∶B时普鲁兰酶的最适酶用量为1 U,与测定银杏支链淀粉的酶用量(1 U)相同[9],高于测定葛根支链淀粉的酶用量(0.6 U)[8]。

图9 稻米支链淀粉A∶B测定时普鲁兰酶用量与还原力生成的关系
2.3.4 A∶B值测定时普鲁兰酶的最适反应时间
图10为种稻米异淀粉酶水解反应液再次加入普鲁兰酶1 U,37 ℃水浴酶解后,4 h至32 h不同反应时间点酶解体系中还原力(葡萄糖当量)的测定结果。从图10中可以看出,随着酶解反应时间的增加,不同品种支链淀粉的水解程度均相应增大,当反应时间达到24 h后开始,反应体系中所产生的还原力基本上达到一个平稳值,水解程度达到最大,随后还原力不再增加。可见,对于1 mL异淀粉酶水解后的反应液,测定A∶B时的最适酶解时间为24 h。
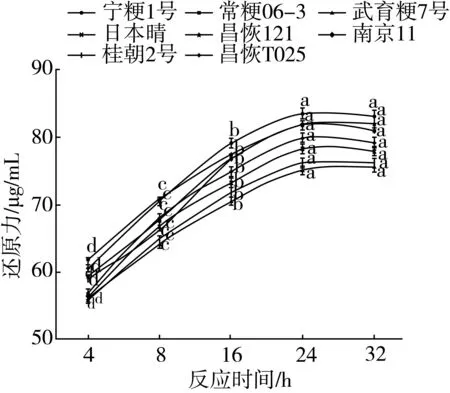
图10 稻米支链淀粉A∶B值测定时普鲁兰酶酶解反应时间与还原力生成的关系
2.4 8个水稻品种的支链淀粉精细结构
表1为根据优化的反应条件利用酶法测定的8个水稻品种的支链淀粉结构参数,由表1可见,8个水稻品种的β-淀粉酶水解率变幅为51.22%~62.86%,其中昌恢121最大,宁粳1号最小;CL的变幅为18.31~20.83,ECL的变幅为11.38~14.82,两者中均为南京11最大,宁粳1号最小;ICL的变幅为4.57~5.93,宁粳1号最大,昌恢121最小;A∶B值的变幅为1.05~1.67,常粳06-3最大,昌恢T025最小。
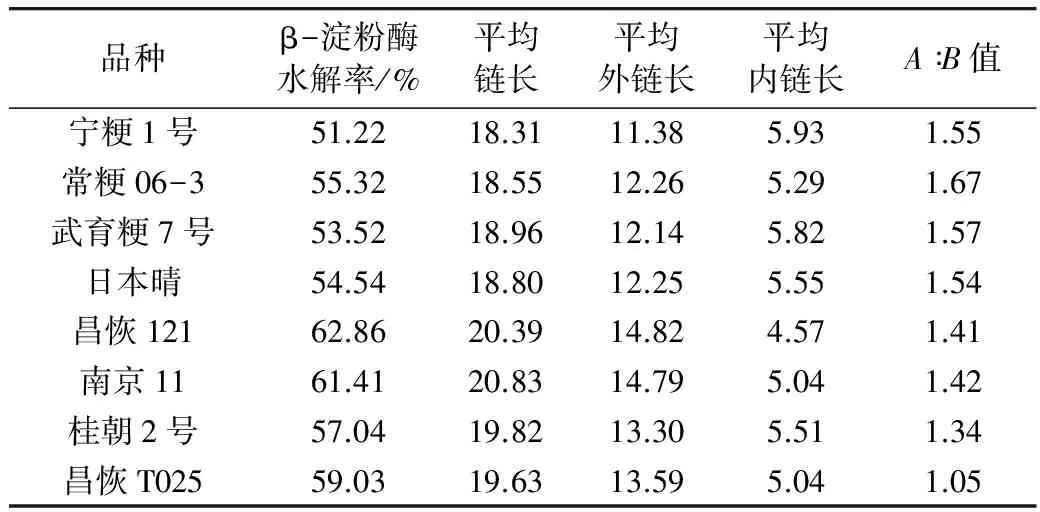
表1 参试水稻品种的支链淀粉结构
3 讨论
利用酶法测定支链淀粉精细结构的基本原理首先是利用β-淀粉酶作用于支链淀粉的α-1,4-糖苷键形成了β-限制糊精,并获得β-淀粉酶水解率;利用普鲁兰酶作用支链淀粉的α-1,6-糖苷键使支链淀粉脱支成为直链片段,获得CL;利用异淀粉酶作用于α-1,6-糖苷键先水解β-限制糊精中大于三个葡萄糖单位构成的侧链,再用普鲁兰酶进一步水解两个以上葡萄糖单位构成的侧链,这样经过异淀粉酶和普鲁兰酶共同作用后可以使β-极限糊精完全脱支,以此通过计算得到 A与B 链的比值。杜先锋等[8]测定葛根支链淀粉β-淀粉酶水解率时,β-淀粉酶用量为500 U,反应时间约48 h,反应温度为37 ℃;测定A∶B值时,异淀粉酶用量为2 U,反应时间为15 h,普鲁兰酶用量为0.6 U,反应时间为24 h。敖自华等[9]测定银杏支链淀粉β-淀粉酶水解率时,β-淀粉酶用量为500 U,反应时间约44 h,反应温度为37 ℃;测定CL时,普鲁兰酶用量为4 U,反应时间约24 h,反应温度为37 ℃;测定A∶B值时,异淀粉酶用量为80 U,反应时间为20 h,普鲁兰酶用量为1 U,反应时间为15 h。王素雅等[10]测定慈姑支链淀粉β-淀粉酶水解率时,β-淀粉酶用量为325 U,反应温度为37 ℃;测定CL时,普鲁兰酶用量为3 U,反应温度为37 ℃。本研究表明,0.1 g的稻米支链淀粉水解时,β-淀粉酶的最适用量为500 U,反应时间为48 h,反应温度为37 ℃;测定CL时,对于22 mg的稻米支链淀粉,普鲁兰酶的最适用量为4 U,反应时间为24 h,反应温度为37 ℃;对于1 mL浓度为1 mg/mL的稻米β-极限糊精溶液,先用100 U异淀粉酶对其进行水解,反应24 h 后加热使酶失活,再用1 U普鲁兰酶进行第二步脱支水解,反应24 h后进行A∶B值的测定可以取得较好的效果。研究结果对于了解支稻米链淀粉的精细结构,揭示稻米食用品质形成的机理都具有应用价值。
4 结论
本文优化了酶法测定稻米支链淀粉精细结构的各项反应条件。在此基础之上进行了稻米支链淀粉结构的测定,8个参试品种中,β-淀粉酶水解率的变幅为51.22~62.86%,CL的变幅为18.31~20.83,ECL的变幅为11.38~14.82,ICL的变幅为4.57~5.93,A∶B值的变幅为1.05~1.67。
[1]KONG X, ZHU P, SUI Z, et al. Physicochemical properties of starches from diverse rice cultivars varying in apparent amylose content and gelatinization temperature combinations [J]. Food Chemistry, 2015, 172: 433-440
[2]彭小松, 朱昌兰, 王方, 等. 籼粳杂种后代支链淀粉结构及其与稻米糊化特性相关性分析[J]. 核农学报, 2014, 28(7): 1219-1225
PENG X S, ZHU C L, WANG F, et al. The relationship between amylopectin structure and rice paste property of Indica/Japonica cross progenies [J]. Journal of Nuclear Agricultural Sciences, 2014, 28(7): 1219-1225
[3]张昌泉, 赵冬生, 李钱峰, 等. 稻米品质性状基因的克隆与功能研究进展[J]. 中国农业科学, 2016, 49(22): 4267-4283
ZHANG C Q, ZHAO D S, LI Q F, et al. Progresses in research on cloning and functional analysis of key genes involving in rice grain quality [J]. Scientia Agricultura Sinica, 2016, 49(22): 4267-4283
[4]YAO Y, THOMPSON D B, GUILTINAN M J. Maize Starch-Branching Enzyme Isoforms and Amylopectin Structure. In the Absence of Starch-Branching Enzyme IIb, the Further Absence of Starch-Branching Enzyme Ia Leads to Increased Branching [J]. Plant Physiology, 2004, 136(3): 3515-3523
[5]胡志萍, 钟海明, 柳美南, 等. 稻米品质形成机理研究进展及水稻品质育种技术策略[J]. 江西农业学报, 2007, 17(6): 5-11
HU Z P, ZHONG H M, LIU M N, et al. Advance in Forming Regularity of Rice Quality and Its Breeding Technical Strategies [J]. Acta Agriculturae Jiangxi, 2007, 17(6):5-11
[6]VANDEPUTTE G E, DELCOUR J A. From sucrose to starch granule to starch physical behaviour: a focus on rice starch [J]. Carbohydrate Polymers, 2004, 58(3): 245-266
[7]HIZUKURI S. Polymodal distribution of the chain lengths of amylopectins, and its significance [J]. Carbohydrate Research, 1986, 147: 342-347
[8]杜先锋, 王璋, 许时婴. 酶法测定葛根支链淀粉分支化度[J]. 食品与发酵工业, 2002, 28(2): 62-65
DU X F, WANG Z, XU S Y, et al. Enzymatic Determination on the Degree of Multiple Branching in Pueraria lobata Amylopectin [J]. Food and Fermentation Industries, 2002, 28(2): 62-65
[9]敖自华, 王璋, 许时婴. 银杏支链淀粉分子结构的研究[J]. 食品科学, 2000, 21(10):15-18
AO Z H, WANG Z, XU S Y. Research on the molecular structure of ginkgo amylopectin [J]. Food Science, 2000(21): 15-18
[10]王素雅, 曹崇江, 杨玉玲, 等, 慈菇支链淀粉的分离纯化及其分子结构研究[J]. 食品科学, 2009(9):29-32
WANG S Y, CAO C J, YANG Y L, et al. Study on separation of arrowhead amylopectin and its molecular structure [J]. Food Science, 2009(9): 29-32
[11]贺晓鹏, 朱昌兰, 刘玲珑, 等, 不同水稻品种支链淀粉结构的差异及其与淀粉理化特性的关系[J]. 作物学报, 2010. 36(2): 276-284
HE X P, ZHU C L, LIU L L, et al. Difference of amylopectin structure among rice varieties differing in grain quality and its correlations with starch physicochemical properties [J]. Acta Agronomica Sinica, 2010, 36(2): 276-284.
