猪伪狂犬病病毒gE蛋白间接ELISA抗体检测方法的建立
2018-05-09寇晓晶郭慧琳刘剑锋
寇晓晶,高 峰,郭慧琳,刘剑锋
(1.甘肃省动物疫病预防控制中心,甘肃兰州 730000;2. 盐城出入境检验检疫局,江苏盐城 224002;3. 南京农业大学,江苏南京 210014)
伪狂犬病毒(Pseudorabies virus,PRV)是一种疱疹病毒,能够感染猪、牛、羊等家畜及野生动物,主要侵害神经系统及生殖系统,降低家畜的生产性能,甚至导致动物死亡。据不完全统计,全世界范围内己有44个国家和地区报道过伪狂犬病的发生。
猪是PRV的天然宿主,各个阶段猪均可感染。新生仔猪感染后呈现神经症状,且死亡率极高;妊娠母猪、种公猪以繁殖障碍为主;生长育肥猪则表现为呼吸道症状[1-2]。一旦猪群发生PRV感染,病毒很难被清除。猪伪狂犬病因传播速度快、范围广、途径多,以及病原顽固等特点,被定义为极难防疫的自然疫源性疾病,国际动物卫生组织(OIE)将其列为须报告动物疫病。目前,一些欧洲和北美国家通过积极有效的疾病防控手段和扑杀程序,已将PRV彻底净化。但PRV在我国仍广泛流行,引起的经济损失巨大。
目前PRV的诊断方法主要有病毒分离培养、PCR、血清抗体检测等[3-7]。但病毒分离培养耗时较长,一般需要耗时2~3 d,并且敏感性较差;PCR是一种快速、精确、敏感的检测方法,但对专业技能要求较高,且设备昂贵,不适用于临床推广[8-9]。相比上述两种检测方法,血清抗体检测具有操作简单、敏感性好、能大批量检测样品的优点,更能符合临床检测需要。
根据疮疹病毒糖蛋白命名法,PRV的糖蛋白统一命名为gB、gC、gD、gE、gH、gJ、gK、gL、gM、gN,其中gE是主要的毒力因子。病毒在体外培养时,gE的缺失并不影响其增殖性能和免疫原性,但病毒毒力则会降低,从而为该病疫苗制备提供了思路[10]。目前,几乎所有分离到的野毒株中都含有gE蛋白[11]。当动物自然感染PRV时,血清中的gE抗体则会升高,而gE蛋白缺失疫苗免疫后则不会产生gE抗体。因此,选择gE蛋白作为包被抗原,可用于猪群野毒感染的临床检测。
本研究以gE蛋白为包被抗原,建立了PRV野毒株ELISA检测方法,并通过与国际知名产品进行对比试验和稳定性试验,确定该方法可用于猪伪狂犬病检测。
1 材料与方法
1.1 材料
PRV原核表达重组gE纯化蛋白:由本公司合成、表达及纯化;辣根过氧化物酶(HRP)羊抗猪:购自亿米诺公司;TMB底物显色液:本公司自备;胎牛血清:购自美国Gibco公司;96孔可拆式酶标板、酶标仪:购自美国Thermo公司;猪伪狂犬病毒gE蛋白抗体ELISA检测试剂盒:购自于美国IDEXX。其他试剂为国产分析纯。
1.2 方法
1.2.1 gE蛋白间接ELISA的建立及优化 对抗原包被量、抗原包被条件、封闭液成分、孵育温度、样品稀释液,以及二抗稀释液成分和稀释度等进行优化,根据P/N值建立最佳条件。
1.2.2 gE蛋白间接ELISA反应体系的确立 取酶标板,将待检血清作1∶50稀释,取100 µL加至酶标板中。同时设阴、阳性对照各2孔,各取阴阳性对照100 µL 加入孔中(不用稀释)。轻轻振匀孔中样品,盖上盖板膜,置室温下温育30 min。弃去孔中溶液,每孔加入稀释好的洗涤液260 µL,静置30 s后,弃去洗涤液;洗涤4次后在吸水纸上拍干。配制酶结合物工作液:按1∶100比例,混匀。每孔加酶结合物工作液100 µL,盖上盖板膜,室温(25±2)℃下温育30 min。弃去孔中溶液,洗涤4次后在吸水纸上拍干。将底物A液与底物B液按1∶1混合均匀,加入孔中(100 µL/孔),盖上盖板膜,室温下反应10 min。每孔加入终止液50 µL,5 min内于OD450/630nm处测定结果。
1.2.3 gE蛋白间接ELISA阴阳性判定标准的建立 利用建立的方法,检测阴阳性对照血清OD450/630nm差值,并各检测20份阴阳性血清OD450/630nm差值,分别计算出阴阳性对照血清的平均OD值,以S/P值作为判定阴阳性标准。
1.2.4 与国外标杆产品的比对 用本自制产品与美国IDEXX公司产品,对246份猪血清分别进行检测,然后分析本自制产品的敏感性、特异性和符合率。
1.2.5 gE蛋白抗体检测试剂盒稳定性试验 4 ℃条件下,用同一份血清检测OD450/630nm差值以及阴阳性对照血清OD450/630nm差值。检测时间分别为0 d、15 d、1个月、3个月、6个月及12个月。计算3批次的S/P值,探究试剂盒的有效期。
2 结果
2.1 gE蛋白间接ELISA阴阳性判定标准的建立
利用建立的PRV gE蛋白间接ELISA方法,检测阴性对照血清、阳性对照血清、20份阴性血清和20份阳性血清的OD450/630nm差值。具体结果见表1。统计发现,阴性对照OD450/630nm平均差值为0.068,阳性对照为2.782。根据公式S/P=(样本OD值-阴性对照平均值)/(阳性对照平均OD值-阴性对照平均值),以及阴阳性血清的检测结果,初步确定S/P≥0.15为阳性,S/P<0.15为阴性。
2.2 与美国IDEXX公司产品的比对
与美国IDEXX公司产品完成了246份临床样本的比对试验,证明本自制的ELISA产品与该国外标杆产品的阳性符合率为88.03%,阴性符合率为91.47%,总体符合率为89.84%(表2)。
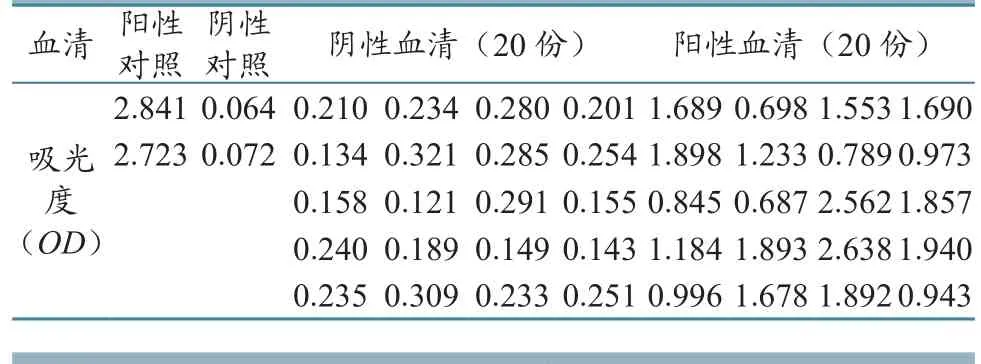
表1 ELISA检测猪血清结果(OD 450/630 nm差值)
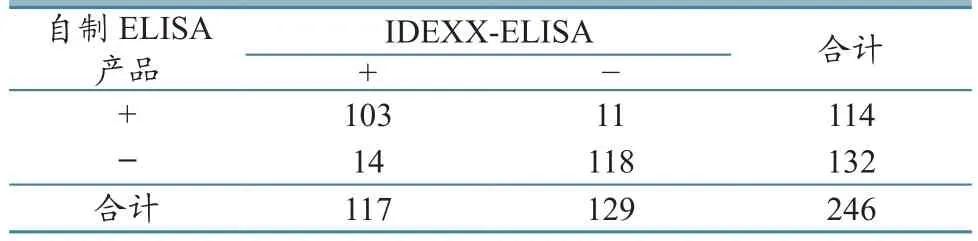
表2 与国外进口标杆品牌符合度对比结果 单位:份
2.3 gE蛋白抗体检测试剂盒的批间、批内重复性
分别用3个批次组装的试剂盒检测5份血清的OD450/630nm差值,发现批间变异系数(CV)在3.44%~6.05%之间,均小于10%,表明PRV gE蛋白抗体检测试剂盒不同批次间的重复性较好(表3)。
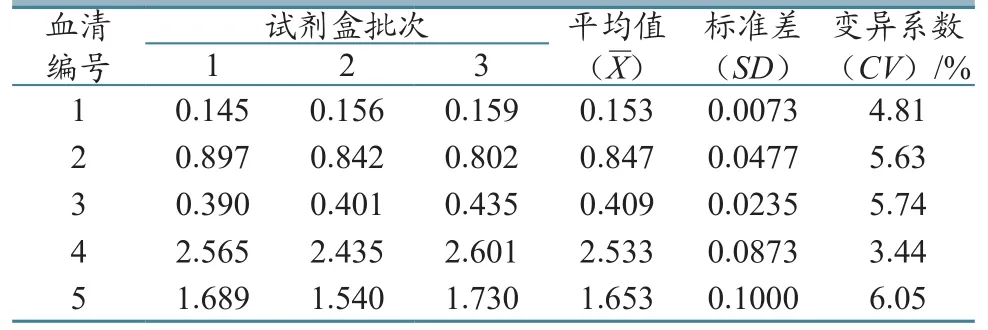
表3 批间重复性试验结果
使用同批次组装的试剂盒检测与上相同的5份血清,根据OD450/630nm差值标准差和变异系数,分析批内重复性,发现批内变异系数在2.14%~8.67%之间,均小于10%,表明PRV gE蛋白抗体检测试剂盒同批次内的重复性较好(表4)。
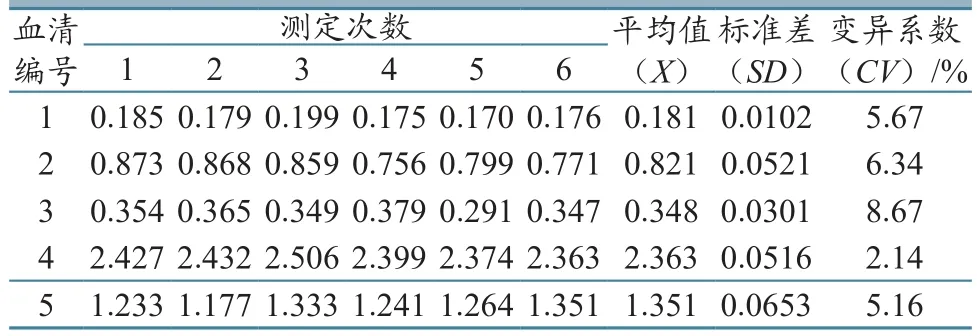
表4 批内重复性试验结果
2.4 gE蛋白抗体检测试剂盒4℃保存试验
4 ℃条件下,0 d、15 d、1个月、3个月、6个月和12个月的保存试验结果见表5。保存试验显示,4 ℃条件下,12个月的S/P值基本恒定,故可以保存12个月。

表5 4 ℃条件下保存试验(S/P值)
3 讨论
PRV目前在国内猪场广泛流行,仔猪感染后呈急性发病并大量死亡,成年猪感染后临床症状各异,包括脑炎、肺炎、流产,同时造成猪机体免疫力下降,对畜牧业威胁极大。目前伪狂犬病的防控主要靠gE基因缺失疫苗免疫。采用gE-ELISA对猪群进行血清抗体检测,可以有效区分疫苗抗体及感染抗体,对猪场伪狂犬病的防控具有重要意义。目前市面上很多gE-ELISA检测试剂盒是基于5个抗原表位中1个或者2个建立的阻断ELISA。但是gE抗原显示出一定的抗原漂移性,并且猪个体之间对gE不同表位的抗体应答也显示出多样性,因此阻断ELISA可能会出现一些误判[12-13]。鉴于这种情况,检测全蛋白抗体的结合性ELISA,如间接ELISA或夹心ELISA则较有优势。这种方法不会受到gE表位特异性变化的影响。虽然gE蛋白在异体表达系统里面很难完全表达[14],但是随着对PRV gE蛋白的研究,其表位已被分析清楚[15]。
本研究通过原核表达gE蛋白中具有免疫原性抗原决定簇的基因片段,使包被抗原具有较好的敏感性及特异性。产品比对试验中,将自制的间接ELISA方法对比国外的标杆产品,显示阳性符合率为88.03%,阴性符合率为91.47%,说明建立的间接ELISA方法敏感性和特异性良好;生物统计学显示,不存在显著性差异。同时,该检测方法在时间上比国外标杆产品缩短了近半个小时,更有利于在我国动物疫病防控一线市场推广应用。
4 结论
本研究以原核表达的PRV gE蛋白为包被抗原,通过建立并优化间接ELISA方法,研制出了PRV间接ELISA抗体检测试剂盒。与美国IDEXX生产的标杆产品对比发现,该试剂盒的阳性符合率为88.03%,阴性符合率为91.47%,总体符合率为89.84%。批间和批内重复性试验表明,该试剂盒变异系数均小于10%,具有较好的重复性。该检测试剂盒为猪场PRV野毒感染检测提供了技术支撑,可用于猪场PRV野毒感染的临床检测。
参考文献:
[1] THOMSEN D R,MAROTTI K R,PALERMO D P,et al.Pseudorabies virus as a live virus vector for expression of foreign genes[J]. Gene,1987,57(2/3):261-265.
[2] WU Q X,ZHANG H,DONG H.L,et al.Seroprevalence and risk factors associated with Pseudorabies virus infection in Tibetan pigs in Tibet[J]. BMC veterinary research,2018,14(1):25.
[3] BALASCH M,PUJOLS J,SEGALES J,et al.Aujeszky's disease(pseudorabies)virus detection in cerebrospinal fluid in experimentally infected pigs[J].Veterinary microbiology,1998,60(2/3/4):99-106.
[4] PENSAERT M,LABARQUE G.,FAVOREEL H,et al. Aujeszky's disease vaccination and differentiation of vaccinated from infected pigs[J]. Developmental biology,2014,119:243-254.
[5] POL F,DEBLANC C,OGER A,et al. Validation of a commercial real-time PCR kit for specific and sensitive detection of pseudorabies[J]. Virological methods,2013,187(2):421-423.
[6] ZHANG M,XIE Z,XIE L,et al. Simultaneous detection of eight swine reproductive and respiratory pathogens using a novel GeXP analyser-based multiplex PCR assay[J]. Virological methods,2015,224:9-15.
[7] LEE C S,MOON H J,YANG J S,et al. Multiplex PCR for the simultaneous detection of pseudorabies virus,porcine cytomegalovirus,and porcine circovirus in pigs[J]. Virological methods,2007,139(1):39-43.
[8] EN F X,WEI X,JIAN L,et al. Loop-mediated isothermal amplification establishment for detection of pseudorabies virus[J]. Virological methods,2008,151(1):35-39.
[9] ZHANG C F,CUI S J,ZHU C. Loop-mediated isothermal amplification for rapid detection and differentiation of wild-type pseudorabies and gene-deleted virus vaccines[J]. Virological methods,2010,169(1):239-243.
[10] JACOBS L,MULDER W A,VAN OIRSCHOT J T,et al. Deleting two amino acids in glycoprotein gI of pseudorabies virus decreases virulence and neurotropism for pigs,but does not affect immunogenicity[J]. Journal of general virology,1993,74(10):2201-2206.
[11] HU D F,LÜ L,ZHANG Z D,et al. Seroprevalence and associated risk factors of pseudorabies in Shandong province of China[J]. Journal of veterinary science,2016,17(3):361-368.
[12] MORENKOVS O S,SOBKO Y A,PANCHENKO O A.Glycoprotein gE blocking ELISAs to differentiate between Aujeszky's disease-vaccinated and infected animals[J].Virological methods,1997,65:83-94.
[13] GUTWINIARSKA M,JACOBS L,KERSTENS H,et al. A highly specific and sensitive sandwich blocking ELISA based on baculovirus expressed pseudorabies virus glycoprotein B[J]. Journal of virological methods,2000,88(1):63-71.
[14] KIMMAN T G,LEEUW Q,KOCHAN G. An indirect double-antibody sandwich enzyme-linked immunoassay(ELISA)using baculovirus-expressed antigen for the detection of antibodies to glycoprotein E of pseudorabies virus and comparison of the method with blocking ELISAs[J]. Clinical and diagnostic laboratory immunology,1996,3:167-174.
[15] FUCHS W,RZIHA H J,LUKÀCS N,et al.Pseudorabies virus glycoprotein gI:in vitro and in vivo analysis of immunorelevant epitopes[J]. Journal of general virology,1990,71:1140-1151.
