5种氮源对蛹虫草生长及其质量的影响
2018-05-08卞文印钟李凤
李 菲,王 忠,卞文印,钟李凤
[安发(福建)生物科技有限公司, 福建 宁德 352100]
蛹虫草又名北冬虫夏草,属于真菌门、子囊菌纲、肉座菌目、麦角菌科、虫草属[1]。蛹虫草含有丰富的生物活性成分,如虫草素、虫草酸、虫草多糖等,其中虫草素是一种核苷类抗生素,能抑制 mRNA 合成,诱导细胞凋亡 ,使细胞分化,对多种肿瘤细胞的生长具有抑制作用,尤其是对某些类型的白血细胞抑制作用更为明显[2-3];虫草多糖可提高人体免疫功能,已临床用于治疗恶性肿瘤[3-4]。氮源作为蛹虫草生长必需的营养成分之一,对蛹虫草生长有着非常重要的作用。本试验系统研究氮源对蛹虫草子实体生长及虫草素、虫草多糖含量的影响,以寻找适宜蛹虫草生长及虫草素、虫草多糖积累的氮源,为生产富含虫草素、虫草多糖的蛹虫草提供参考。
1 材料与方法
1.1 试验材料
蛹虫草菌种Cmα-001,由安发(福建)生物科技有限公司研发中心实验室提供。
葡萄糖、蔗糖、琼脂、硫酸镁、维生素B1、磷酸二氢钾、蛋白胨、蚕蛹粉、牛肉膏、黄豆粉、酵母粉、硫酸铵、虫草素、甘露醇标样、甲醇(色谱纯)、四氢呋喃(色谱纯)、无水乙醇、氯仿、正丁醇、浓硫酸、苯酚(分析纯)等。
SW-CJ-1A超净工作台,SPX-250BS-Ⅱ生化培养箱,TES1330A照度计,MS6508数显温湿度计,Waters高效液相色谱仪,Waters2487紫外检测器,Part No.wato45905C18(4.6 mm×150 mm)色谱柱,汉邦C18(4.6 mm×250 mm,5 μm)色谱柱,0.5 μm水相微孔滤膜,恒温水浴锅,722分光光度计。
1.2 试验处理
用于菌种分离培养的斜面培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、MgSO40.5 g、KH2PO41.0 g、VB10.1 g,pH自然值;用于培养菌丝体的液体培养基:马铃薯200.0 g、葡萄糖20.0 g、蛋白胨5.0 g、MgSO41.0 g、KH2PO42.0 g、VB10.1 g,pH自然值,分装至三角瓶;用于栽培的培养基:大米32 g、营养液42 mL (蔗糖20 g、 MgSO41.0 g、KH2PO42.0 g、 VB10.1 g、水1000 mL,pH自然值),以不加氮源作为对照(CK),5个试验处理分别加入10 g·L-1的蛋白胨、牛肉膏、黄豆粉、蚕蛹粉、酵母粉作为氮源,分别编号为Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ,研究不同氮源对蛹虫草整个生长过程、产量,以及对虫草多糖、虫草素含量的影响。
1.3 栽培方法
栽培种制备:将蛹虫草母种进行分离,接种至斜面试管,放置于生化培养箱中18℃培养,从培养的第4 d开始,每天进行10 h光照培养,7 d左右获得生产菌种。
液体种制备:在超净工作台下,将试管菌切成小碎块,接种至液体培养基中,温度20℃下静置培养48 h,后置于摇床内130 r·min-1下进行振荡培养,3 d左右获得液体接种菌。将液体菌种稀释5倍,即可用于接种大米培养基。
接种后搬进培养室内,温度18~20℃下黑暗培养5 d左右,至菌丝吃透培养基;发菌完成后开始进行弱光照培养,在光照度200~400 lx、光照时长10~12 h·d-1、温度20℃、相对湿度70%~80%条件下培养4 d左右,至培养基完全转为橙色;之后进入原基分化阶段,温差控制在5~10℃,培养5 d左右,至有较多小刺尖状突起形成;之后进入子实体生长阶段,温度22℃,相对湿度80%~90%,光照700~1 000 lx,每日光照10 h·d-1,培养35 d左右,采收时60℃烘干。
1.4 虫草素、虫草多糖含量的测定
高效液相色谱条件:C18柱,250 mm×4.6 mm(i.d.),5 μm,流动性:乙腈∶水为5∶95,用前过0.45 μm滤膜,脱气。流速:1.0 mL·min-1,柱温:35℃,波长:260 nm,进样量:10 μL。
虫草素标准曲线制定:准确吸取0.1 mL、0.2 mL、0.5 mL、1.0 mL、2.0 mL和5.0 mL的标准液于10 mL容量瓶中,用水定容、摇匀,该标准曲线浓度设为1.00、2.00、5.00、10.0、20.0和50.0 μg·mL-1,按色谱条件测定,以虫草素质量为横坐标,相应的峰面积为纵坐标,计算标准曲线,求线性回归方程。
提取虫草多糖:取每组样品粉末,以无水乙醇提取10 h除去脂溶性成分,自然风干,取脱脂后的残渣,水浴70℃恒温提取2次,过滤,取滤液减压浓缩,浓缩液以Savag法除去蛋白质,最后移入100 mL的容量瓶中,冷却定容备用。
葡萄糖标准曲线绘制:精确称取葡萄糖200 mg置于100 mL容量瓶中,定容摇匀,取1 mL溶液溶于50 mL容量瓶中定容摇匀,备用。分别吸取标准溶液0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL,用蒸馏水补充至2.0 mL,加入6%的苯酚溶液1 mL,静止10 min,摇匀静置20 min,于490 nm处测定吸光值,以2.0 mL蒸馏水作为空白,获得回归方程:A=0.0089C+0.0117,r=0.9950。其中,A为吸光值,C为葡萄糖浓度。
精确吸取样品处理液1.0 mL置于10 mL比色管中,加水补足至2.0 mL,样品管和空白管中加入苯酚溶液1.0 mL,摇匀,迅速加浓硫酸5.0 mL,摇匀放置5 min,置沸水浴中加热15 min,取出冷却至室温,以空白校正零点,于490 nm处用1.0 mL比色皿测吸光度[5-6]。
2 结果与分析
2.1 5种氮源对蛹虫草发菌的影响
由表1可知,添加蛋白胨、蚕蛹粉的菌丝健壮、浓密、洁白,菌丝生长速度较快,且菌丝生长速度显著高于添加牛肉膏、黄豆粉、酵母粉处理。对照处理蛹虫草菌丝生长速度显著低于各添加氮源处理。说明适当添加氮源有利于蛹虫草菌丝生长。

表1 不同氮源对蛹虫草发菌阶段的影响
注:表中所列数据为平均值±标准差;同列数据后不同小写字母表示其在0.05水平下差异显著,下表同。
2.2 5种氮源对蛹虫草子实体生长的影响
由表2可知,添加氮源处理蛹虫草子实体的畸形率显著低于对照;添加氮源处理蛹虫草子实体的平均高度显著高于对照。除处理Ⅵ外,各处理的出草率均显著高于对照。说明添加氮源有利于子实体生长,且以添加蚕蛹粉处理最佳,其次是添加蛋白胨处理。除处理Ⅵ外,各处理的干品产量均显著高于对照,且添加蚕蛹粉处理干品产量最高。
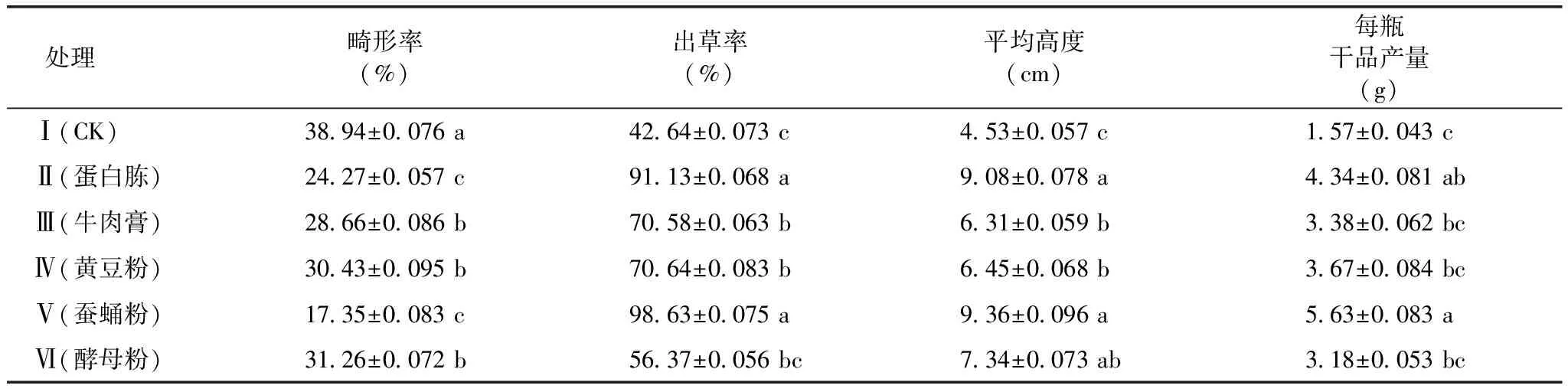
表2 5种氮源对蛹虫草子实体生长的影响
2.3 5种氮源对虫草素及虫草多糖含量的影响
由表3可知,与对照处理相比,添加氮源处理虫草素的含量及产量、虫草多糖的含量与产量均增加,说明添加氮源更有利于虫草素、虫草多糖的积累。添加蚕蛹粉处理的虫草素含量及产量均明显高于其他处理,蛋白胨次之。添加蛋白胨处理的虫草多糖含量显著高于其他氮源处理,添加蚕蛹粉处理的虫草多糖产量显著高于其他处理。
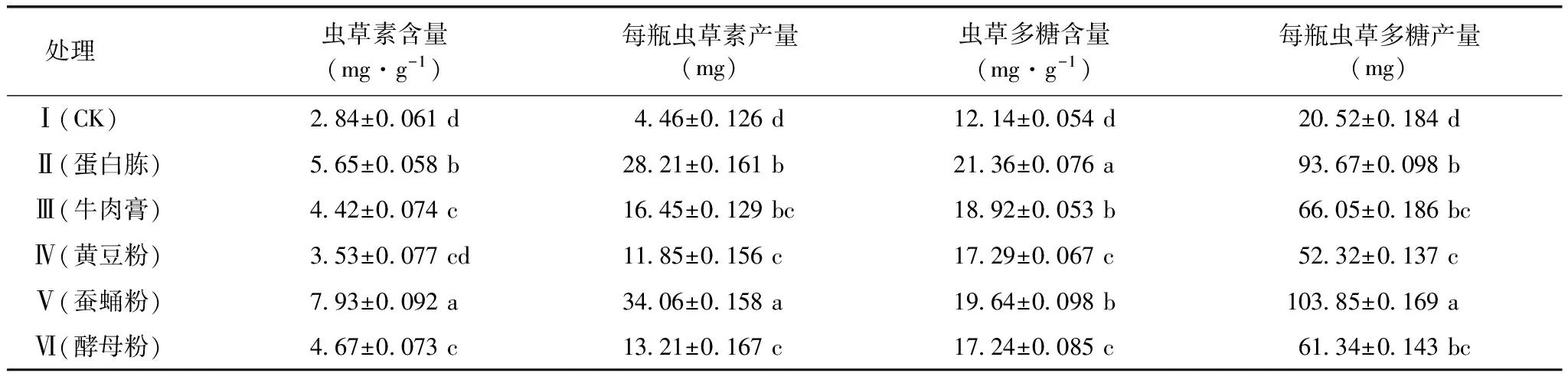
表3 5种氮源对虫草素及虫草多糖含量的影响
3 讨论
添加氮源对蛹虫草整个生长过程都有很大的促进作用,且以添加蛋白胨和蚕蛹粉处理更有利于蛹虫草生长,子实体产量和质量均较高,虫草素的含量与产量,虫草多糖的含量及产量均相对较高。说明添加蛋白胨和蚕蛹粉均能促进蛹虫草的生长及有效成分的积累。添加蚕蛹粉处理的虫草素含量及产量均最高,分别达到(7.93±0.092)mg·g-1和每瓶(34.06±0.158)mg。添加蛋白胨处理虫草多糖含量最高,达到(21.36±0.076)mg·g-1,但由于子实体产量相对添加蚕蛹粉处理低,造成虫草多糖产量低于添加蚕蛹粉处理;添加蚕蛹粉处理的虫草多糖产量最高,每瓶达(103.85±0.169)mg。因此,建议添加蚕蛹粉作为氮源,更适合高产量、高质量蛹虫草的栽培生产。
参考文献:
[1]郑壮丽,黄春花,梅彩英,等.蛹虫草国内外研究的新进展[J].环境昆虫报,2011,3(2):225-233.
[2]曾照芳,罗光丽.虫草素临床应用研究概述[J].实用中医药杂志,2010,26(9):666-668.
[3]张平,朱述钧,钱大顺,等.北冬虫夏草功能成分及保健作用分析[J].江苏农业科学,2003(6):105-107.
[4]CHO H J,CHO J Y ,RHEE M H ,et al.Cordycepin(3-deoxyaden sine)in hibits human platelet aggregation acyclic AMP and cyclic GMP-dependent manner[J].European Journal of Pharmacology,2007,558(1):43-51.
[5]王蕾,于荣敏,张辉,等.人工培养蛹虫草多糖的分离纯化及其结构的初步研究[J].中国生化药物杂志, 2003(1): 23-25.
[6]卢晓岩.硫酸-苯酚法测定北冬虫夏草多糖含量[J].食品工业科技,2002,23(4):69-70.
