TLR2和TLR4受体封闭肽对LPS诱导的小鼠腹腔巨噬细胞TNF-α表达的影响
2018-05-08钱英红徐博然曹金山
钱英红 ,徐博然 ,刘 博 ,曹金山 ,关 红 ,毛 伟
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;3.农业部动物临床诊疗技术重点实验室,内蒙古 呼和浩特 010018)
细菌等病原微生物感染动物机体后会发生天然免疫过程。在这一过程中模式识别受体Toll样受体 (Toll-like receptors,TLRs)发挥着重要的作用,病原分子能够与其结合,激活相关的信号转导通路,可作为重要的纽带将天然免疫和获得性免疫联系起来,进而在免疫性疾病的治疗过程中产生重要的作用。TLRs能够与包括细菌及其内毒素等模式识别分子发生非特异性结合,激活的TLRs可促进细胞因子和炎症介质的合成分泌,同时还可使炎症细胞发生浸润,促使机体发生炎症反应。有文献报道,TLR2和TLR4在机体抵御细菌感染引发炎症反应发生过程中具有关键的作用,其激活效应如能得到有效的控制,可降低动物机体炎症反应发生的程度[1-2]。综上所述,该研究拟以小鼠腹腔巨噬细胞为研究对象,按照文献中TLR2和TLR4的序列进行受体封闭肽的合成,采用荧光定量PCR技术检测了TLR2和TLR4的特异性受体封闭肽对小鼠腹腔巨噬细胞肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA 表达的影响,探讨TLR2和TLR4受体在细菌毒素脂多糖(Lipopoly-saccharides,LPS)刺激小鼠腹腔巨噬细胞过程中对TNF-α基因表达影响的作用机制。

表1 受体封闭肽合成序列

表2 试验分组
1 材料
1.1 实验动物
实验动物选择 6~8 周龄,体重 18~22 g,雌、雄各半的C57BL/6J小鼠,由内蒙古医科大学动物实验中心提供。
1.2 试验试剂
反转录试剂盒由宝生物工程(大连)有限公司提供;SYBR Green荧光定量PCR试剂盒由Roche公司提供;细菌脂多糖由美国Invitrogen公司提供;小鼠TNF-α ELISA检测试剂盒由美国Biolegend公司提供;其他试剂均为国产或进口分析纯。
2 试验方法
2.1 小鼠腹腔巨噬细胞的分离培养
参照刘博[3]报道的方法进行小鼠腹腔巨噬细胞的分离培养。
2.2 TLR2和TLR4受体封闭肽的合成
根据Toshchakov等[4]研究报道中TLR2和TLR4封闭小肽序列进行合成,序列见表1。TLR2和 TLR4 受体封闭肽、对照肽(control peptide,CP)均由吉尔生化公司合成。
2.3 分组及给药
成功分离培养小鼠腹腔巨噬细胞后,按照2.5×106个/mL细胞浓度,加入到6孔细胞培养板中进行贴壁培养并给予相应的药物作用,试验分组见表2。
2.4 TLR2和TLR4受体封闭肽对小鼠腹腔巨噬细胞细胞因子TNF-α mRNA表达的影响
2.4.1 引物设计与合成:根据GenBank中公布的小鼠TNF-α序列(NM 013693.2)设计引物序列,TNF-α上游引物序列为CTTCTCATTCCTGCTTGTG,TNF-α下游引物序列为 ACTTGGTG-GTTTGCTACG。以管家基因GAPDH为内参照,引物由上海捷瑞生物工程有限公司合成。

表3RT-PCR反应体系
2.4.2 总RNA的提取:试验分组如表2。TLR2和TLR4受体封闭肽预处理24 h后,加入LPS(浓度为100 ng/mL)刺激4 h,对各组细胞进行总RNA的提取。具体试验方法按照总RNA制备试剂盒说明书进行。
2.4.3 cDNA的制备:按照反转录试剂盒说明书进行cDNA的制备。样本置于-20℃冰箱保存待用。
2.4.4 RT-PCR检测细胞因子TNF-α mRNA的表达量:按照表3配制RT-PCR反应体系。
按照如下反应条件进行荧光定量PCR反应:50 ℃,2 min,1 个循环;95 ℃,10 min,1 个循环;95℃ 15 s,60℃ 60 s,共 38个循环。 Real-time PCR检测数据采用2-△Ct(△Ct=目的基因Ct值-GAPDH Ct值)进行计算,结果以平均值±标准差表示。
3 结果
由图1可知,TLR2和TLR4受体封闭肽作用组中TNF-α mRNA的相对表达量极显著降低于LPS刺激组和 CP对照组(P<0.01);而 LPS刺激组中TNF-α mRNA的相对表达量与CP对照组相比较无显著性差异(P>0.05)。由此可说明,当加入TLR2和TLR4受体封闭肽作用于小鼠腹腔巨噬细胞后,TNF-α基因的相对表达量降低。
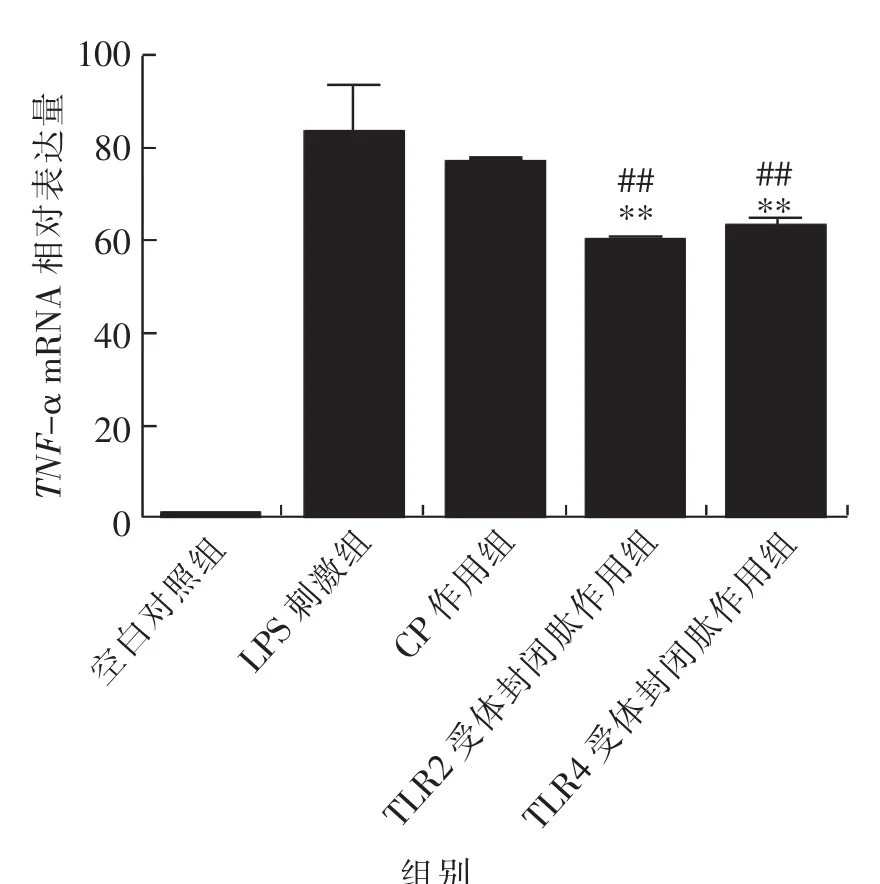
图1 小鼠腹腔巨噬细胞TNF-α mRNA相对表达量
4 讨论
在机体发生炎症反应的过程中,TLR2与TLR4介导的信号转导通路发挥着最为重要的作用,当其激活后所引起的信号级联反应是导致炎症反应加剧的最主要原因。研究显示,LPS主要是通过识别TLR2受体,进而激活其介导的信号通路引发炎症反应的发生。而随后的研究还发现TLR4也是识别LPS并介导炎症反应的主要受体。当LPS刺激细胞后可通过MyD88和TRIF依赖性途径募集下游接头分子,进而使NF-κB和MAPK信号通路激活,启动炎症相关基因的表达,促使细胞释放TNF-α、IL-1β以及IL-8等细胞因子,同时导致趋化因子RANTES和抗炎性因子IL-10的表达量升高[5-7]。
封闭肽是指遵循模拟天然蛋白之间相互作用位点的氨基酸序列而合成的小肽,能够与原蛋白的结合位点发生结合效应,进而使原蛋白之间的特异性相互作用受到阻碍。大量的研究表明,封闭肽能够抑制信号通路的转导和激活,从而在疾病的治疗过程中发挥重要的作用[8]。因此,该研究采用荧光定量PCR技术检测了TLR2和TLR4受体封闭肽对LPS诱导下小鼠腹腔巨噬细胞TNF-α mRNA表达的影响。研究结果显示,TLR2和TLR4受体封闭肽能够抑制LPS诱导下小鼠腹腔巨噬细胞TNF-α基因的表达。由此可知,TLR2和TLR4受体封闭肽能够在LPS诱导的小鼠腹腔巨噬细胞炎症反应发生的过程中对细胞因子的表达产生影响,为日后封闭肽在临床上推广使用提供了试验支持,对未来联合用药以及新药的研发具有一定的意义。
参考文献:
[1]曹雪涛.免疫学前沿进展[M].北京:人民卫生出版社,2010.
[2]景志忠.TOLL样受体与天然免疫[M].兰州:兰州大学出版社,2012.
[3]刘博.小鼠巨噬细胞TLR2、TLR4及RP105在金黄色葡萄球菌感染中的天然免疫应答机制[D].长春:吉林大学,2013.
[4]TOSHCHAKOV V Y, FENTON M J, VOGEL S N.Cutting Edge:Differential inhibition of TLR signaling pathways by cell-permeable peptides representing BB loops of TLRs[J].Journal of Immunology, 2007, 178(5):2655-2660.
[5]NARAYANAN K B,PARK H H.Toll/interleukin-1 receptor (TIR) domain-mediated cellular signaling pathways[J].Apoptosis,2015,20(2):196-209.
[6]ROCK F L, HARDIMAN G, TIMANS J C, et al.A family ofhuman receptors structurally related to Drosophila Toll[J].PNAS,1998,95(2):588-593.
[7]JIMENEZ L A,THOMSON J,BROWN D,et al.PM10 particles activate NF-kappa B in alveolar epithelial cells[J].American Journal of Respiratory&Critical Care Medicine,1999,159(3):A27.
[8]VOGEL S N,FENTON M.Toll-like receptor 4 signalling:new perspectives on a complex signaltransductionproblem[J].BiochemicalSocietyTransactions,2003,31(3):664-668.
