miRNA-506对上皮性卵巢癌细胞增殖及侵袭迁移能力的影响
2018-05-08李明娥陈递林黄妙瑜蔡如玉宋振坤郭玉霞
李明娥,陈递林,黄妙瑜,蔡如玉,杨 熠,宋振坤,郭玉霞
(暨南大学第二临床医学院,深圳市人民医院妇科,深圳 518020;*通讯作者,E-mail:dilin-c@163.com)
卵巢恶性肿瘤的发病率在全球女性生殖系统恶性肿瘤位居第三,死亡率居第一。上皮性卵巢癌(epithelial ovarian cancer,EOC)占卵巢恶性肿瘤的85%-90%,其恶性程度高、病情发展迅速,仍然是妇科恶性肿瘤患者死亡的主要原因[1,2]。现有研究结果证实,miRNAs具有癌基因或抑癌基因的双重行为[3],其表达异常有可能成为卵巢癌早期诊断及预后评估的生物学标志物。有研究报道,miRNA-506是miRNA调控当中的一个关键miRNA,通过与不同的靶基因结合,从而抑制相应靶基因的表达,表现为在不同类型的肿瘤中的微环境发挥抑癌基因的功能,在肿瘤浸润及侵袭转移中发挥极为重要的作用[4-6],但有关miRNA-506在上皮性卵巢癌的研究极少。本研究旨在探讨miRNA-506对上皮性卵巢癌细胞增殖及侵袭迁移能力的影响。
1 材料与方法
1.1 实验材料
人类卵巢癌细胞系A2780、ES-2、Ovar-3和SK-OV-3购于中国科学院上海生物科学所细胞库。外源性质粒hsa-miRNA-506 mimics、hsa-miRNA-506 inhibitor由上海吉玛制药技术有限公司合成和纯化。引物均购自中国上海生科院,Lipofectamine 2000 reagent(Invitrogen,美国),基质胶(BD生物科学,美国),Matrigel(BD公司,USA),Transwell小室(8 μm孔径的滤器,Corning,NY,USA)。
1.2 细胞培养
分别将人类卵巢癌细胞A2780、ES-2、Ovar-3和SK-OV-3细胞加入DMEM培养基,在37 ℃、5% CO2培养箱中进行培养,细胞贴壁生长,用0.25%胰蛋白酶/EDTA消化分散细胞,每3 d传代1次。
1.3 q-PCR检测miRNA-506的表达
逆转录合成cDNA第一链后进行real time PCR扩增,获得上皮性卵巢癌A2780、ES-2、Ovar-3、SK-OV-3细胞株的Ct值,以U6作为内参校正误差,运用2-ΔΔCt相对定量法来计算这4种细胞系miRNA-506的相对表达量。
1.4 细胞转染
根据上述实验结果,选取相对低表达miRNA-506的细胞株及过表达miRNA-506的细胞株,采用脂质体法细胞转染,分别转染hsa-miRNA-506 mi-mics、hsa-miRNA-506 inhibitor,分成miRNA-506抑制表达和过表达组。空白对照组使用相同体积的培养基,转染Lipofectamine。转染8 h后,10%胎牛血清的DMEM换为无血清培养基,37 ℃的CO2培养箱培养48 h采用qRT-PCR检测转染后卵巢癌细胞株的miRNA-506表达量。其值越高,表示该细胞株的miRNA-506相对表达量越高。
1.5 CCK 8法检测细胞增殖实验
将对数期生长期细胞悬液接种于96孔培养板(100 μl/孔;4 000细胞/孔),37 ℃5%CO2培养12 h。脂质体转染,继续细胞培养72 h,加CCK-8试剂溶液10 μl/孔,培养1.5 h。酶联免疫检测仪450 nm测定吸光度,其吸光度越高表示该细胞株的增殖率越高。
1.6 细胞迁移和侵袭实验
迁移实验:在无血清培养基中,取5×105/ml A2780细胞或3×105/ml SK-OV-3细胞50 μl接种于Transwell小室的上室,在小室下室添加10%胎牛血清的培养液500 μl,置入37 ℃,5%的CO2培养箱培养24 h,拭去上室上表面细胞。滤器的下表面的细胞用0.05%结晶紫染色30 min。在显微镜系统下计算计数5个单独的视野中迁移到下室的细胞,取平均值。侵袭实验:细胞侵袭实验如前所述。步骤与迁移实验相同,除了Transwell小室涂上基质胶。抹去膜上细胞,在膜下方的细胞使用0.05%结晶紫染色固定。在显微镜下(×200)5个单独的视野的染色细胞数,取平均值。所有的实验重复3次。
1.7 统计学分析
所有结果数据表示为正态分布计量资料均数±标准差,使用SPSS 13.0进行数据分析,组间差异采用两独立样本的t检验分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同细胞系中miRNA-506表达量
qRT-PCR检测人类卵巢癌细胞系A2780、ES-2、Ovar-3和SK-OV-3中miRNA-506的相对表达量。A2780细胞系相对表达量为1±0.070 39,ES-2细胞系相对表达量为0.014 27±0.003 306,Ovar-3细胞系相对表达量为0.078 96±0.013 32,SK-OV-3细胞系相对表达量为0.003 779±0.000 456。A2780细胞系表达量最高,SK-OV-3细胞系表达量最低(见图1)。
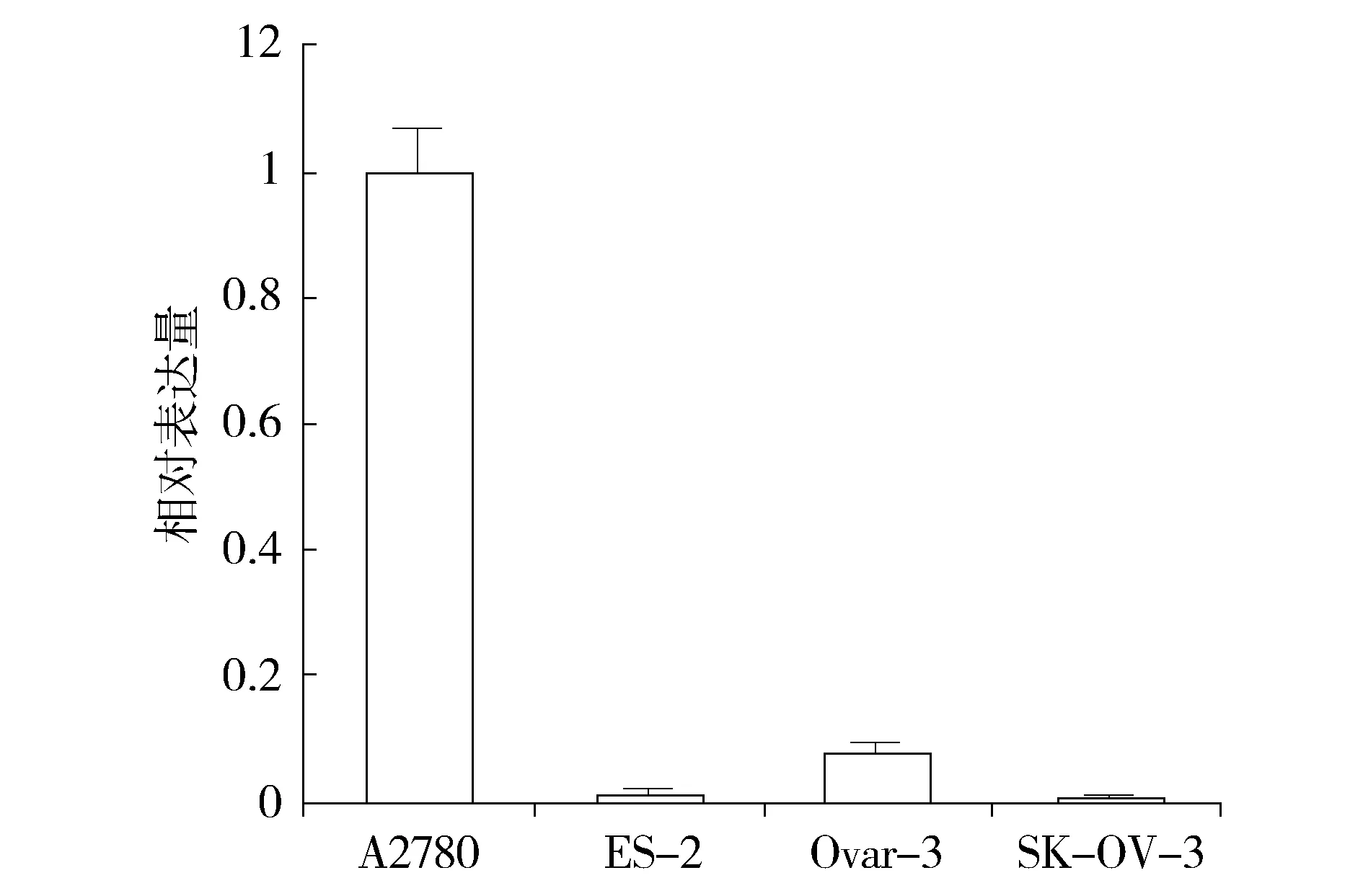
图1 不同细胞系miRNA-506的相对表达量Figure 1 The relative expression of miRNA-506 in different kind of cell lines
2.2 miRNA-506对上皮性卵巢癌细胞增殖的影响
CCK-8实验结果显示,转染miRNA-506 inhibitor质粒的A2780细胞系A450值为2.309 5±0.011 7,空白对照组A450值为2.221 6±0.022 8,转染组高于对照组(t=5.938,P<0.05)。转染miRNA-506 mimics质粒的SK-OV-3细胞系的A450值为2.010 6±0.095 0,空白对照组A450值为2.174 4±0.043 6,转染组低于对照组(t=6.351,P<0.05,见图2)。
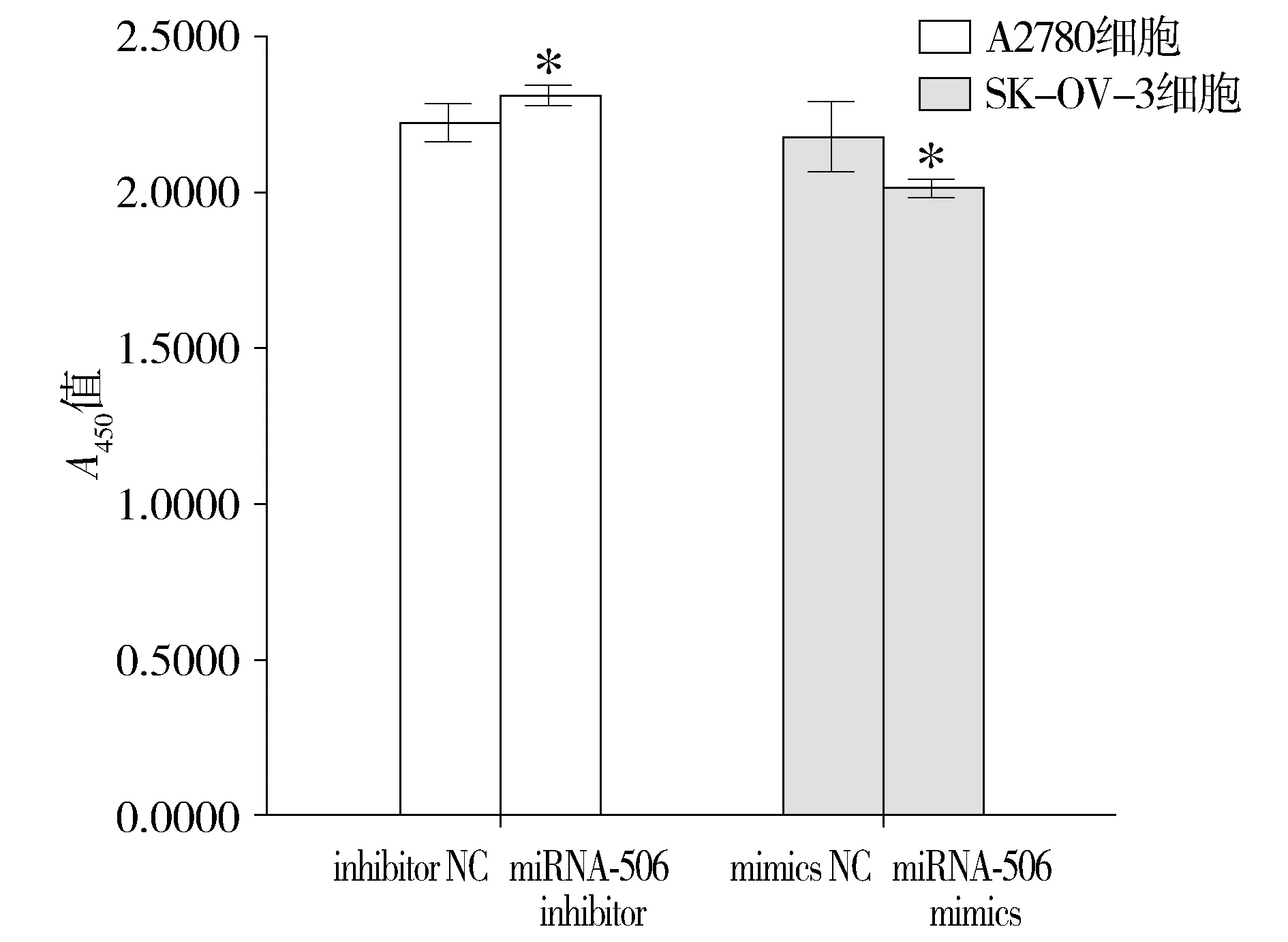
同细胞系与对照组(NC)比较,*P<0.05图2 CCK-8试剂对不同研究组细胞增殖水平检测结果Figure 2 Proliferation levels in different groups by CCK8
2.3 miRNA-506对上皮性卵巢癌细胞迁移能力的影响
转染miRNA-506 inhibitor质粒的A2780细胞系迁移细胞数为126±10.91,空白对照迁移细胞数为95±11.11,两组比较差异有统计学意义(t=4.45,P=0.002)。转染miRNA-506 mimics质粒的SK-OV-3细胞系的迁移细胞数为103.2±9.78,空白对照组为121.0±5.61,两组相比差异有统计学意义(t=3.529,P=0.008,见图3)。

图3 采用Transwell小室检测不同转染组细胞迁移能力结果Figure 3 Cell migration in different cell lines after different transfection using Transwell assays
2.4 miRNA-506对上皮性卵巢癌细胞侵袭能力的影响
转染miRNA-506 inhibitor质粒的A2780细胞系的侵袭细胞数为25.0±14.20,空白对照组为16.6±7.89,miRNA-506表达抑制组细胞数少于对照组(见图4),但两组相比差异无统计学意义(t=1.156,P=0.281)。转染miRNA-506 mimics质粒的SK-OV-3细胞系的细胞个数为52.4±8.47,空白对照组为67.2±9.68,两组相比差异有统计学意义(t=2.572,P=0.033,见图4)。

图4 Transwell小室检测不同转染组细胞侵袭能力结果Figure 4 Cell invasion in different cell lines after different transfection using Transwell assays
3 讨论
卵巢恶性肿瘤具有多样性及异质性,发病率位居妇科恶性肿瘤第三位,但死亡率居首位。虽然新的化疗药物不断出现及靶向治疗有新进展,但卵巢癌的5年生存率仍较低(34%-45%)。已经确定的是,上皮性卵巢癌预后不良与肿瘤细胞的侵袭迁移关系密切相关[7]。因此,探讨其发病机制及寻找有效治疗靶点至关重要。
从肿瘤细胞侵袭转移方面着手,miRNA发挥重要抑癌基因或癌基因作用[8-10],就组织特异性、敏感性、降解难易度及检测的方便性来讲,miRNA是肿瘤早期诊断、肿瘤标志物及分子治疗靶向的研究方向[11,12]。有学者报道,相比较miRNA-506高表达的患者,miRNA-506低表达患者预后较差[5,13],miRNA-506异常表达足以抑制细胞增殖、侵袭,并影响细胞的黏附力和伪足运动,从而影响细胞分化、增殖或凋亡等,最终参与肿瘤的发生、发展、迁移侵袭[14-16]。新近研究表明,miRNA-506在上皮性肿瘤的进展、浸润及侵袭转移中发挥极为重要的作用,乳腺癌、结直肠癌、宫颈癌、肾透明细胞癌、卵巢癌等肿瘤中的微环境发挥抑癌基因的功能,不同程度地参与调控细胞增殖、细胞凋亡、细胞周期、细胞衰老、细胞分化、上皮-间质转化、细胞侵袭和转移等过程,抑制恶性肿瘤细胞的侵袭及转移能力,达到影响肿瘤发生发展的效果[4-6,14,17]。
本研究以上皮性卵巢癌细胞系为研究对象,选取了miRNA-506高表达的细胞系A2780及低表达的SK-OV-3,在高表达细胞系中转染抑制表达,在低表达细胞系转染表达模拟物,研究结果表明,转染后A2780系的增殖率增加、侵袭迁移能力增强。这与Liu等[18]研究结果相似,但本次实验结果差异并非完全有统计学意义,需进一步的研究探讨。有学者通过利用EOC细胞系SK-OV-3构建裸鼠移植瘤模型的实验,证实了miRNA-506抑制上皮性卵巢癌生长、侵袭、转移,同时通过体外培养和转染miRNA-506 mimics实验证实了miRNA-506影响卵巢癌细胞上皮间质转化的标志物,并验证了对细胞侵袭能力的影响,明确表达miRNA-506的抑制作用[19]。本研究结果表明,在miRNA-506低表达的SK-OV-3细胞系中,通过转染miRNA-506模拟物,细胞的增殖率显著下降,侵袭迁移能力亦明显下降,均有统计学意义。
综上所述,miRNA-506在上皮性卵巢癌细胞系的增殖、侵袭迁移中发挥着一定的调节作用,这为探索上皮性卵巢癌的发病机制以及寻找新的基因治疗靶点提供了实验依据。
参考文献:
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics,2016[J].CA Cancer J Clin, 2016,66(1):7-30.
[2] Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CACancer J Clin, 2015, 65(1):5-29.
[3] Calin GA, Croce CM. MicroRNA-cancer connection: the beginning of a new tale.[J]. Cancer Res, 2006, 66(15):7390.
[4] Yu F, Lv M, Li D,etal. MiR-506 Over-Expression Inhibits Proliferation and Metastasis of Breast Cancer Cells[J]. Med Sci Monit, 2015, 21: 1687-1692.
[5] Deng J, Lei W, Xiang X,etal. MicroRNA-506 inhibits gastric cancer proliferation and invasion by directly targeting Yap1[J]. Tumour Biol,2015,36(9):6823-6831.
[6] 李明娥,陈递林,郑华珠,等.miRNA-506在浆液性卵巢癌组织中的表达及临床意义[J].山西医科大学学报,2017,48(9):954-956.
[7] Prat J. Staging classification for cancer of the ovary, fallopian tube, and peritoneum [J]. Int J Gynecol Obstet, 2014, 124(1):1-5.
[8] Reza AM,Choi YJ,etal.Human adipose mesenchymal stem cell-derived exosomal-miRNAs are critical factors for inducing anti-proliferation signalling to A2780 and SKOV-3 ovarian cancer cells[J].Sci Rep, 2016, 6:38498.
[9] Yin S,Fan Y, Zhang H,etal.Differential tgfbeta pathway targeting by mir-122 in humans and mice affects liver cancer metastasis[J].Nat Commun, 2016,7:11012.
[10] Qian J,Kong X,Deng N,etal.Octl is a determinant of synbindin-related erk signalling with independent prognostic significance in gastric cancer [J].Gut,2015,64(1):37-48.
[11] van Marion DM,Domanska UM, Timmer-Bosscha H,etal.Studying cancer metastasis:Existing models,challenges and future perspectives[J].Crit Rev Oncol Hematol,2016,97:107-117.
[12] 杨芳,于雁.肿瘤微环境——肿瘤转移的关键因素[J].中国肺癌杂志,2015,18(1):48-54.
[13] Zhang Y, Lin C, Liao G,etal. MicroRNA-506 suppresses tumor proliferation and metastasis in colon cancer by directly targeting the oncogeneEZH2[J].Oncotarget,2015,6(32):32586-32601.
[14] Wang Y, Cui M, Sun BD,etal. MiR-506 suppresses proliferation of hepatoma cells through targeting YAP mRNA 3'UTR[J]. Acta Pharmacol Sin,2014,35(9):1207-1214.
[15] Wen SY, Lin Y, Yu YQ,etal. miR-506 acts as a tumor suppressor by directly targeting the hedgehog pathway transcription factor Gli3 in human cervical cancer[J].Oncogene,2015,34(6):717-725.
[16] Yang FQ, Zhang HM, Chen SJ,etal. MiR-506 is down-regulated in clear cell renal cell carcinoma and inhibits cell growth and metastasis via targeting FLOT1[J].PloS One,2015,10(3):e0120258.
[17] Sakimura S, Sugimachi K, Kurashige J,etal. The miR-506-induced epithelial-mesenchymal transition is involved in poor prognosis for patientswith gastric cancer [J].Ann Surg Oncol,2015,3:1436-1443.
[18] Liu G, Sun Y, Ji P,etal.MiR-506 suppresses proliferation and induces senescence by directly targeting the CDK4/6-FOXM1 axis in ovarian cancer[J].J Pathol, 2014, 233(3):308-318.
[19] 张靖宜,孙燕.microRNA-506在不同肿瘤中作用的研究进展[J].中国肿瘤临床,2016,43(3):120-124.
