基于核磁共振图像的人体面部软组织的分割
2018-05-08,,,,
,,,,
(浙江工业大学 计算机科学与技术学院,浙江 杭州 310023)
使用数字断层序列图像构造人体面部模型是计算机图形图像学及医疗领域中一个十分活跃的研究热点.人体面部模型的参数可以帮助医生进行准确和客观的医学诊断,模型的可视化还可以为医生提供手术方案的仿真及术后效果的模拟.而分割出面部不同类型的组织(如脂肪、肌肉和皮肤等),且对组织的生物特征进行定性定量的测量,是构建上述三维面部模型的数据基础.因此,人体面部软组织的分割在医学诊断和临床治疗上都有重要的意义[1].目前,国内外学者对软组织的分割研究大多集中在大脑和心肺等组织,对于面部软组织的研究工作相对较少.同时,头部作为整个人体中最为复杂的部分,其组织大多浅薄,相互连接并且结构复杂,分割难度较大.另外,医学图像分割易受图像噪音、灰度不均匀性以及部分容积效应的影响.因此,面部软组织的分割是一项具有挑战性的工作.
在已有的研究工作中,大部分的脂肪组织分割方法都以腿部及腹部为研究目标[2-4],其目标脂肪组织厚实且均匀,不适用于细薄且厚度不均的面部脂肪组织的分割.近年来,基于先验信息的肌肉组织分割方法被陆续提出[5-7],这类算法可以实现准确的肌肉组织分割,但是其分割精度依赖于训练数据集的规模,而医学图像的获取涉及病人的隐私,大数据集的获取十分困难.Ng等[8-9]通过追踪面部肌肉(如咬肌、翼内外肌)的手动分割轮廓得到一个模版,该模版储存了面部肌肉区域与头部区域的相对位置信息,根据该模版可以从MRI图中自动检测到面部肌肉区域,以此肌肉区域作为梯度矢量流的初始轮廓,进行演化得到分割结果,该方法的模版获取过程困难且耗费时间.Ng等[10]采用改进的分水岭方法实现MRI图像上咬肌的分割,该方法通过一系列的措施来改善分水岭算法过分割的问题,其中包括使用高斯滤波进行图像预处理,自动阈值改进sobel算子得到的滤波图像的梯度幅值图,以及在分水岭算法得到的初始分割上进行后分割融合,该方法的计算复杂度低但是其分割准确率也偏低.为实现较为准确的面部软组织分割,结合MICO算法与区域生长法设计了一种脂肪组织的分割方法,该方法通过灰度不均匀矫正,以及初分类移除背景,二次分割提取脂肪实现了较传统算法更为准确的脂肪组织分割.于此同时,还提出了一种改进的DRLSE方法实现了咬肌组织的分割,该方法设计了一个新的边缘停止函数解决了DRLSE方法的误分割问题.该方法实现简单,不依赖于数据集大小且实现了较高的平均分割准确率.
1 脂肪组织的分割
脂肪组织是面部软组织中分布最广的一类组织,面部脂肪主要指位于皮肤下的皮下脂肪,皮下脂肪结构完善且连贯,对于人脸部的外观形状有很大的影响,是面部外科整形手术的常见手术对象,其位置大小参数对医学诊断和临床治疗有很重要的意义.
脂肪组织受MRI图像中普遍存在的噪音、伪影、灰度不均匀和相邻相似灰度组织的影响,其分割存在一定的难度.笔者采用MICO算法对面部MRI图像进行灰度不均匀矫正和面部主要组织的预分类分割,之后通过图像运算得到去除了大部分背景的初脂肪组织分割图像,在此图像上采用区域生长进行二次分割并对结果进行形态学处理,实现了脂肪组织的分割.并将该方法的实验结果与传统的图像分割算法结果进行比较,结果证明笔者提出的方法得到的脂肪组织结果更为精确.
1.1 MRI图像预处理及组织分类分割
MRI图像存在的灰度不均匀性使得位于不同位置的脂肪组织呈现不同的灰度值(图1),这会在很大程度上影响脂肪组织分割的准确率,因此对MRI图像进行灰度不均匀矫正显得尤为重要.
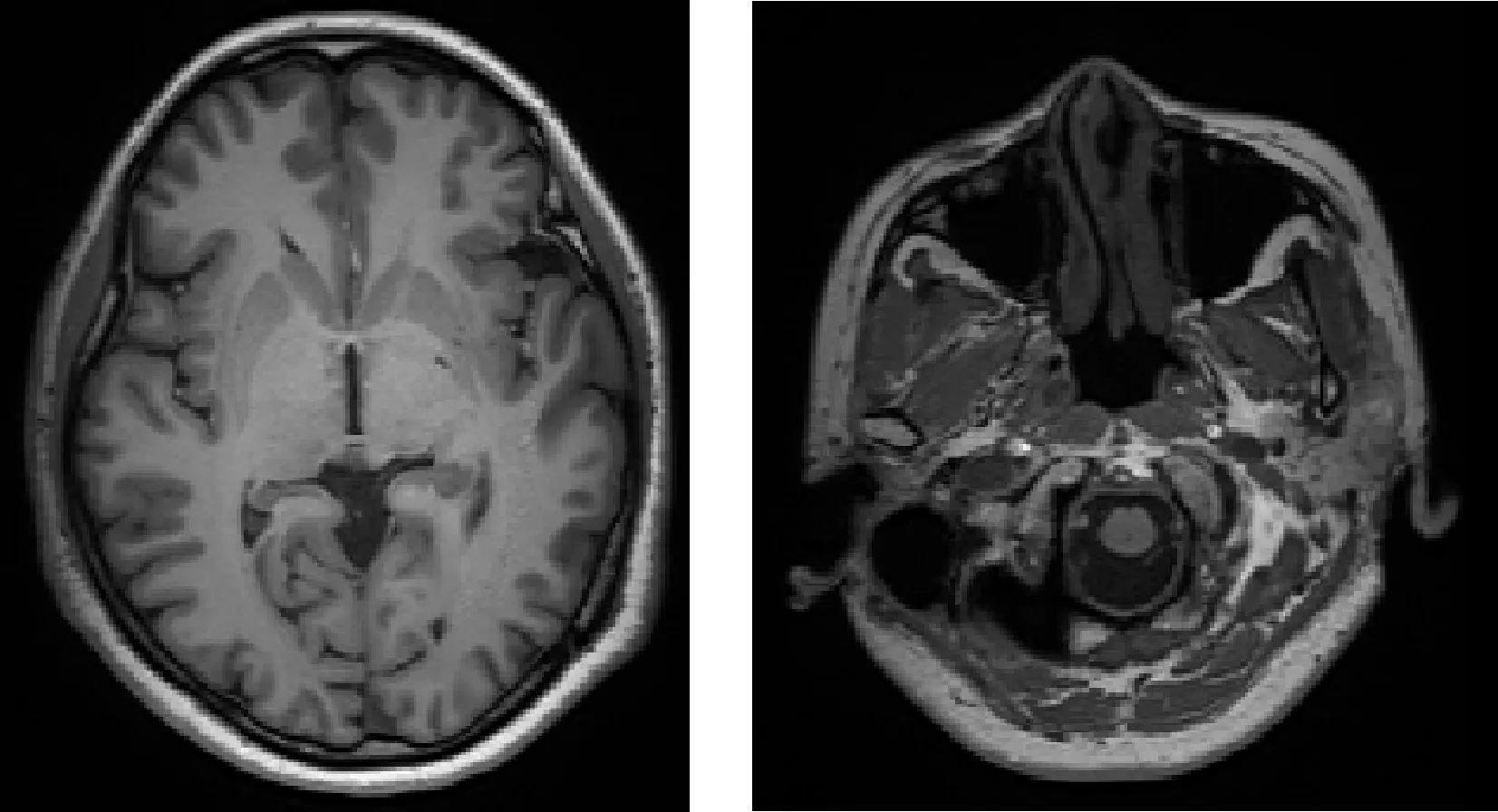
图1 面部MRI图像Fig.1 The facial MRI images
乘法内在分量优化[11](Multiplicative intrinsic component optimization,MICO)是一种结合了MRI图像灰度不均匀矫正及组织分割的能量最小化方法.该方法将MRI图像分解为两个乘法分量构成公式,通过能量最小化方法最优化这两个乘法分量,使MICO算法可以同时实现灰度不均匀矫正及组织分割.MRI图像I的模型化公式为
I(x)=b(x)J(x)+n(x)
(1)
式中:I(x)为待处理图像在像素点x上的灰度值;J(x)为真实图像,它定义了组织的物理特性,且属于相同类别组织的像素点的值是固定的,比如属于第i类组织的像素点的取值为ci;b(x)为偏移场;n(x)为均值为0的附加噪音.

b(x)=wTG(x)
(2)

(3)
根据式(1),构建能量函数为
(4)
代入式(2)偏移场b和式(3)真实图像J的数学描述,经整理,得到能量函数表达式为
(5)
式中q≥1是使成员函数的值域为[0,1]的模糊器.从式(5)可以看出:能量函数的最小化已经被转换为对u,c,w的优化,通过固定3个参数中的其中2个参数计算另1个参数的优化值,然后递归迭代求出最后的优化值.
1.2 引入区域生长法进行二次分割
MICO算法会对面部MRI图像进行灰度不均匀矫正,并且对面部主要的组织进行分类分割.但是组织的分类结果大多会包含很多灰度相似的非目标组织(图2),因此需要对经MICO算法处理过的分类结果进行二次精细分割.

图2 灰度不均匀矫正及分类结果图Fig.2 The images of bias field estimation and tissue classification
因皮下脂肪组织结构完善且连续,采用区域生长法进行二次精细分割.区域生长法利用图像的局部空间信息,适用于提取灰度特征相似的连通区域,十分适用于脂肪组织的提取.
二次分割的步骤如下:
1)将偏移矫正后的图像与脂肪组织分类图像相乘,得到移除大部分背景的具有灰度特征的待处理图像.
2)在1)中得到的图像中选取种子点.
3)在种子点处进行8邻域扩展,如果种子点的8邻域像素与种子点的灰度差的绝对值小于设定的阈值T,则该像素与种子点合并为同一区域,并作为新种子点等待生长.
4)重复3)直到没有新的像素满足合并条件,区域生长停止.
5)对4)中的结果进行形态学处理,用以填充细小空洞,得到最终分割结果.形态学处理指的是基于数学形态学的闭运算处理[12].闭运算可以填充图像中的细小空洞,平滑边缘,其定义为
A·B=(A⊕B)⊖B
(6)
式中:A为目标图像;B为结构元素;⊕为膨胀运算;⊖为腐蚀运算.图3为设计方法的具体框架图.

图3 分割框架图Fig.3 The frame graph of segmentation
2 肌肉组织的分割
肌肉组织是面部软组织的重要组成部分之一.而咬肌组织作为面部肌肉组织,其大小形状不仅影响咀嚼力的大小,还会影响面下部宽度和下颌角的形态,更是确定下颌角及咬肌肥大畸形患者治疗方案的重要指标之一.鉴于咬肌在面部形状和医学诊断上的重要性,笔者将肌肉组织的研究重点放在咬肌组织上.
咬肌组织的背景组织繁多,灰度信息复杂,且存在相邻相似灰度的组织.因此咬肌组织的分割是一项相对较有挑战的工作.笔者提出了一种新的基于MRI图像的咬肌分割方法,该方法通过构建一个新的边缘停止函数改进了距离正则化水平集,将相位一致性引入构造边缘停止函数,结合图像的梯度信息和相位信息来解决咬肌的分割问题.该方法在50张咬肌的MRI图像上进行了测试,测试结果显示该方法可以提取到临床可接受的咬肌分割结果.
2.1 距离正则化水平集
距离正则化水平集(Distance regularized level set evolution,DRLSE)由Li等[13]提出,该模型在基于边缘的主动轮廓模型中增加了一个距离正则项,完全消除了重初始化水平集函数的需要,提高了水平集演化的效率和准确率.距离正则项是一个势函数,它使水平集函数的梯度幅值趋向函数中的一个最小值以保证水平集函数的期望形状,并通过驱动水平集演化过程中的前向-后向扩散,保持了水平集函数的规则性.距离正则化水平集可应用于感兴趣区域边缘的准确提取,并且保证提取到的边缘是光滑且闭合的,这是分割生物组织结构的关键[14].假设水平集函数φ:Ω→R,距离正则化水平集的能量函数E(φ)可定义为

(7)
式中:μ>0,λ>0,α∈R分别为常量;p为距离正则化的势函数;δ为Dirac函数;H为Heaviside函数;g为边缘停止函数.
引入距离正则项的目的是为了平滑水平集函数,并且通过保持符号距离属性|▽φ|=1确保水平集演化正确.为了满足上述目的,势函数p定义为一个双井函数,表达式为
(8)
基于梯度的边缘停止函数g定义为
g
(9)
式中:I为输入图像;Gσ为标准差σ的高斯内核;(Gσ*I)为卷积,用于平滑图像.g通常在边缘位置取得较小值.
式(7)中的能量函数通过梯度流实现最小化,即

(10)
DRLSE中的边缘停止函数g是随梯度值增大而减小的单调递减函数,因此g可能会在梯度值较大的噪音处陷入一个局部最小值,也可能在存在灰度不均匀性的非边缘区域因图像梯度较大而取到近零值[15].以上这些都会导致水平集的错误演化.
使用DRLSE分割咬肌,可以发现使用仅利用梯度信息的边缘停止函数驱使水平集演化会出现错误,如图4(d)所示.原因就在于边缘停止函数在假边缘处取到了局部最小值.假边缘是由咬肌的解剖结构和核磁共振成像的成像特点导致的.咬肌内侧分布着上颌支,在MRI图像中,咬肌呈灰色,上颌支中的骨髓呈白色,骨骼呈黑色.因此,咬肌的内侧边缘会有灰-黑-白的分布(图4b),灰黑边缘为咬肌实际边缘,其梯度小于黑白假边缘,使得g取到局部最小值,水平集演化向假边缘处.

图4 咬肌的原图及分割结果图Fig.4 The original images of masseter and the results of segmentation
2.2 为DRLSE构建新的边缘停止函数
DRLSE利用图像的梯度信息实现分割,但仅依靠图像的梯度信息无法准确地分割出咬肌组织.并且咬肌的相邻组织结构复杂,灰度不均,融合基于区域的灰度信息无法发挥较大作用,因此引入相位一致性特征[16]对DRLSE进行改进.
相位一致性假设图像特征出现在相位傅立叶分量最大的点[17],它对于图像灰度和对比度变化不敏感,抗噪能力强.对于二维图像,相位一致性可以表示为
(11)
(12)
式中:o为方向索引;Ano(x),ΔΦno(x)分别为第n个傅立叶分量在o方向上的幅度和局部相位差;To为o方向上的估计噪音;Wo(x)为加权函数;ε为常数,用于避免除数为零.
相位一致性由log Gabor小波提取到的图像信号的频率信息和不同频率下的相位信息计算而得,不受图像对比度的影响,能够获得可靠完整的图像边缘特征,被广泛地应用于图像的边缘检测.因此,相位一致性可以提取到咬肌图像丰富的边缘特征信息(图5b),且它的取值范围为[0,1],越靠近边缘取值越接近于1,越远离边缘取值越接近于0,因此将相位一致性提取到的边缘特征转换为梯度信息可以在咬肌边缘处得到局部最大梯度值(图5c).由此可构建新的边缘停止函数为
(13)
式中:Ω为整个图像域;Ωinside,Ωoutside分别为咬肌的内外侧区域,由初始轮廓决定;λ为常数,用于扩充相位一致性图谱的灰度域,取值为256.

图5 相位一致性应用的一组例子Fig.5 An example of phase congruency
3 实验与结果
实验测试在两组数据集上进行,数据集由医院放射科提供(采集自两位志愿者).笔者将脂肪组织的分割结果与几种传统的脂肪组织分割算法结果进行对比.而对咬肌组织的结果分析,从两方面考虑:一方面对比改进的DRLSE方法与原DRLSE方法;另一方面通过比较自动分割结果与手工分割结果的重合率来验证改进方法的分割准确率.
图6显示了笔者提出的脂肪组织分割方法与传统的区域生长法、模糊C均值聚类法(FCM),活动轮廓模型(ACM)以及图割方法的分割结果对比,从图6中可以明显地观察到笔者方法的分割结果相对较为准确.笔者方法不仅解决了因MRI图像灰度不均匀导致的组织欠分割问题以及相似灰度组织导致的过分割问题,且利用形态学运算处理了区域生长法常见的空洞的问题,得到了更为准确的脂肪组织分割结果.

图6 笔者方法和传统算法之间的对比Fig.6 The comparison the proposed method and the traditional algorithm
图7为笔者提出的咬肌分割方法和DRLSE方法的对比.为两种方法设定相同的初始轮廓并演化,改进后的方法演化到了更为准确的咬肌边缘轮廓.由此可以得出:笔者提出的方法成功地改进了DRLSE方法,解决了边缘停止函数陷入局部最小值的问题,避免了轮廓曲线的演化泄漏到错误的边缘位置.
表1为改进的咬肌分割方法在2组数据集上的准确率结果,2组数据集上的平均准确率为92.41%.采用κ索引[18]方法评估自动分割结果和手动分割结果的重合率用来计算分割的准确率.κ索引的定义为
(14)
式中:M,S分别为笔者提出方法和手动分割法得到的咬肌区域;M∩S为M和S的重叠区域;N(·)表示区域内包含的像素个数.改进方法的平均准确率为92.41%.在目前已有的研究咬肌分割的文献中,有一些方法与笔者使用了相同的准确率验证技术(表2),经对比,改进的DRLSE方法获得的平均准确率相对高于其他方法.

图7 改进方法与DRLSE的对比Fig.7 The comparison of the modified method and the DRLSE

第1组图像序号分割准确率/%第2组图像序号分割准确率/%第1组图像序号分割准确率/%第2组图像序号分割准确率/%4592.445190.695892.296492.984691.565294.075991.976593.464794.485391.736092.156690.894892.265493.626192.896791.694992.945593.136291.906894.145092.525693.066391.506991.435191.275791.616490.407092.955293.135893.726591.447191.445394.695996.636691.587292.475493.456094.976791.427390.555593.816193.366890.867492.285692.456291.356990.237591.145791.426391.84

表2 不同方法的平均准确率对比Table 2 The comparison of average accuracy using different methods %
4 结 论
结合MICO算法和区域生长法,提出了一种脂肪组织分割方法,该方法采用MICO算法对灰度不均匀的MRI图像进行处理,通过图像运算得到移除了大部分背景的初脂肪组织分割图像,在此图像上接着采用区域生长法进行二次分割并对分割结果进行形态学处理,得到了较传统算法更为准确的脂肪组织分割结果.同时,还提出了一种改进的DRLSE方法用于实现咬肌组织的分割.该方法通过引入相位一致性特征为DRLSE方法构造了一个新的边缘停止函数,以处理DRLSE采用的仅基于图像梯度的边缘停止函数易在假边缘处取到局部最小值而导致的误分割问题.该方法改进了DRLSE,并且实现了较高准确率的咬肌分割.
参考文献:
[1] 汪晓妍,郑焕彰,黄晓洁,等.上下文窄带约束下腹主动脉瘤外轮廓分割[J].浙江工业大学学报,2015,43(6):642-648.
[2] TAN C, YAN Z, ZHANG S, et al. An automated and robust framework for quantification of muscle and fat in the thigh[C]//22nd International Conference on Pattern Recognition (ICPR). Piscataway, NJ: IEEE,2014:3173-3178.
[3] SUSSMAN D L, YAO J, SUMMERS R M. Automated fat measurement and segmentation with intensity inhomogeneity correction[C]//Medical Imaging: Image Processing. Bellingham, United States: SPIE,2010:76233X-76233X-8.
[4] ORGIU S, LAFORTUNA C L, RASTELLI F, et al. Automatic muscle and fat segmentation in the thigh from T1-Weighted MRI[J]. Journal of magnetic resonance imaging,2015,43(3):601-610.
[5] YOUSEF R, ILKAY U. The effect of labeled/unlabeled prior information for masseter segmentation[J]. Mathematical problems in engineering,2013(1):1-12.
[6] MAJEED T, FUNDANA K, LUTHI M, et al. A shape prior-based MRF model for 3D masseter muscle segmentation[C]//Medical Imaging: Image Processing. Bellingham, United States: SPIE,2012:83140O-83140O-7.
[7] YOUSEF R, ILKAY U. Automatic 3D segmentation of individual facial muscles using unlabeled prior information[J]. International journal of computer assisted radiology and surgery,2012(7):35-41.
[8] NG H P, ONG S H, GOH P S, et al. Template-based automatic segmentation of masseter using prior knowledge[C]//IEEE Southwest Symposium on Image Analysis & Interpretation. Piscataway, NJ: IEEE,2006:208-212.
[9] NG H P, ONG S H, FOONG K W C, et al. Automatic segmentation of muscles of mastication from magnetic resonance images using prior knowledge[C]//18th International Conference on Pattern Recognition(ICPR). Piscataway, NJ :IEEE,2006:968-971.
[10] NG H P, ONG S H, FOONG K W C, et al. Masseter segmentation using an improved watershed algorithm with unsupervised classification[J]. Computers in biology and medicine,2008,38(2):171-184.
[11] LI C, GORE J C, DAVATZIKOS C. Multiplicative intrinsic component optimization (MICO) for MRI bias field estimation and tissue segmentation[J]. Magnetic resonance imaging,2014,32(7):913-923.
[12] 吴福理,鲁锦樑,胡同森.基于BF-WS的肝脏CT图像的自动分割[J].浙江工业大学学报,2015,43(6):630-635.
[13] LI CHUNMING, XU CHENYANG,GUI CHANGFENG, et al. Distance regularized level set evolution and its application to image segmentation[J]. IEEE transactions on image processing,2010,19(12):3243-3254.
[14] LIU Y, CAPTUR G, MOON J C, et al. Distance regularized two level sets for segmentation of left and right ventricles from cine-MRI[J]. Magnetic resonance imaging,2016,34(5):699-706.
[15] QI Yong, ZHANG Tao. Region-based method of adaptive distance preserving level set evolution[J]. Research journal of applied sciences, engineering and technology,2013,5(5):1608-1613.
[16] KOVESI P. Image features from phase congruency[J]. Videre: journal of computer vision research,1999,1(3):1-26.
[17] 张建华,张自然,汪晓妍,等.基于结构显著性的医学图像质量评价[J].浙江工业大学学报,2015,43(6):636-641.
[18] VAN L K, MAES F, VANDERMEULEN D, et al. Automated model-based tissue classification of MR images of the brain[J]. IEEE transactions on medical imaging,1999,18(10):897-908.
