催产素减轻新生大鼠海马神经元缺氧缺血性损伤*
2018-05-07谢常宁王欣萌彭斯聪肖凌慧
谢常宁, 吴 俭▲, 王欣萌, 彭斯聪, 吴 静, 肖凌慧, 柳 涛, 2, 3△
(南昌大学第一附属医院 1儿科, 2医学科研中心, 3江西省分子诊断与精准医学重点实验室, 江西 南昌 330006)
围生期窒息所引起的新生儿缺氧缺血性脑病(neonatal hypoxic-ischemic encephalopathy,NHIE)常并发多种神经系统后遗症,如脑瘫[1],严重危害儿童健康。目前治疗手段有限且疗效不佳[2-3],因此探求NHIE治疗的新途径迫在眉睫。
海马是NHIE最常累及的部位,其主要原因有:(1)脑缺血后,脑血流二次重新分配导致海马梗死;(2)N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)型谷氨酸受体在海马CA1区高度表达,易引起兴奋性毒性,使其对缺氧缺血尤其敏感[4]。海马CA1区是海马神经环路的最后一站,对维持海马的正常功能(如学习和记忆)具有重要作用[5]。因此,减少缺氧缺血所导致的海马CA1区神经元损伤是治疗NHIE的关键。
抑制性突触传递可拮抗神经元NMDA受体激活导致的兴奋性毒性,对局部神经环路的稳定具有重要作用。γ-氨基丁酸(γ-aminobutyric acid,GABA)是大脑内最主要的抑制性神经递质,使其信号增强的药物,如唑吡坦和氯镁噻唑等,均被证实对缺氧缺血后的神经元损伤具有保护作用[6-7]。催产素(oxytocin)是一种由下丘脑室旁核和视上核的大细胞所合成的古老的神经肽,具有分娩发动和乳汁分泌等作用而被长期应用于临床。在海马中,催产素可增强幼年(3~5周龄)大鼠海马CA1区椎体神经元GABAA受体介导的自发性抑制性突触后电流[8]。近年来,研究表明催产素对多种神经系统疾病具有治疗作用,如中风[9-10]及帕金森病[11]。由于神经系统发育分化的复杂性,神经环路的结构和功能在围产期、幼年及成年尽管相互关联,但又有各自不同的特点。目前催产素在新生动物缺氧缺血性损伤中的作用尚不明确。本研究探讨了催产素对新生大鼠海马CA1区神经元缺氧缺血性损伤的保护作用并揭示了其细胞机制,为催产素用于临床治疗NHIE提供理论基础。
材 料 和 方 法
1 动物及分组
本研究的动物实验严格按照《南昌大学实验动物管理办法》和《南昌大学动物实验伦理审查》原则进行。健康7~10 d 龄Sprague-Dawley(SD)大鼠,雌雄不限,由江西中医药大学动物中心提供。取8只新生大鼠的海马脑片(6~8片/只),随机分为4个处理组:对照(control)组、氧糖剥夺(oxygen-glucose deprivation,OGD) 20 min组、OGD 40 min组和OGD+oxytocin组。OGD 20 min组和OGD+oxytocin组孵育时间为20 min,OGD 40 min组孵育时间为40 min。全细胞膜片钳记录另取20只新生大鼠随机分为4组,即OGD组、OGD+oxytocin组、OGD+dVOT(催产素受体阻断剂)+oxytocin组和OGD+bicuculline(GABAA受体阻断剂)+oxytocin组。
2 溶液及试剂
解剖液(即蔗糖高渗人工脑脊液,sucrose-substituted artificial cerebrospinal fluid,s-ACSF)成分为 (mmol/L):240 sucrose、2.5 KCl、3.5 MgCl2、0.5 CaCl2、1.25 NaH2PO4、0.4 ascorbic acid、2 pyruvate和25 NaHCO3;人工脑脊液(artificial cerebrospinal fluid,ACSF)成分为 (mmol/L):117 NaCl、3.6 KCl、1.2 NaH2PO4·2H2O、2.5 CaCl2·2H2O、1.2 MgCl2·6H2O、25 NaHCO3和11 glucose,pH 7.4;钾电极内液成分为(mmol/L):130 K-gluconate、5 KCl、4 Mg-ATP、10 phosphocreatinine、0.5 EGTA、0.3 Li-GTP和10 HEPES,pH 7.3,300 mOsm。催产素(1 μmol/L)、哇巴因(500 μmol/L)和bicuculline(10 μmol/L)购自Sigma;dVOT(1 μmol/L) 购自Bachem;TO-PRO-3 (1∶2 000)购自Invitrogen。
3 方法
3.1脑片制备 选取7~10 d 龄SD大鼠置于0 ℃冰水混合物中冰冻麻醉,采用2~4 ℃预充氧(95% O2+5% CO2)的解剖液行心脏灌流后将大鼠断头。用VT1000S震动切片机(Leica)进行350 μm厚度的脑冠状切片,后将切片移入32 ℃持续充氧(95% O2+5% CO2)的ACSF中孵育1 h后移入记录槽。
3.2制备体外缺血缺氧模型 OGD液是目前应用最普遍的用于模拟体外缺氧缺血的液体,其制备方法是将正常ACSF中的葡萄糖用相同摩尔质量的蔗糖代替,并充混合气(95% N2+5% CO2)30 min以排尽溶液中的氧气。在记录细胞的缺氧去极化(anoxic depolarization,AD)时间时,为加速细胞死亡,于OGD液中加入钠-钾泵抑制剂哇巴因以诱导缺氧缺血所引起的细胞死亡[12]。
3.3TO-PRO-3染色 上述制备的脑片于ACSF液中恢复1 h后,将分好组的脑片放入上述4种溶液中进行孵育(37 ℃)。随后将其置于TO-PRO-3溶液中染色20 min(室温),用ACSF洗去残余染液。将脑片置于LSM700激光共聚焦显微镜(Zeiss)下观察,激发光波长为639 nm,拍照时各参数保持一致。用ZEN2010软件统计每个切片CA1区面积为500 μm×500 μm中TO-PRO-3荧光阳性神经元的数目。
3.4全细胞膜片钳技术 在红外相差显微镜下定位海马CA1区椎体神经元。记录电极(1.5 mm,1.12 mm ID; World Precision Instruments)由P-97电极拉制仪(Sutter Instrument)拉制而成,入液电阻为4~6 MΩ。灌流速度为1~3 mL/min。电流钳模式下记录缺氧去极化时间,钳制电流为0 pA,所有记录的神经元的静息膜电位低于-45 mV,记录温度为32±1 ℃。信号采集采用EPC-10放大系统(HEAK),分析数据用Clamp-Fit软件。串联电阻在20~30 MΩ之间,且在记录过程中变化<20%。
4 统计学处理
数据分析用SPSS 17.0软件。所有参数用均数±标准误(mean±SEM)表示,n代表脑切片个数(TO-PRO-3染色实验)或神经元个数(电生理实验)。多组间比较采用单因素方差分析,事后检验采用 Bonferroni校正检验法。以P<0.05为有统计学意义。
结 果
1 OGD对海马神经元死亡的影响
为明确催产素的神经保护作用,我们采用TO-PRO-3染色方法标记死亡神经元,红色荧光代表TO-PRO-3荧光所标记的死亡神经元。根据之前的研究[13-14],我们选择催产素浓度为1 μmol/L。结果显示,OGD孵育20 min后,海马CA1区TO-PRO-3阳性的神经元数目比对照组增加(P<0.01); OGD 40 min组与OGD 20 min组相比,神经元死亡数量增加差异无统计学意义,见图1。这提示缺氧缺血后20 min神经元已发生严重的不可逆性死亡,因此在缺氧缺血早期对神经元进行保护是十分必要的,接下来的药物实验亦以此为时间点开展进一步研究。
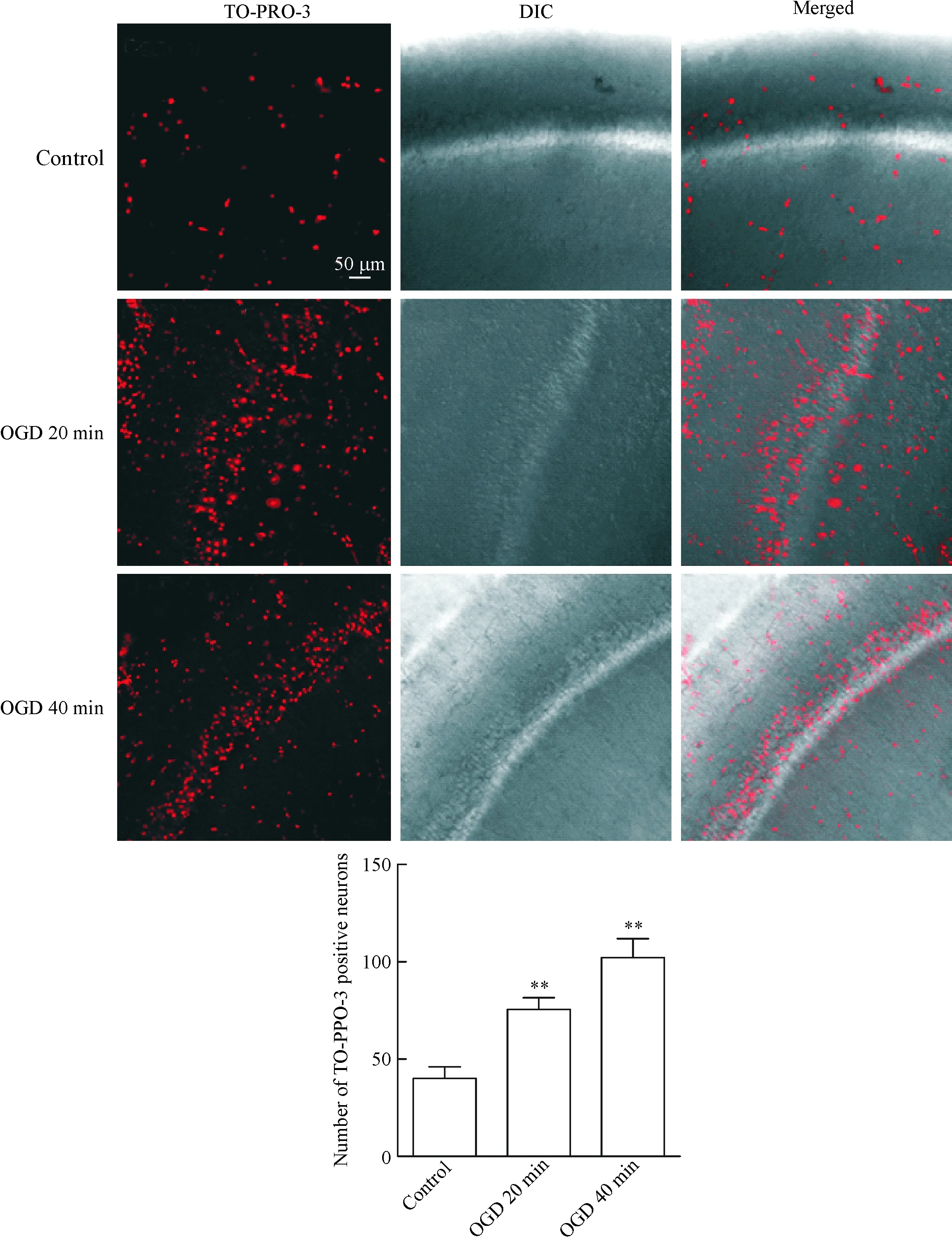
Figure 1. The effect of OGD on the death of hippocampal neurons (TO-PRO-3 staining, ×20). DIC: differential interference contrast. Mean±SEM.n=14 in control group;n=9 in OGD 20 min group;n=10 in OGD 40 min group.**P<0.01vscontrol group.
图1OGD对海马神经元死亡的影响
2 催产素干预减少OGD所致的神经元死亡
在OGD液中加入催产素后,海马CA1区TO-PRO-3阳性的神经元平均死亡数量比OGD 20 min组减少(P<0.01),提示催产素可减少新生大鼠海马CA1区神经元缺氧缺血后的死亡,具有神经保护作用,见图2。
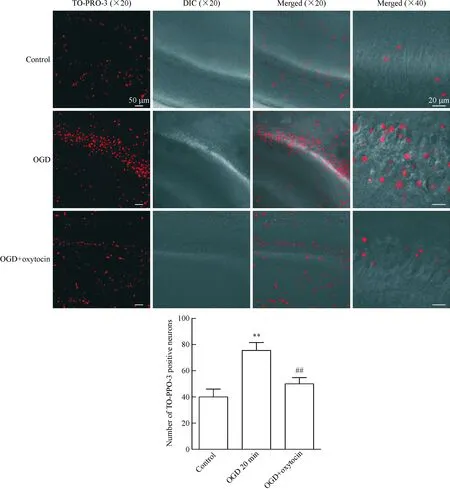
Figure 2. Oxytocin reduced the death of neurons caused by OGD (TO-PRO-3 staining). DIC: differential interference contrast. Mean±SEM.n=14 in control group;n=9 OGD 20 min group;n=10 OGD+oxytocin group.**P<0.01vscontrol group;##P<0.01vsOGD 20 min group.
图2催产素干预减少OGD所致的神经元死亡
3 催产素显著延长新生大鼠海马神经元AD时间,其机制与GABAA受体介导的电流有关
为明确催产素对神经元缺氧缺血性损伤的保护作用机制,我们进一步观察各组神经元AD出现的时间。如图3所示,OGD组AD出现的时间是(13.44±1.84) min,相比OGD组,OGD+oxytocin组AD出现的时间延长至(23.19±2.04) min (P<0.01),提示催产素可提高海马神经元对缺氧缺血的耐受能力;OGD+dVOT+oxytocin组AD出现的时间是(15.49±1.74) min,相比OGD+oxytocin组,AD出现时间显著缩短(P<0.05);相比OGD+oxytocin组,OGD+bicuculline+oxytocin组的AD出现时间[(12.66±2.24) min]也明显缩短(P<0.01)。以上结果提示,催产素对新生大鼠海马神经元缺氧缺血性损伤具有拮抗作用,其作用可被dVOT和bicuculline所抑制,这表明催产素的神经保护作用是通过结合催产素受体所发挥,并且与GABAA受体介导的电流有关。
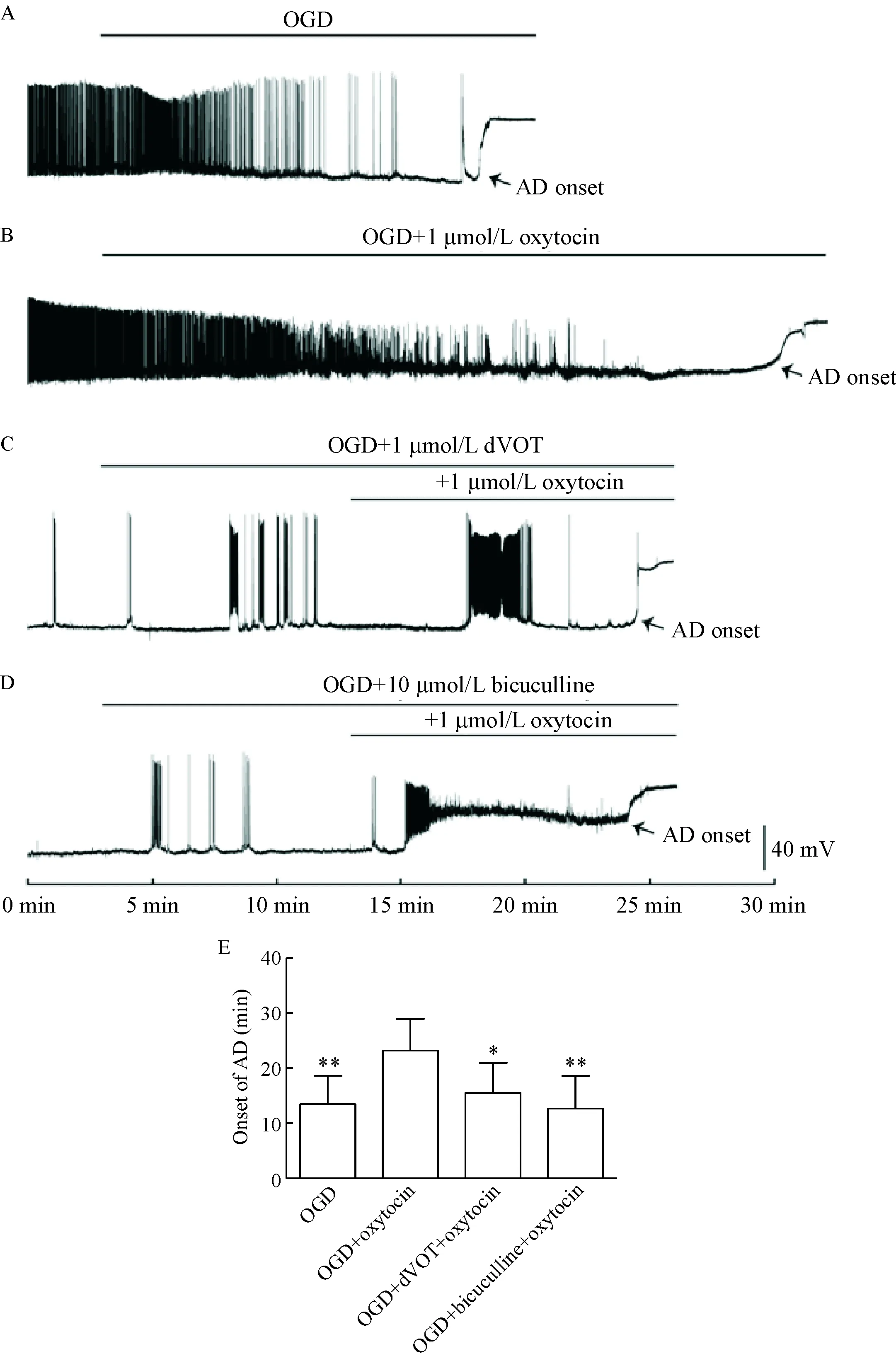
Figure 3. Oxytocin delayed the onset of anoxic depolarization (AD) of hippocampal CA1 pyramidal neurons. Below the traces, arrows indicated the appearance of AD. In this figure, a bar on top of the trace indicated the perfusion period unless noted elsewhere. A: representative recordings of the AD onset in OGD group (n=9); B: representative recordings of the AD onset in OGD+oxytocin group (n=9); C: representative recordings of the AD onset in OGD+dVOT+oxytocin group (n=11); D: representative recordings of the AD onset in OGD+bicuculline+oxytocin group (n=8); E: summary of the onset of anoxic AD under different conditions. Mean±SEM.*P<0.05,**P<0.01vsOGD+oxytocin group.
图3催产素对新生大鼠海马神经元缺氧去极化时间的影响
讨 论
新生儿缺氧缺血性脑损伤发病机制复杂,其中兴奋性毒性是导致神经元死亡的重要原因。缺氧缺血所产生的神经元兴奋性毒性主要是由于兴奋性神经递质增强如谷氨酸大量释放[4]以及抑制性神经递质减弱如神经元丢失及GABA受体功能障碍[15]。本研究证实催产素可减少体外缺氧缺血所致的神经元死亡,其主要机制与催产素通过与神经元上催产素受体结合,增加抑制性传递,从而消除兴奋性毒性有关。
本实验TO-PRO-3染色结果表明,氧糖剥夺20 min导致新生大鼠海马CA1区神经元死亡数量显著增加,与之前报道[16]基本一致,提示在神经元缺氧缺血的早期采取有效的干预措施是十分有必要的。此外,我们的研究结果表明,催产素能显著减少氧糖剥夺20 min导致的神经元死亡。
近年来,随着对催产素的病理生理功能的深入研究,研究表明催产素对神经元损伤具有保护作用[9-10],但机制仍然不明确。为进一步探讨催产素的神经保护作用机制,我们研究了催产素对新生大鼠海马神经元缺氧去极化时间的影响。缺氧去极化是电生理学上判断神经元死亡的重要标志之一。由于缺氧去极化使神经元膜电位迅速去极化至0 mV,钾离子大量外流及钠离子和钙离子内流,神经元和突触功能发生不可逆性损伤[17]。因此,延长神经元缺氧去极化的时间,可为减少神经元的死亡赢得宝贵时间[18-19]。本研究结果显示,催产素显著延长了新生大鼠海马椎体神经元缺氧去极化的时间,这与TO-PRO-3染色的结果一致。催产素受体在海马CA1广泛分布,如19%的GABA能神经元表达催产素受体,而80%以上的椎体神经元表达催产素受体[20]。我们观察到催产素的保护作用可被催产素受体阻断剂dVOT抑制,这表明催产素是通过结合的海马神经元膜上的催产素受体产生保护作用。
在海马中,催产素增强抑制性神经传递,其机制是调控抑制性中间神经元,促使GABA释放增加,激活GABAA受体,增强突触GABA介导的电流[8, 21]。抑制性神经传递如GABA可减少神经元缺氧缺血后谷氨酸的释放,从而拮抗缺氧缺血所产生的兴奋性毒性[22],因此被认为是神经元缺氧缺血性损伤的保护机制之一。例如,地西泮、唑吡坦及氯镁噻唑等GABA受体增强剂在动物实验中被证实具有保护作用[6-7]。本研究表明,bicuculline阻断GABAA受体后,催产素并不能延长AD出现的时间。因此,我们推测催产素的对新生大鼠的神经保护作用主要与GABAA受体介导的突触后电流增强有关。Kaneko等[9]研究从分子生物上证实催产素调控GABAA受体亚基组成,增强GABAA受体效能,拮抗神经元的兴奋性毒性,这与我们的研究具有相似性。而Ceanga等[13]和Tyzio等[14]的研究认为催产素可以降低胎鼠海马神经元降低钠-钾-氯共同转运体的活性,促进GABA受体转变为抑制性[13-14],我们认为这种结果的差异与实验动物发育期不同有关。
综上所述,催产素对新生大鼠海马神经元缺氧缺血性损伤具有保护作用,其机制是通过结合催产素受体增强GABA能中间神经元的活动,使GABA释放,拮抗神经元的兴奋性毒性,提高催产素对缺氧缺血的耐受能力。我们的研究将为催产素用于新生儿缺氧缺血性脑病的治疗提供新思路。
[参考文献]
[1] Adhikari S, Rao KS. Neurodevelopmental outcome of term infants with perinatal asphyxia with hypoxic ischemic encephalopathy stage II[J]. Brain Dev, 2017, 39(2):107-111.
[2] Tagin M, Abdel-Hady H, ur Rahman S, et al. Neuroprotection for perinatal hypoxic ischemic encephalopathy in low- and middle-Income Countries[J]. J Pediatr, 2015, 167(1):25-28.
[3] Liu L, Oza S, Hogan D, et al. Global, regional, and national causes of child mortality in 2000-13, with projections to inform post-2015 priorities: an updated systematic analysis[J]. Lancet, 2015, 385(9966):430-440.
[4] Gee CE, Benquet P, Raineteau O, et al. NMDA receptors and the differential ischemic vulnerability of hippocampal neurons[J]. Eur J Neurosci, 2006, 23(10):2595-2603.
[5] Remondes M, Schuman EM. Role for a cortical input to hippocampal area CA1 in the consolidation of a long-term memory[J]. Nature, 2004, 431(7009):699-703.
[6] Hiu T, Farzampour Z, Paz JT, et al. Enhanced phasic GABA inhibition during the repair phase of stroke: a novel therapeutic target[J]. Brain, 2016, 139(2):468-480.
[7] Vandevrede L, Tavassoli E, Luo J, et al. Novel analogues of chlormethiazole are neuroprotective in four cellular mo-dels of neurodegeneration by a mechanism with variable dependence on GABAAreceptor potentiation[J]. Br J Pharmacol, 2014, 171(2):389-402.
[8] Zaninetti M, Raggenbass M. Oxytocin receptor agonists enhance inhibitory synaptic transmission in the rat hippocampus by activating interneurons in stratum pyramidale[J]. Eur J Neurosci, 2000, 12(11):3975-3984.
[9] Kaneko Y, Pappas C, Tajiri N, et al. Oxytocin modulates GABAAR subunits to confer neuroprotection in strokeinvitro[J]. Sci Rep, 2016, 6:35659.
[10] Karelina K, Stuller KA, Jarrett B, et al. Oxytocin mediates social neuroprotection after cerebral ischemia[J]. Stroke, 2011, 42(12):3606-3611.
[11] Erbas O, Oltulu F, Taskiran D. Amelioration of rotenone-induced dopaminergic cell death in the striatum by oxytocin treatment[J]. Peptides, 2012, 38(2):312-317.
[12] White SH, Brisson CD, Andrew RD. Examining protection from anoxic depolarization by the drugs dibucaine and carbetapentane using whole cell recording from CA1 neurons[J]. J Neurophysiol, 2012, 107(8):2083-2095.
[13] Ceanga M, Spataru A, Zagrean AM. Oxytocin is neuroprotective against oxygen-glucose deprivation and reoxyge-nation in immature hippocampal cultures[J]. Neurosci Lett, 2010, 477(1):15-18.
[14] Tyzio R, Cossart R, Khalilov I, et al. Maternal oxytocin triggers a transient inhibitory switch in GABA signaling in the fetal brain during delivery[J]. Science, 2006, 314(5806):1788-1792.
[15] Almeida-Suhett CP, Prager EM, Pidoplichko V, et al. GABAergic interneuronal loss and reduced inhibitory sy-naptic transmission in the hippocampal CA1 region after mild traumatic brain injury[J]. Exp Neurol, 2015, 273:11-23.
[16] Fernandez-Lopez D, Martinez-Orgado J, Casanova I, et al. Immature rat brain slices exposed to oxygen-glucose deprivation as an in vitro model of neonatal hypoxic-ischemic encephalopathy[J]. J Neurosci Methods, 2005, 145(1-2):205-212.
[17] Tanaka E, Yamamoto S, Kudo Y, et al. Mechanisms underlying the rapid depolarization produced by deprivation of oxygen and glucose in rat hippocampal CA1 neuronsinvitro[J]. J Neurophysiol, 1997, 78(2):891-902.
[18] Somjen GG. Mechanisms of spreading depression and hypoxic spreading depression-like depolarization[J]. Physiol Rev, 2001, 81(3):1065-1096.
[19] 梁华为, 夏 强. ROS介导线粒体ATP敏感性钾通道开放剂对缺氧脑的保护作用[J]. 中国病理生理杂志, 2005, 21(10):2018-2021.
[20] Ripamonti S, Ambrozkiewicz MC, Guzzi F, et al. Tran-sient oxytocin signaling primes the development and function of excitatory hippocampal neurons[J]. Elife, 2017, 6:e22466.
[21] Owen SF, Tuncdemir SN, Bader PL, et al. Oxytocin enhances hippocampal spike transmission by modulating fast-spiking interneurons[J]. Nature, 2013, 500(7463):458-462.
[22] Matsumoto N, Kumamoto E, Furue H, et al. GABA-mediated inhibition of glutamate release during ischemia in substantia gelatinosa of the adult rat[J]. J Neurophysiol, 2003, 89(1):257-264.
