舒洛地特对低氧状态下人真皮微血管内皮细胞凋亡的影响*
2018-05-07桂福强
桂福强, 罗 鸿, 刘 洪, 朱 桦, 张 矛, 赵 渝
(重庆医科大学附属第一医院血管外科, 重庆 400016)
下肢静脉性溃疡(venous leg ulcer,VLU)是慢性静脉功能不全(chronic venous insufficiency, CVI)最严重的临床分级,全球成人发病率约为1%。VLU一旦形成,便经久不愈,不仅会严重影响患者工作和生活,而且还会给家庭带来不小的医疗开销[1]。CVI是下肢静脉高压导致的一系列综合结果,包括静脉瓣膜功能不全、深浅静脉瓣膜功能障碍、静脉返流或者阻塞[2]。早期CVI若不予以干预最终会导致皮肤微循环功能障碍,主要表现为炎症因子浸润、真皮微血管纤维蛋白沉积和局部低氧,最终发展为VLU。目前有研究发现VLU周围经皮氧分压可低至1.7~7.0 mmHg[3],严重缺氧首先作用于皮肤微循环血管内皮细胞,使其凋亡和增殖之间的平衡发生紊乱,继而出现皮肤溃疡。
舒洛地特(sulodexide,SDX)是一种天然的糖胺聚糖,具有抗凝、抗炎和改善内皮细胞功能等作用,现以已被广泛应用于治疗包括静脉血栓、静脉曲张和静脉性溃疡等多种静脉性疾病,且有系统评价称SDX能有效提高VLU愈合率[4]。目前许多临床研究表明SDX可以明显降低静脉性溃疡周围血管通透性、减少炎性因子分泌并加快静脉性溃疡的愈合,且在一些关于糖尿病肾病的研究中也报道了SDX对肾脏的保护作用[5],但其具体作用机制尚不明确。依据下肢静脉性溃疡的病理生理特点和舒洛地特对静脉性溃疡明确的治疗效果,我们提出猜想:舒洛地特可有效降低低氧状态下人真皮微血管内皮细胞(human dermal microvascular endothelial cells,HDMECs)的凋亡率。本研究通过不同浓度的SDX作用于低氧状态下人真皮微血管内皮细胞,探讨SDX对细胞凋亡率的影响及分子机制。
材 料 和 方 法
1 主要材料与设备
人真皮微血管内皮细胞株购买于北京北纳创联生物技术研究院;SDX由意大利阿尔法韦士曼(北京)制药公司上海分公司提供;兔抗人Bax、Bcl-2、caspase-3和P53多克隆抗体购于万类生物有限公司;相应引物购于GeneCopoeia;蛋白提取试剂盒、BCA蛋白定量试剂盒及Western blot常规试剂均购于碧云天生物科技有限公司;CCK-8试剂盒购于东仁化学科技有限公司;caspase-3活性检测试剂盒购于万类生物有限公司;胎牛血清购于PAN-Biotech GmbH;RPMI-1640培养液购于Corning;TaKaRa逆转录试剂盒和SYBR Green均购于宝生物工程有限公司;三气孵箱购于Thermo。
2 方法
2.1细胞的培养与实验分组 HDMECs用含10%胎中血清和1%青、链霉素混合液的 RPMI-1640培养液,置于21% O2、5% CO2、37 ℃孵箱培养,待细胞生长至70%融合时,用不含血清的培养基静置培养24 h后,对细胞进行分组培养:(1)常氧对照(normoxia control,NC)组即用完全培养基培养于常氧孵箱;(2)低氧对照(hypoxia control,HC)组即将细胞更换新鲜培养基后培养于1% O2、5% CO2、94% N2、37 ℃细胞培养孵箱培养24 h;(3)不同浓度(0.25、0.5、1 LSU/mL)SDX组即细胞更换含不同浓度(0.25、0.5、1 LSU/mL)SDX的新鲜完全培养基后移至1% O2、5% CO2、94% N2、37 ℃细胞培养孵箱培养24 h。
2.2CCK-8法检测细胞活力 将HDMECs以每孔5×103接种至96孔板中,每个孔板中添加完全培养基,置于21% O2、5% CO2、37 ℃细胞培养箱中至细胞融合,然后换液加含不同浓度(0、0.25、0.5、1 LSU/mL)SDX的完全培养基各加100 μL,分别在5% CO2、37 ℃细胞培养孵箱与1% O2、5% CO2、94% N2、37 ℃细胞培养孵箱培养24 h后,每孔添加10 μL CCK-8试剂(每孔)反应2 h,用酶标仪测定450 nm波长吸光度(A)值,实验重复6次,根据不同处理浓度A值与对照组A值的比例计算HDMECs的细胞活力。
2.3Annexin V-FITC/PI双染色法检测细胞凋亡 Annexin V-FITC/PI双染色法检测细胞凋亡根据试剂盒说明书操作,主要过程将细胞按以上分组方式培养后,收集细胞,PBS洗涤2次,500 μL反应缓冲液垂悬细胞,然后加入5 μL Annexin V-FITC和5 μL PI,混合后于室温避光静置10 min,上流式细胞仪检测,激发波长488 nm,发射波长 530 nm,计算各时相细胞百分比,实验重复3次。
2.4细胞内caspase-3活性测定 按以上分组方式培养细胞后,收集各组细胞并用PBS洗涤1次,用裂解液冰浴裂解15 min,4 ℃条件下12 000×g离心15 min,采用Bradford法检测上清液中蛋白浓度。在96孔板中将10 μL蛋白上清液、80 μL反应缓冲液和10 μL caspase-3底物混合并在37 ℃条件下孵育2 h。利用多功能酶标仪于405 nm处读取A值,实验重复3次,并以各组吸光度与常氧对照组吸光度相比计算相对的caspase-3活性。
2.5Western blot检测蛋白表达 按以上分组方式培养细胞后收集各组细胞用RIPA裂解液裂解后静置30 min,然后4 ℃、12 000×g离心15 min取上清液即为总蛋白。BCA法测定蛋白浓度并配平。SDS-PAGE约2 h,用电转移法将蛋白转移至PVDF膜上,5%脱脂牛奶-TBST室温封闭1.5 h,加入 I 抗4 ℃过夜。经 II 抗室温孵育1.5 h和洗膜后将膜置于显影仪使用ECL发光试剂进行显影。以目的蛋白与内参照GAPDH条带光吸光度之比表示目的蛋白的相对表达水平,实验重复3次。
2.6Real-time PCR检测mRNA的表达 按以上分组方式培养细胞后收集各组细胞,按照总RNA提取试剂盒说明书步骤提取RNA,测RNA浓度,取1 μL RNA按照TaKaRa逆转录试剂盒说明书进行逆转录反应,测DNA浓度。进而通过特异性引物(表1)对HDMECs中的P53、Bax、Bcl-2和内参照GAPDH进行PCR扩增。10 μL PCR反应体系包括:1 μL逆转录反应产物、5 μL SYBR Green、3 μL DEPC水和1 μL上、下游混合引物。在CFX96实时荧光定量PCR仪上进行反应,共40个循环,循环结束后绘制熔解曲线。每次扩增均设置GAPDH内参照,用2-ΔΔCt方法分析数据。
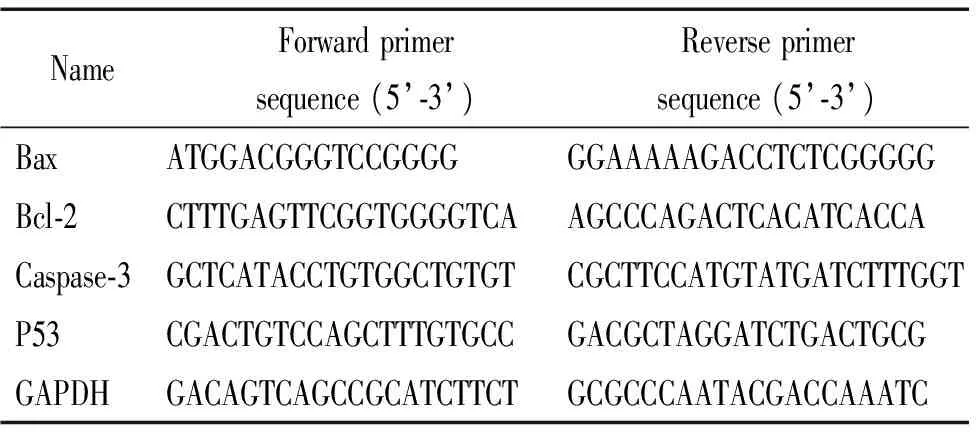
表1 引物序列
3 统计学处理
所有实验均独立重复3次,计量资料以均数±标准差(mean±SD)表示,采用SPSS 18.0统计学软件对实验结果进行统计分析,两组独立样本均数比较采用Studentt检验;多组间均数比较采用单因素方差分析(在此基础上的组间两两比较采用SNK-q法),以P<0.05为差异有统计学意义。
结 果
1 SDX对常氧及低氧状态下的HDMECs存活率的影响
CCK-8实验结果显示,常氧状态下,各组HDMECs存活率没有明显差异;与常氧不加药组细胞对比,低氧不加药组细胞存活率明显降低(P<0.05);低氧状态下,与低氧对照组比较,SDX处理组HDMECs的存活率存在明显差异,且随浓度增加存活率增加(P<0.05),见图1。

Figure 1. The effect of SDX on the viability of HDMECs under normoxic and hypoxic condition. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vsHC group;△P<0.05vs0.25 LSU/mL SDX group;▲P<0.05vs0.5 LSU/mL SDX group.
图1常氧及低氧状态下SDX对HDMECs活力的影响
2 SDX对低氧状态下HDMECs凋亡率的影响
流式细胞仪结果显示,与常氧对照组相比,低氧对照组细胞凋亡率明显增高(P<0.05)。与低氧对照组相比,SDX处理组细胞凋亡率显著降低,并随着浓度增高细胞凋亡率降低(P<0.05),见图2。
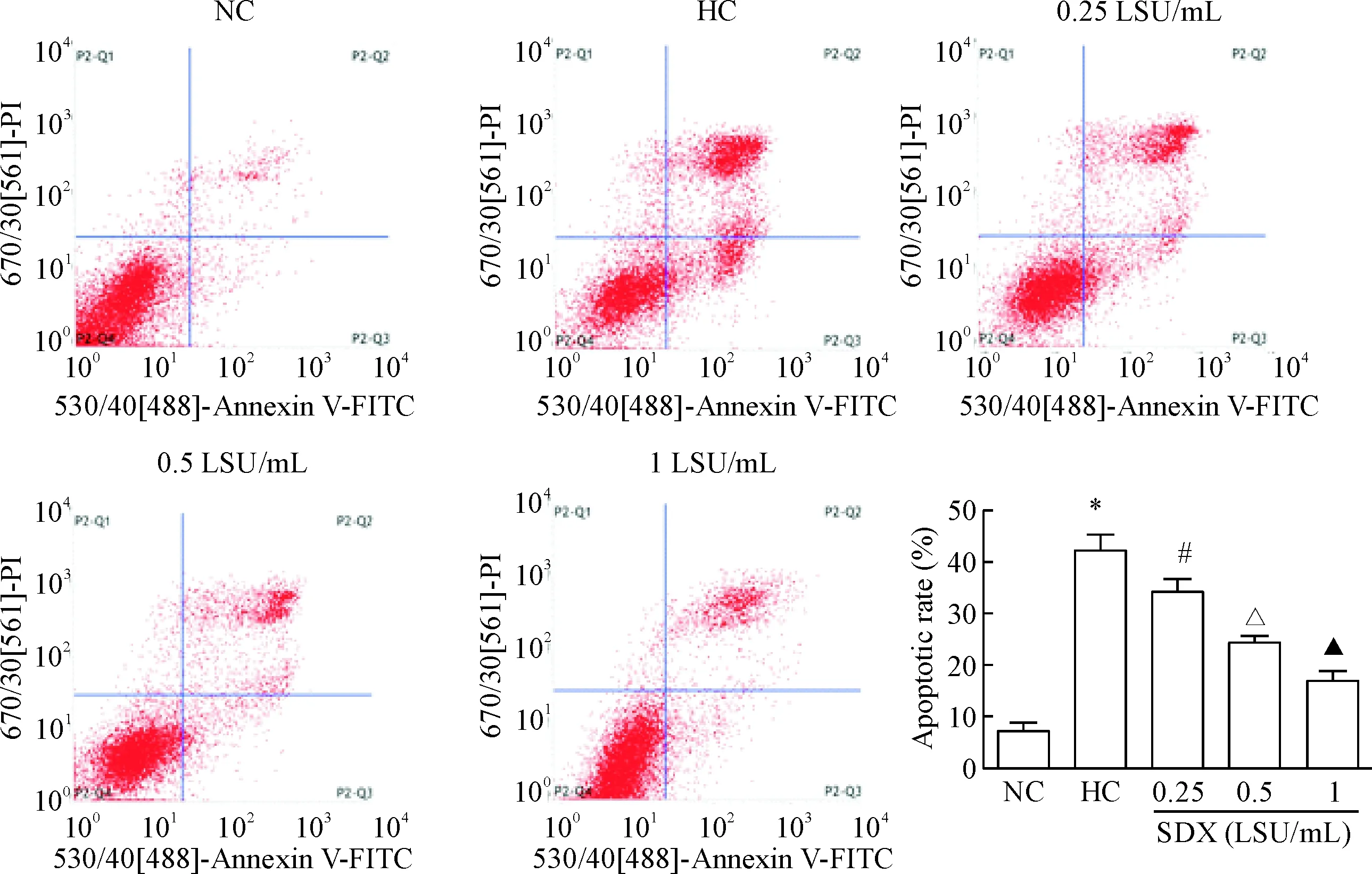
Figure 2. The effect of SDX on the apoptotic rate of HDMECs under hypoxic condition. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsHC group;△P<0.05vs0.25 LSU/mL SDX group;▲P<0.05vs0.5 LSU/mL SDX group.
图2SDX对低氧状态下HDMECs凋亡率的影响
3 SDX对低氧状态下HDMECs内caspase-3活性的影响
Caspase-3活性试剂盒检测结果显示,与常氧对照组比较,低氧对照组caspase-3活性显著升高(P<0.05);与低氧对照组相比,SDX各处理组caspase-3活性明显降低,且随浓度增加caspase-3活性呈降低趋势(P<0.05),见图3。
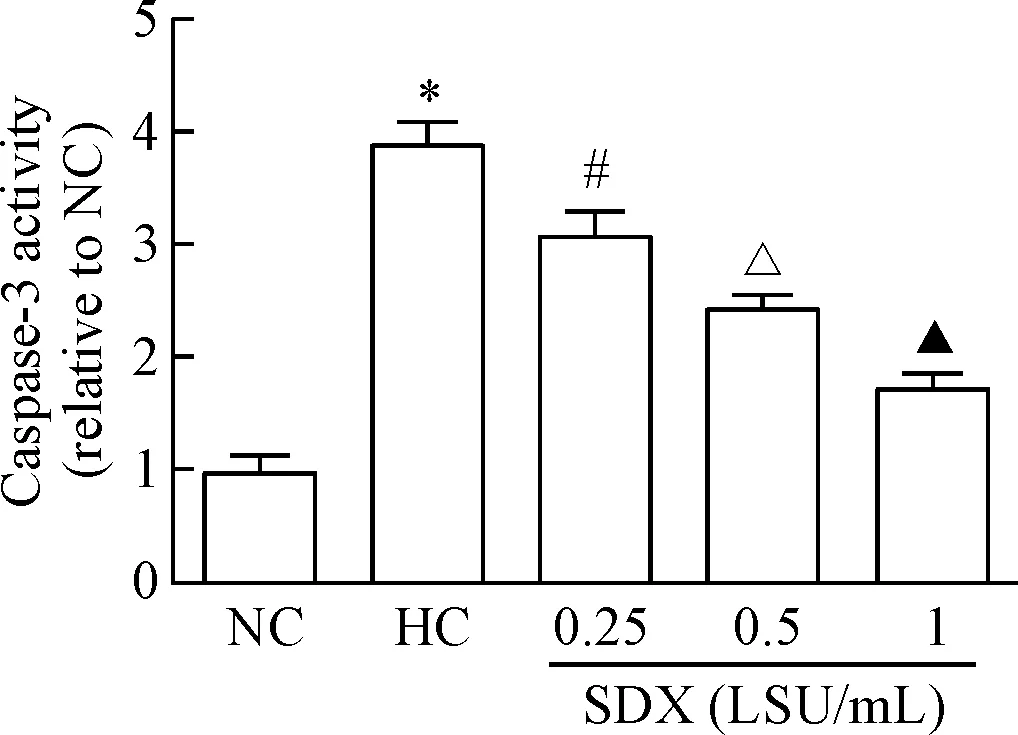
Figure 3. The effects of SDX on the activity of caspase-3 in the HDMECs under hypoxic condition. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsHC group;△P<0.05vs0.25 LSU/mL SDX group;▲P<0.05vs0.5 LSU/mL SDX group.
图3SDX对低氧状态下HDMECs内caspase-3活性的影响
4 SDX对低氧状态下HDMECs凋亡相关分子mRNA的表达的影响
Real-time PCR结果显示,与常氧对照组相比, 低氧对照组促凋亡因子P53、Bax和caspase-3表达均有明显上升(P<0.05),抑凋亡因子Bcl-2表达明显下降(P<0.05);与低氧对照组相比,SDX处理组促凋亡因子P53、Bax和caspase-3 mRNA表达均有显著下降,而凋亡抑制因子Bcl-2有明显上升(P<0.05),呈现显著的浓度依赖性,见图4。
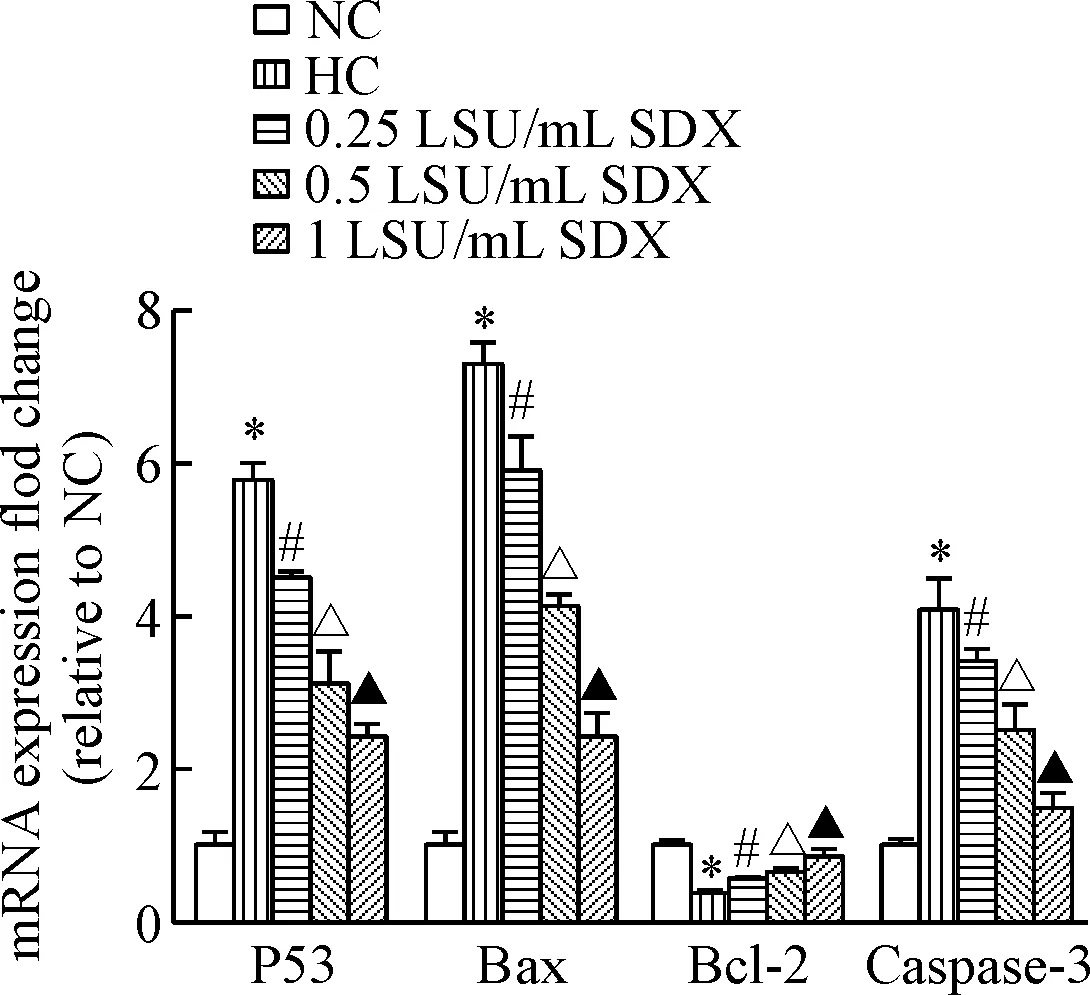
Figure 4. The effects of SDX on the mRNA expression of apoptosis-related factors in the HDMECs. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsHC group;△P<0.05vs0.25 LSU/mL SDX group;▲P<0.05vs0.5 LSU/mL SDX group.
图4SDX对HDMECs凋亡相关因子mRNA表达的影响
5 SDX对低氧状态HDMECs凋亡相关因子蛋白表达的影响
与real-time PCR的结果相似,Western blot结果显示,低氧对照组较常氧对照组比较,P53、Bax和caspase-3蛋白表达均明显上调(P<0.05),Bcl-2明显下调(P<0.05);与低氧对照组相比,各SDX处理组P53、 Bax和caspase-3蛋白表达均有显著下调(P<0.05),Bcl-2有明显上调(P<0.05),呈现显著的浓度依赖性,见图5。
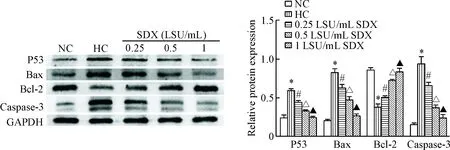
Figure 5. The effects of SDX on the expression of apoptotsis-related proteins in the HDMECs. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsHC group;△P<0.05vs0.25 LSU/mL SDX group;▲P<0.05vs0.5 LSU/mL SDX group.
图5SDX对各组HDMECs凋亡相关蛋白表达的影响
讨 论
长期静脉血液回流不畅导致血流淤滞和静脉高压,进而出现皮肤血管微循环白细胞介导炎性反应、血小板黏附、毛细血管周围纤维囊形成、大分子物质堆积于局部组织等,导致组织缺氧和血管内皮细胞死亡,最终形成溃疡[6-7]。许多静脉性溃疡的临床研究已证实,静脉性溃疡患者其溃疡周围都存在不同程度的缺氧[8-9],且在老年性静脉性溃疡患者中溃疡周围组织经皮氧分压低至1.7~7.0 mmHg[3],如此程度的缺氧与许多由动脉缺血性低氧(包括动脉粥样硬化性下肢缺血和糖尿病病足下肢缺血)程度相似。目前对动脉缺血性低氧损害血管内皮细胞的体外机制研究较多,而静脉性溃疡的体外低氧细胞损害的研究却很少,以致缺少统一的体外细胞模型。体外细胞低氧培养模型有使用CoCl2处理细胞的化学低氧模型和通过三气培养孵箱培养细胞的物理低氧模型。这两种低氧模型各有利弊,但不少学者因为担心CoCl2可能会对细胞内其它某些蛋白会产生影响而采用物理模型。虽然目前尚没有成熟的静脉性溃疡体外细胞低氧培养模型,但已有缺血再灌注的缺氧/复氧模型、动脉缺血的低氧-无糖模型以及糖尿病病足的低氧-高糖模型做参考,依据静脉性溃疡缺氧程度相似的动脉缺血性低氧的体外低氧模型而采用1% O2浓度培养细胞24 h较多[10-11],所以本研究在低氧程度上参考动脉体外研究模型采用1% O2氧浓度培养HDMECs 24 h以模拟静脉性溃疡局部严重缺氧情况。通过体外培养细胞并使用SDX干预后探索其治疗静脉性溃疡的潜在机制。
大量研究表明低氧可以导致内皮细胞产生一系列的细胞间相互级联反应,包括:细胞有氧代谢障碍、细胞膜结构改变、炎症因子释放和细胞凋亡等,而在静脉性溃疡中严重低氧长时间作用微血管内皮细胞的最终结局是细胞凋亡。
细胞凋亡是一种细胞程序性死亡,由多种分子间的相互作用控制,负责清除体内不需要的细胞。细胞凋亡通过外部的细胞死亡信号触发。不同的蛋白家族如caspase家族、Bcl-2家族、TNF受体家族和P53都直接或间接参与细胞的凋亡[12]。p53是第一个被证实的肿瘤抑制基因,在各种应激情况下(包括低氧、癌基因激活、DNA损伤和核苷酸缺失等)调控细胞周期、细胞凋亡以及细胞衰老的过程[13-14]。在低氧条件的刺激下,促凋亡因子P53表达增加,并介导下游多种细胞凋亡相关因子包括Bcl-2家族、IGF-BP3、P53诱导基因(PIGs)等的表达。本研究中发现,与常氧状态比较,低氧状态下HDMECs的P53表达明显升高。在低氧导致的内皮细胞凋亡的过程中,线粒体性细胞凋亡扮演着重要的角色,P53通过对Bcl-2家族的介导进而调控线粒体性细胞凋亡。通常认为Bcl-2家族成员中促凋亡蛋白Bax与抑凋亡蛋白Bcl-2的表达比例以及二者形成的二聚体决定细胞的存活和凋亡[15]。本研究也发现,与常氧对照,低氧状态下HDMECs中Bax/Bcl-2比例增高,且流式结果显示凋亡率明显增加。在普遍细胞凋亡过程中, caspase是执行细胞凋亡的主要酶类,负责选择性的切割某些蛋白质,从而导致细胞凋亡,其中caspase-3是核心蛋白酶,裂解蛋白质后通过正反馈调节,产生caspase级联反应,最终导致细胞凋亡[16]。在本研究结果中可看出低氧情况下HDMECs表达caspase-3明显增高,且活性也明显增高。
舒洛地特是属于糖胺聚糖类物质,具有很高的血管壁趋向性,在多项临床研究中表明它具有抗凝、抗炎和改善内皮细胞功能等作用[17-20]。低氧状态下血管内皮细胞间糖胺聚糖含量减少时,它提供有效的糖胺聚糖以维持内皮细胞的结构和稳定性,改善糖胺聚糖代谢平衡,提高血管内皮细胞膜表面多糖-蛋白质复合物,有助于细胞膜抵抗外界炎症因子以及氧自由基对细胞的损伤,从而降低细胞的凋亡[21]。本研究的CCK-8实验结果表明,常氧下SDX对HDMECs无毒性作用,低氧下随SDX浓度增高HDMECs存活率明显增加。同时在分子和基因层面,SDX能有效降低低氧状态下HDMEsC的凋亡率、降低促凋亡因子P53、Bax和caspase-3蛋白和mRNA表达,提高抗凋亡因子Bcl-2的蛋白和mRNA表达。在2项动脉性缺血的基础研究中发现,SDX在浓度为0.125~0.5 LSU/mL和0.5 LSU/mL时,可以减少低氧下血管内皮细胞的炎性因子释放,有抗细胞衰老和抗细胞凋亡的作用[22-23]。可见SDX对低氧状态下内皮细胞存在显著的抗凋亡作用并呈现浓度依赖性,且其抗凋亡机制可能与线粒体凋亡通路(P53-Bax/Bcl-2-caspase-3)相关。
综上所述,本研究证实了低氧导致的HDMECs凋亡与凋亡通路P53-Bax/Bcl-2-caspase-3相关,并首次提出舒洛地特对其有抑制作用,且抑制效果呈浓度依赖性,此结果为舒洛地特治疗静脉性溃疡的分子机制提供了依据。未来将更深入地研究舒洛地特降低血管内皮的低氧损伤深层机制及其作用靶点,以期发现逆转或降低血管内皮细胞低氧损伤更有效的治疗方式。
[参考文献]
[1] Eberhardt RT, Raffetto JD. Chronic venous insufficiency[J]. Circulation, 2014, 130(4):333-346.
[2] Nicolaides AN. Investigation of chronic venous insufficiency: a consensus statement (France, March 5-9, 1997)[J]. Circulation, 2000, 102(20):E126-E163.
[3] Losev RZ, Zakharova NB, Burov IuA, et al. Local tissue hypoxia consequence in the trophic venous ulceration in elderly patients[J]. Angiol Sosud Khir, 2007, 13(2):79-83.
[4] Wu B, Lu J, Yang M, et al. Sulodexide for treating venous leg ulcers[J]. Cochrane Database Syst Rev, 2016(6):CD010694.
[5] 舒 冏, 曾龙译, 林可意, 等.伊贝沙坦联合舒洛地特对糖尿病大鼠肾脏协同保护作用的研究[J]. 中国病理生理杂志, 2009, 25(2):361-366.
[6] Chatterjee SS. Venous ulcers of the lower limb: where do we stand? [J]. Indian J Plast Surg, 2012, 45(2):266-274.
[7] Yun JK, McCormick TS, Villabona C, et al. Inflammatory mediators are perpetuated in macrophages resistant to apoptosis induced by hypoxia[J]. Proc Natl Acad Sci U S A, 1997, 94(25):13903-13908.
[8] Clyne CA, Ramsden WH, Chant AD, et al. Oxygen tension on the skin of the gaiter area of limbs with venous disease[J]. Br J Surg, 1985, 72(8):644-647.
[9] Barnikol WK, Potzschke H. A novel, non-invasive diagnostic clinical procedure for the determination of an oxygenation status of chronic lower leg ulcers using peri-ulce-ral transcutaneous oxygen partial pressure measurements: results of its application in chronic venous insufficiency (CVI) [J]. Ger Med Sci, 2012, 10:Doc11.
[10] Liu B, Ren KD, Peng JJ, et al. Suppression of NADPH oxidase attenuates hypoxia-induced dysfunctions of endothelial progenitor cells[J]. Biochem Biophys Res Commun, 2017, 482(4):1080-1087.
[11] 董红燕, 张中明, 闫英群. 缺氧、复氧条件下低氧反应元件(HRE)对心肌细胞转染hVEGF165基因表达的调控作用[J].中国病理生理杂志, 2006, 22(9):1712-1716.
[12] Kiraz Y, Adan A, Kartal Yandim M, et al.Major apopto-tic mechanisms and genes involved in apoptosis[J]. Tumour Biol, 2016, 37(7):8471-8486.
[13] Burns TF, El-Deiry WS. The p53 pathway and apoptosis[J]. J Cell Physiol, 1999, 181(2):231-239.
[14] Amaral JD, Xavier JM, Steer CJ, et al. Targeting the p53 pathway of apoptosis[J]. Cur Pharm Design, 2010, 16(22):2493-2503.
[15] Yoon O, Roh J. Downregulation of KLF4 and the Bcl-2/Bax ratio in advanced epithelial ovarian cancer[J]. Oncol Lett, 2012, 4(5):1033-1036.
[16] Chen T, Chen M, Chen J. Ionizing radiation potentiates dihydroartemisinin-induced apoptosis of A549 cells via a caspase-8-dependent pathway[J]. PLoS One, 2013, 8(3):e59827.
[17] Jo H, Jung SH, Kang J, et al. Sulodexide inhibits retinal neovascularization in a mouse model of oxygen-induced retinopathy[J]. BMB Rep, 2014, 47(11):637-642.
[18] Ciszewicz M, Polubinska A, Antoniewicz A, et al. Sulodexide suppresses inflammation in human endothelial cells and prevents glucose cytotoxicity[J]. Transl Res, 2009, 153(3):118-123.
[19] Cha JJ, Kang YS, Hyun YY, et al. Sulodexide improves renal function through reduction of vascular endothelial growth factor in type 2 diabetic rats[J]. Life Sci, 2013, 92(23):1118-1124.
[20] Kristova V, Liskova S, Sotnikova R, et al. Sulodexide improves endothelial dysfunction in streptozotocin-induced diabetes in rats[J]. Physiol Res, 2008, 57(3):491-494.
[21] Masola V, Zaza G, Onisto M, et al. Glycosaminoglycans, proteoglycans and sulodexide and the endothelium: biolo-gical roles and pharmacological effects[J]. Int Angiol,2014, 33(3):243-254.
[22] Gabryel B, Jarzabek K, Machnik G, et al. Superoxide dismutase 1 and glutathione peroxidase 1 are involved in the protective effect of sulodexide on vascular endothelial cells exposed to oxygen-glucose deprivation[J]. Microvasc Res, 2016, 103:26-35.
[23] Suminska-Jasinska K, Polubinska A, Ciszewicz M, et al. Sulodexide reduces senescence-related changes in human endothelial cells[J]. Med Sci Monit, 2011, 17(4):CR222-CR226.
