益气化瘀化痰方对UUO诱导的肾间质纤维化大鼠KLF15、HMGB1、NF-κB及其下游炎症因子表达的影响*
2018-05-07张永越曹文富
张永越, 曹文富, △, 田 晟, 吴 庆
(重庆医科大学 1附属第一医院中西医结合科, 2中医药学院, 重庆 400016)
肾间质纤维化(renal interstitial fibrosis,RIF)是各种慢性肾脏病进展至慢性肾衰竭(chronic renal failure,CRF)乃至终末期肾病(end-stage renal di-sease, ESRD)的主要病理基础及共同转归。研究表明RIF起始于各种损伤引起的炎症反应[1],高迁移率族盒蛋白1(high mobility group box protein 1,HMGB1)是介导损伤性炎症反应的主要因素。它通过信号级联激活核因子κB(nuclear factor-κB,NF-κB)[2],继而诱导单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)、白细胞介素1β(interleukin-1β,IL-1β)及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎性介质的转录与表达[3],促进肾脏炎性损伤,最终导致肾间质纤维化。研究还表明锌指蛋白超家族成员Krüppel样因子15(Krüppel-like factor 15,KLF15)具有抗纤维化作用,可调控NF-κB的转录活性[4]。目前对肾间质纤维化的形成机制已有较深入的研究,但治疗手段及疗效仍较为有限。中药多途径、多靶点的特点在肾间质纤维化的防治中具有一定优势,但中医典籍中并无“肾纤维化”的病名,根据其临床表现及演变规律,类属于“水肿”、“溺毒”、“癃闭”和“关格”等病症,其病机主要为“气虚、血瘀、痰凝及痰瘀互结”。本研究所用益气化瘀化痰方(Yiqi Huayu Huatan decoction,YHHD)为曹文富教授治疗慢性肾炎、肾病综合征、IgA肾病、糖尿病肾病及肾功能不全的基础方[5]。在前期研究和已知临床疗效的基础上,本研究采用单侧输尿管结扎(unilateral ureteral obstruction,UUO)建立RIF大鼠模型,探讨益气化瘀化痰方改善肾间质纤维化的作用机制。
材 料 和 方 法
1 材料
1.1实验动物 SPF级雌性SD大鼠48只,体质量180~220 g,购买并饲养于重庆医科大学实验动物中心SPF级动物房,动物许可证号为SYXK(渝)2012-0001。
1.2药品及试剂 中药饮片黄芪、白术、川芎、姜黄、瓜蒌和海藻购于重庆医科大学附属第一医院中药房(由重庆医科大学中医药研究室曹文富教授鉴定合格);替米沙坦(telmisartan)购于重庆医科大学附属第一医院西药房(国药准字H20080222;批号为6160616);TRIzol、逆转录试剂盒和SYBR Premix购自TaKaRa;PCR引物由成都宝生生物公司合成;兔抗鼠KLF15和MCP1多克隆抗体购于Novus;兔抗鼠HMGB1单克隆抗体购于Abcam;兔抗鼠NF-κB多克隆抗体购于武汉塞维尔生物公司;HRP标记羊抗兔IgG和HRP标记羊抗鼠IgG及β-actin单克隆抗体购于EARTH;RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒和蛋白marker购于碧云天生物技术公司;小鼠SP试剂盒和DAB显色液购于北京中杉金桥生物技术公司;ECL化学发光液购于Affinity生物技术公司;大鼠胱抑素C(cystatin C,Cys-C)酶联免疫检测试剂盒和尿酸(uric acid,UA)检测试剂盒(酶比色法)购自南京建成生物工程研究所。
1.3仪器设备 低温高速离心机(Sigma);Image-Pro Plus 6.0图像分析软件、ELISAcalc 计算软件、T100TMPCR仪和Thermo NanoDrop 2000超微量核酸蛋白测定仪(上海基因有限公司);AL204 型电子天平(METTLER TOLEDO);CFX ConnectTM荧光定量PCR检测系统、电泳仪及电泳槽(Bio-Rad);BX53荧光正置显微镜及CellSens Standard图像采集软件(OLYMPUS);旋转蒸发仪(上海亚荣生化仪器厂);4 ℃冰箱和-80 ℃超低温冰箱(Haier公司)。
2 方法
2.1UUO模型的建立 大鼠适应性喂养1周,禁食不禁水12 h后,用2%戊巴比妥钠以2.5 mL/kg剂量腹腔注射。常规备皮、消毒、铺巾,于左肋缘下脊柱旁开1.5 cm处作2 cm左右切口,将左肾牵拉出切口,在肾蒂处脂肪内沿左肾下极寻找输尿管,齐左肾下极用4-0丝线结扎输尿管,距结扎点0.7 cm处再次结扎,于两结扎点间剪断输尿管,将左肾还纳腹腔,依次缝合肌肉筋膜、皮肤,切口消毒。假手术组除不结扎剪断输尿管,其余操作相同。
2.2药物制备 益气化瘀化痰方各中药饮片均按《中国药典》(2015版)规定的临床常用量使用,即黄芪30 g、白术10 g、川芎10 g、姜黄10 g、瓜蒌10 g和海藻10 g。各中药饮片混合水提后,用旋转蒸发仪浓缩成含生药2 kg/L的制剂,4 ℃冰箱中保存备用。替米沙坦制剂用生理盐水配成2 g/L的制剂,现配现用。
2.3分组及给药 UUO术后将大鼠随机分为假手术组、模型组、替米沙坦组及益气化瘀化痰方低、中、高剂量(YHHD-low、YHHD-middle和YHHD-high)组,每组8只。根据《药理实验方法学》体表面积折算法计算大鼠用药剂量,成人体重以70 kg算,大鼠等效剂量为成人6.3倍,由此算出大鼠替米沙坦和益气化瘀化痰方的临床等效剂量分别为3.6 mg/kg和7.2 g/kg。以临床等效剂量的0.5倍、1倍及2倍设立益气化瘀化痰方低(3.6 g/kg)、中(7.2 g/kg)和高(14.4 g/kg)剂量。术后各组大鼠予相应制剂灌胃,制剂间的体积差用生理盐水补齐,模型组和假手术组予等体积生理盐水灌胃。各组大鼠分笼喂养,实验期间每日灌胃1次,连续用药12周,自由饮水、进食相同的标准饲料。
2.4标本采集 灌胃12周并于末次灌胃后,禁食不禁水12 h,用2%戊巴比妥钠以2.5 mL/kg腹腔注射麻醉大鼠,心脏取血,血清于-80 ℃保存,用于检测血清胱抑素C和尿酸;取术侧肾脏,部分肾组织放入液氮速冻后转入-80 ℃保存,用于提取mRNA及蛋白,部分4%多聚甲醛固定。
2.5肾功能检测 血清胱抑素C和尿酸检测按试剂盒说明书操作。
2.6肾组织形态学观察 肾组织固定后,梯度乙醇脱水,二甲苯透明,石蜡包埋,制成3 μm厚切片;按试剂说明进行PAS染色和Masson染色后,脱水,透明,中性树胶封片。
2.7胶原面积计算 400倍光镜下,每张切片随机选择10个不重叠视野,用Image-Pro Plus 6.0图像分析软件测定其阳性(蓝色)区域面积与该视野组织的总面积(去除肾小管管腔),以二者百分比计算肾间质胶原纤维沉积率。
2.8Real-time PCR TRIzol法提取总mRNA,在37 ℃ 15 min、85 ℃ 5 s条件下逆转录合成cDNA。扩增条件为预变性 95 ℃ 30 s;95 ℃变性 5 s、55 ℃退火30 s、72 ℃延伸30 s,循环40次。采用real-time PCR相对定量方法(2-ΔΔCt法)进行分析。引物信息见表1。
2.9Western blot检测蛋白表达 RIPA裂解液提取肾组织总蛋白,BCA法测定蛋白浓度,用5×上样缓冲液配平各蛋白样品,上样进行SDS-PAGE。根据蛋白marker位置切下目的蛋白所在的PAGE胶;将蛋白转至PVDF膜后,用5%脱脂牛奶室温封闭2 h。加 I 抗,摇床4 ℃孵育过夜,TBST洗膜3次,每次5 min。室温下 II 抗孵育1 h,TBST洗膜3次,每次5 min。化学发光成像仪中显影。目的蛋白与内参照β-actin吸光度值之比为该蛋白的相对表达量。
2.10免疫组化检测MCP-1蛋白表达 采用SP法,石蜡切片常规脱蜡至水;枸橼酸钠微波加热法修复抗原;3%过氧化氢孵育消除过氧化物酶活性;山羊血清封闭。滴加抗MCP-1抗体,湿盒4 ℃过夜;滴加生物素标记 II 抗孵育;滴加HRP标记的链霉卵白素工作液孵育;DAB避光显色。苏木素复染,自来水冲洗,脱水,透明,封片。400倍镜下每张切片随机选取10个不重叠视野,使用Image-Pro Plus 6.0图像分析软件,分别计算阳性区域积分吸光度(integrated absorbance,IA)及视野内组织面积(area),以平均吸光度(IA/area)作为该蛋白的相对表达量。

表1 Real-time PCR的引物序列
3 统计学处理
使用SPSS 22.0软件进行统计学分析,数据用均数±标准差(mean±SD)表示。Levene检验判断方差齐性,方差齐时组间比较采用单因素方差分析,多重比较采用SNK-q检验;方差不齐时采用独立样本Kruskal-Wallis检验。以P<0.05为差异有统计学意义。
结 果
1 肾组织外观
假手术组肾脏大小形态正常,呈暗红色、质软;模型组左侧肾脏明显肿大,呈暗褐色,包膜紧张,切开后内含褐色浑浊肾积水,肾盂肾盏扩张变形;YHHD中、高剂量组及替米沙坦组左侧肾脏亦明显肿大、呈暗褐色,但残存皮质较模型组厚。
2 肾组织形态学观察
PAS和Masson染色结果显示假手术组肾组织结构正常,仅肾小球基膜、系膜区及小管周围间质区见少量胶原纤维呈线状分布;模型组肾小球数量减少,肾小管严重萎缩,炎性细胞弥漫浸润,肾间质区及系膜区增宽伴大量胶原纤维沉积;各药物干预组较模型组间质纤维化程度有所减轻,其中YHHD中、高剂量组及替米沙坦组改善较明显,见图1、2。
3 YHHD对胶原纤维沉积率的影响
Masson染色后计算肾间质胶原纤维沉积率。结果显示,模型组胶原纤维沉积率明显高于假手术组(P<0.05);YHHD中、高剂量组及替米沙坦组明显低于模型组(P<0.05);YHHD低剂量组与模型组的差异无统计学显著性,见表2。
Figure 1. The morphological changes of renal tissues in the rats of each group (PAS staining,×400). A: sham group; B:model group;C: telmisartan group; D: YHHD-low group; E: YHHD-middle group; F: YHHD-high group.
图1各组大鼠肾组织肾组织形态变化
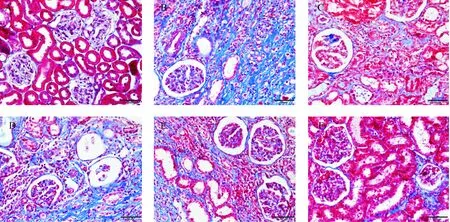
Figure 2. The collagen deposition in renal tissues of the rats in each group (Masson staining,×400). A: sham group; B: model group; C: telmisartan group; D: YHHD-low group; E: YHHD-middle group; F: YHHD-high group.
图2各组大鼠肾组织胶原沉积情况
4 YHHD对血清胱抑素C和尿酸的影响
Cys-C是评价肾功能损害的灵敏标志物。本研究中模型组血清Cys-C较假手术组显著升高(P<0.05);YHHD低、中、高剂量组及替米沙坦组Cys-C较模型组均显著下降(P<0.05)。各组间UA水平的差异无统计学显著性,见表2。
表2各组大鼠血清Cys-C、UA和肾组织胶原纤维沉积率的比较
Table 2. Comparison of serum levels of Cys-C and UA, and the deposition rate of collagen fibers in renal tissues of the rats in each group (Mean±SD.n=8)
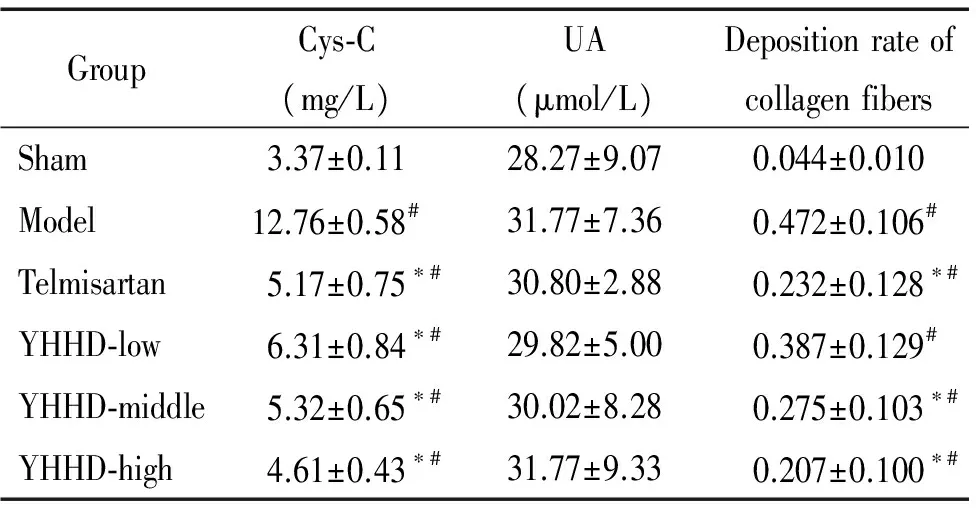
GroupCys⁃C(mg/L)UA(μmol/L)DepositionrateofcollagenfibersSham3.37±0.1128.27±9.070.044±0.010Model12.76±0.58#31.77±7.360.472±0.106#Telmisartan5.17±0.75∗#30.80±2.880.232±0.128∗#YHHD⁃low6.31±0.84∗#29.82±5.000.387±0.129#YHHD⁃middle5.32±0.65∗#30.02±8.280.275±0.103∗#YHHD⁃high4.61±0.43∗#31.77±9.330.207±0.100∗#
#P<0.05vssham group;*P<0.05vsmodel group.
5 YHHD对肾间质纤维化相关基因表达的影响
模型组中HMGB1、NF-κB、 IκB、MCP-1、IL-1β和TNF-α的mRNA表达较假手术组明显上调(P<0.05),药物干预后上述基因表达较模型组均有不同程度下调,以YHHD高剂量组下调最明显(P<0.05)。检测细胞外基质成分的基因表达发现,模型组的纤连蛋白(fibronectin,FN)、I 型胶原(collagen type I ,Col I) 和IV型胶原(collagen type IV,Col IV)的mRNA表达较假手术组明显上调(P<0.05),药物干预后,YHHD高剂量组下调最明显(P<0.05),其次为替米沙坦组。模型组及各药物干预组抗纤维化因子KLF15的mRNA水平均较假手术组明显下调(P<0.05),但YHHD高剂量组较模型组有明显上调(P<0.05),见图3。
6 YHHD对肾组织HMGB1、NF-κB和KLF15蛋白表达的影响
模型组的HMGB1和NF-κB的蛋白表达较假手术组明显上调(P<0.05),KLF15的蛋白表达较假手术组明显下调(P<0.05);YHHD中、高剂量组及替米沙坦组的HMGB1和NF-κB表达较模型组明显下调(P<0.05),YHHD高剂量组及替米沙坦组的KLF15表达较模型组明显上调(P<0.05),见图4、表3。
7 免疫组化检测肾组织MCP-1蛋白的表达
假手术组MCP-1仅微量表达于肾小管上皮细胞;模型组MCP-1大量表达于肾小球内皮细胞、肾小管上皮细胞及间质区,在纤维化和炎细胞浸润区表达明显增强;YHHD高剂量组和替米沙坦组MCP-1少量表达于间质区;YHHD低、中剂量组MCP-1表达区域与模型组大致相同,但表达量和强度均低于模型组,见图5。统计结果显示,模型组的MCP-1表达明显高于假手术组(P<0.05),YHHD高剂量组和替米沙坦组MCP-1表达明显低于模型组(P<0.05),而YHHD低、中剂量组MCP-1表达水平与模型组比较差异无统计学显著性,见表3。
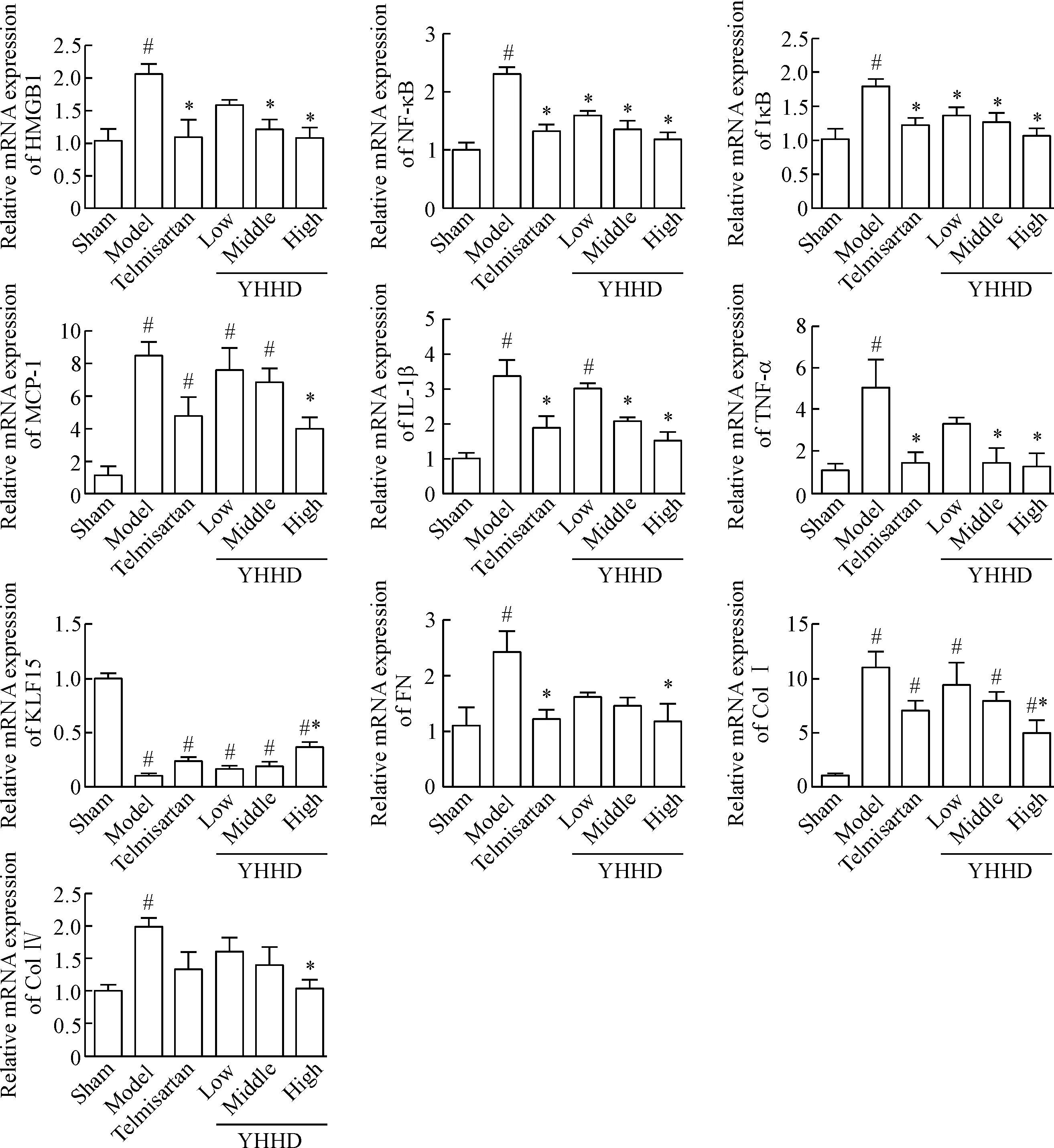
Figure 3. The expression of fibrosis-related genes in renal tissues of the rats in each group. Mean±SD.n=8.#P<0.05vssham group;*P<0.05vsmodel group.
图3各组大鼠肾组织纤维化相关基因的表达

Figure 4. The protein expression of HMGB1, NF-κB and KLF15 in renal tissues of the rats in each group.
图4各组大鼠肾组织HMGB1、NF-κB和KLF15蛋白的表达
讨 论
肾纤维化包括RIF和肾小球硬化。RIF程度与肾功能受损程度具有高度相关性,决定慢性肾脏病的预后[6]。本研究采用单侧输尿管结扎建立肾间质纤维化模型,该模型是观察RIF的经典模型,在研究中被广泛应用[7]。
本研究所用益气化瘀化痰方中黄芪为“益气补中要药”,白术为“益气健脾要药”;川芎为“血中之气药”,姜黄“主心腹结积,下气,破血,消痈肿”;海藻“主破散结气,痈肿癥瘕坚气”,瓜蒌“涤痰结,止消渴,利大肠消痈肿疮毒”。益气药黄芪、白术与化痰药瓜蒌、海藻配伍,能协同发挥益气健脾、化痰散结作用,再与化瘀药川芎、姜黄配伍,共奏益气化瘀化痰之效。益气扶正使津液正常输布、血脉通利,杜绝痰浊与瘀血的生成;化瘀化痰促进已成之“痰凝、瘀血”消散,诸药合用以期改善肾间质纤维化“痰浊凝聚、痰瘀互结”的病理状态,在一定程度上恢复肾组织结构及功能。已有研究表明上述中药或其有效成分可通过多种途径调节参与纤维化进程的关键因子,发挥抗纤维化作用[8-11]。
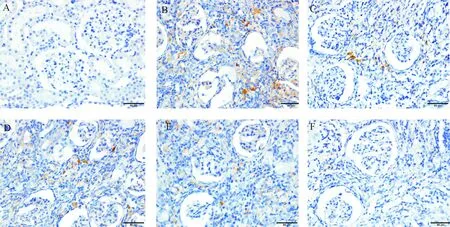
Figure 5. The protein expression of MCP-1 in renal tissues of the rats in each group (immunohistochemical staining,×400). A: sham group; B: model group; C: telmisartan group; D: YHHD-low group; E: YHHD-middle group; F: YHHD-high group.
图5各组大鼠肾组织MCP-1蛋白的表达
表3各组大鼠肾组织HMGB1、NF-κB、KLF15及MCP-1蛋白的表达
Table 3. The protein expression of HMGB1, NF-κB, KLF15 and MCP-1 in renal tissues of the rats in each group (Mean±SD.n=8)

GroupHMGB1NF⁃κBKLF15MCP⁃1Sham1.930±0.3880.366±0.0503.833±0.2600.003±0.002Model4.056±0.518#1.096±0.102#1.870±0.325#0.270±0.202#Telmisartan2.440±0.299∗#0.457±0.134∗#2.462±0.584∗#0.013±0.006∗YHHD⁃low4.030±0.505#1.034±0.085#1.828±0.380#0.068±0.025#YHHD⁃middle3.399±0.509∗#0.831±0.121∗#2.348±0.378#0.043±0.022#YHHD⁃high1.291±0.255∗#0.357±0.078∗2.643±0.265∗#0.009±0.006∗
*P<0.05vsmodel group;#P<0.05vssham group.
Cys-C是评价肾功能损害的敏感指标[12]。本研究中模型组Cys-C明显升高,PAS及Masson染色显示肾小管萎缩,炎性细胞浸润,间质大量胶原纤维沉积,纤维化明显。药物干预后,各组Cys-C均较模型组明显下降,肾小管萎缩及间质纤维化较模型组明显减轻,以YHHD高剂量组改善最为明显。
肾间质纤维化始于各种病因引起的肾组织损伤,持续存在的损伤使炎症反应失去控制,引发病理性修复,继而导致肾间质纤维化[13]。UUO引起的炎症反应由机械损伤所致,损伤相关分子模式(da-mage-associated molecular patterns,DAMPs)是促成这种非感染性炎症的主要因素。HMGB1是存在于真核细胞核内的非组蛋白染色体结合蛋白,也是近年来研究较多的内源性DAMP[14]。组织损伤、细胞坏死或固有免疫细胞被激活时,释放到细胞外的HMGB1成为一种“内源性危险信号”,与单核巨噬细胞和树突状细胞等天然免疫细胞表面的模式识别受体结合[15],通过受体胞内区的髓样分化因子88,激活IL-1受体连接的蛋白激酶和肿瘤坏死因子受体相关因子6,继而激活IκB激酶IKK,使NF-κB的抑制因子IκB降解,NF-κB得以转位入核发挥转录激活功能。NF-κB对多种参与炎症过程的酶类、细胞因子以及细胞黏附分子的表达都起到重要调节作用,可引起其下游MCP-1、IL-1β和TNF-α等炎症介质的过度表达[16]。MCP-1为CC亚家族趋化因子,对单核巨噬细胞在内的多种炎细胞具有趋化和激活作用,而浸润的巨噬细胞数与肾间质纤维化程度成正比[17]。此外,过度表达的IL-1β和TNF-α又可刺激单核巨噬细胞释放HMGB1,活化NF-κB,致炎症信号不断放大,造成炎症失控迁延,进一步加重肾组织损伤[18-19]。
KLF15主要在肾脏的系膜细胞区和肾间质区表达,具有调控分化,增殖,凋亡和纤维化等作用[20]。研究表明KLF15可与NF-κB的p65亚基竞争结合乙酰基转移酶p300,抑制p300依赖的p65乙酰化(p65乙酰化是NF-κB发挥转录活性的重要翻译后修饰方式),从而减少NF-κB下游炎症介质合成,发挥抗炎、抗纤维化作用[4]。
本研究中模型组HMGB1表达较假手术组显著上调,而HMGB1由损伤细胞及固有免疫细胞释放,提示UUO后的输尿管梗阻导致肾组织持续损伤及免疫细胞激活。药物干预后各组HMGB1表达均有下调,以YHHD高剂量组下调最明显。释放到胞外的HMGB1可通过各级信号级联激活NF-κB,控制其下游MCP-1、IL-1β及TNF-α等多种炎症介质的表达。本研究中模型组NF-κB表达较假手术组明显上调,各药物干预后NF-κB表达显著下调,同样以YHHD高剂量组下调最明显。相应的,模型组MCP-1、IL-1β及TNF-α 较假手术组明显上调,药物干预后,仍以YHHD高剂量组下调最明显。以上结果提示单侧输尿管结扎后存在炎症信号级联激活,炎症因子及趋化因子表达显著上调,肾组织发生了明显的炎症反应。而益气化瘀化痰方能下调上述各因子的表达,减轻UUO肾组织的炎症反应。其机制可能与减少损伤细胞及免疫细胞释放HMGB1,抑制NF-κB激活有关。IκB为NF-κB的抑制蛋白,无胞外信号刺激时,与NF-κB的P50/P65亚基结合形成三聚体非活性形式[21]。但本研究中IκB的表达与NF-κB一致,即模型组二者表达明显上调,YHHD高剂量组表达明显下调。因此我们推测NF-κB与IκB的表达存在对应关系,YHHD干预并不能直接影响IκB的表达。
KLF15最初在心肌肥厚、心肌纤维化中被研究得较多,它能减轻心肌间质纤维化、抑制心肌成纤维细胞表型转变[22]。近年来一些研究发现在UUO和5/6 肾切除大鼠模型中,KLF 15表达均出现明显下降,Klf15-/-小鼠也更容易出现心、肾纤维化[23-24]。以上研究均提示KLF15参与并调控纤维化的发生和发展。本研究中模型组及各药物干预组的KLF15 表达较假手术组显著降低,与报道一致。药物干预后,YHHD高剂量组的KLF15 表达则较模型组明显上调。
细胞外基质(extracellular matrix,ECM)成分是构成组织、器官结构的基本框架,其在病理性修复中异常增多、过度沉积是纤维化的主要表现。ECM成分中的Col I为间质性或纤维性胶原,含量较高;Col Ⅳ为非纤维性或无定型胶原,主要存在于基底膜及肾间质[25];FN可结合纤维素、胶原及细胞受体,在ECM 的产生、沉积中发挥重要作用[26]。本研究中模型组肾组织Col I、Col Ⅳ及FN较假手术组显著上调,提示ECM 成分大量合成,与Masson染色显示的纤维沉积相符。药物干预后,各组Col I、Col Ⅳ及FN 表达均有不同程度下调,其中YHHD高剂量组下调最明显,提示益气化瘀化痰方能减少ECM 合成,减轻肾间质纤维化。
随着研究进展,人们逐渐认识到中药在治疗肿瘤、心血管病及器官纤维化等复杂疾病中的优势。RIF的发生发展不仅仅是单个靶点改变,常涉及多个靶点失衡、多条信号通路的交互作用[27]。近年来,针对多途径、多靶点的复方药物研究成为肾纤维化治疗中的研究对象[6]。本研究证实所选用的益气化瘀化痰方呈剂量依赖性地下调炎症相关的HMGB1、NF-κB、MCP-1、IL-1β、TNF-α 表达,上调抗纤维化因子KLF15 的表达,从而减少ECM 成分Col I、Col Ⅳ及FN 的合成,减轻肾间质纤维化、改善肾功能,且益气化瘀化痰方高剂量组上述作用略优于替米沙坦。其具体机制一方面可能是通过减少HMGB1的释放以抑制NF-κB核转位;另一方面是通过上调KLF15表达以竞争抑制NF-κB的转录活性。这2种方式均能减少NF-κB及其下游炎症因子、趋化因子等炎性介质的表达,抑制肾间质炎症反应,从而减轻肾间质纤维化。
[参考文献]
[1] Meng XM, Nikolicpaterson DJ, Lan HY. Inflammatory processes in renal fibrosis[J]. Nat Rev Nephrol, 2014, 10(9):493-503.
[2] Rabadi MM, Ghaly T, Goligorksy MS, et al. HMGB1 in renal ischemic injury.[J]. Am J Physiol Renal Physiol 2012, 303(6):F873-F885.
[3] Tan Y, Wang Q, She Y, et al. Ketamine reduces LPS-induced HMGB1 via activation of the Nrf2/HO-1 pathway and NF-κB suppression.[J]. J Trauma Acute Care Surg, 2015, 78(4):784-792.
[4] Lu Y, Zhang L, Liao X, et al. Kruppel-like factor 15 is critical for vascular inflammation.[J]. J Clin Invest, 2013, 123(10):4232-4241.
[5] 李 艳, 曹文富. 益气化瘀化痰养阴方剂对肝纤维化大鼠TGF-β1表达的影响[J]. 中成药, 2012, 34(8):1437-1442
[6] 辛冰牧, 杨红振, 胡卓伟. 肾纤维化发病机制及治疗学研究进展[J]. 国际药学研究杂志, 2008, 35(5):349-354.
[7] Cheng H, Bo Y, Shen W, et al. Leonurine ameliorates kidney fibrosis via suppressing TGF-β and NF-κB signaling pathway in UUO mice.[J]. Int Immunopharmacol, 2015, 25(2):406-415.
[8] 欧阳燕, 陈小容, 郑林鑫, 等. 黄芪通过抗氧化抑制博莱霉素诱导的小鼠肺纤维化[J]. 中国病理生理杂志, 2017, 33(7):1271-1277.
[9] 刘晓明, 朱 雪, 张 伟. 化痰类中药干预肺纤维化模型大鼠肺组织中Nrf2含量的研究[J]. 时珍国医国药, 2017, 28(9):2081-2084.
[10] 余 璐, 林 立, 李海燕, 等. 姜黄素对肺炎链球菌诱导BEAS-2B细胞SLPI、TNF-α和IL-1β表达的影响[J]. 中国病理生理杂志, 2018, 34(2):321-327.
[11] 秦秀娟, 高家荣, 姜 辉, 等. 疏肝健脾方醇水双提物对CCl4诱导的肝纤维化大鼠的保护作用[J]. 中成药, 2015, 37(8):1646-1651.
[12] 王大光, 管琳妹, 谭 梅. 血清Cys C的检测对肾移植术后患者肾功能评价的临床意义[J].医学与哲学,2014, 35(10B):35-36, 39.
[13] Zhou X, Sun X, Gong X, et al. Astragaloside IV fromAstragalusmembranaceusameliorates renal interstitial fibrosis by inhibiting inflammation via TLR4/NF-кBinvivoandinvitro[J]. Int Immunopharmacol, 2017, 42:18-24.
[14] Yang H, Wang H, Chavan SS, et al. High mobility group box protein 1 (HMGB1): the prototypical endogenous danger molecule[J]. Mol Med, 2015, 21(Suppl 1):S6-S12.
[15] Li J, Gong Q, Zhong S, et al. Neutralization of the extracellular HMGB1 released by ischaemic damaged renal cells protects against renal ischaemia-reperfusion injury[J]. Nephrol Dial Transplant, 2011, 26(2):469-478.
[16] 王建枝, 钱睿哲. 病理生理学[M]. 第3版. 北京: 人民卫生出版社, 2015:213-217.
[17] Pan B, Liu G, Jiang Z, et al. Regulation of renal fibrosis by macrophage polarization.[J]. Cell Physiol Biochem, 2015, 35(3):1062-1069.
[18] Zhang M, Guo Y, Fu H, et al. Chop deficiency prevents UUO-induced renal fibrosis by attenuating fibrotic signals originated from Hmgb1/TLR4/NFκB/IL-1β signaling[J]. Am J Orthodontics, 2015, 70(3):282-289.
[19] Chen L, Sha M L, Li D, et al. Relaxin abrogates renal interstitial fibrosis by regulating macrophage polarization via inhibition of Toll-like receptor 4 signaling[J]. Oncotarget, 2017, 8(13):21044-21053.
[20] Gao X, Wu G, Gu X, et al. Kruppel-like factor 15 modulates renal interstitial fibrosis by ERK/MAPK and JNK/MAPK pathways regulation.[J]. Kidney Blood Pressure Res, 2013, 37(6):631-640.
[21] 王丽君, 仝 雷.白藜芦醇缓解完全弗氏佐剂所致小鼠炎性痛的NF-κB信号通路机制[J]. 中国病理生理杂志, 2018, 34(02):340-345.
[22] Yu Y, Ma J, Xiao Y, et al. KLF15 Is an Essential negative regulatory factor for the cardiac remodeling response to pressure overload[J]. Cardiology, 2015, 130(3):143-152.
[23] 李 丽, 朱 伟, 魏 盟, 等. Kruppel样因子15——多功能转录因子的功能研究[J]. 医学综述, 2014, 20(16):2916-2918.
[24] Gao X, Huang L, Grosjean F, et al. Low-protein diet supplemented with ketoacids reduces the severity of renal disease in 5/6 nephrectomized rats: a role for KLF15[J]. Kidney Int, 2011, 79(9):987-996.
[25] Zeisberg M, Bonner G, Maeshima Y, et al. Renal fibrosis: collagen composition and assembly regulates epithe-lial-mesenchymal transdifferentiation[J]. Am J Pathol, 2001, 159(4):1313-1321.
[26] McDonald GA, Sarkar P, Rennke H, et al. Relaxin increases ubiquitin-dependent degradation of fibronectin in vitro and ameliorates renal fibrosisinvivo.[J]. Am J Physiol Renal Physiol, 2003, 285(1):F59-F67.
[27] 李明亮, 杜 洁. 肾纤维化信号通路的研究进展[J]. 医学综述, 2013, 19(18):3275-3278.
