R848联合Poly(I:C)促进DC抗原呈递和增强T细胞杀伤效果的研究*
2018-05-07杨晓菲郑媛媛王京波李富荣
黄 雪, 王 策, 陈 尚, 杨晓菲, 郑媛媛, 王京波, 李富荣
(暨南大学第二临床医学院, 深圳市人民医院, 转化医学协同创新中心, 深圳市免疫细胞治疗公共服务平台, 广东 深圳 510020)
恶性肿瘤是中国乃至全世界最重要的死亡原因,肺癌已经跃居发病率和死亡率第1位的肿瘤,目前最主要的治疗手段还是手术、放疗和化疗。近年来免疫治疗取得了突破性进展,如食品药品监督管理局批准程序性死亡受体1抗体Keytruda用于非小细胞肺癌的一线治疗[1-2]。树突状细胞(dendritic cell,DC)是高度专职化的抗原递呈细胞(antigen presenting cell,APC),不同成熟程度的DC具有不同的功能,不成熟的DC通过胞饮的方式来摄取抗原[3],而分化成熟的DC能极大地刺激初始T细胞,识别肿瘤相关抗原(tumor-associated antigen,TAA),从而对携带TAA的肿瘤细胞产生特异性的杀伤作用[4-6]。但在肿瘤患者体内树突状细胞的数量及机能都属于低下水平,并不能够很好的将肿瘤细胞清除[7]。
Toll样受体3(Toll-like receptor 3, TLR3)在肿瘤微环境中的激活可以提高免疫细胞的抗肿瘤作用,聚肌胞苷酸[polyinosinic:polycytidylic acid,Poly(I:C)]是一种TLR3激动剂,能促进DC的分化成熟,并将抗原呈递给T细胞,活化特异性的杀伤性T细胞,进一步诱导特异性的免疫应答[8-9]。已有文献报道,TLR7/8激动剂咪唑喹啉类化合物R848与Poly(I:C)联合应用比单一使用更能促进小鼠CD141+DC的分化成熟,这类DC比CD1c+DC呈递抗原给CD8+T细胞的能力更强。不仅如此,TLR3/7/8激动剂刺激DC,会上调DC表面共刺激分子和趋化因子受体的表达[10-11]。因此,本研究拟将R848与Poly(I:C)联合使用,诱导人DC分化成熟,并将肿瘤抗原递呈给T细胞,观察T细胞在体外特异性杀伤肺腺癌A549细胞的效果作用。
材 料 和 方 法
1 主要试剂和耗材
AIM-V® CTSTM无血清培养基购于Life;人肺腺癌A549细胞系购于中国上海干细胞库;PE标记的抗CD11c单抗、APC标记的抗CD86单抗、APC标记的抗CD80单抗和APC标记的抗CD83单抗购于BioLegend;胎牛血清购于Gibco;RPMI-1640培养基和PBS缓冲液购于HyClone;白细胞介素4(interleukin-4,IL-4)、人重组粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和干扰素γ(interferon-γ, IFN-γ)ELISA试剂盒等购于PeproTech; R848和Poly(I:C)购于Sigma。
2 方法
2.1人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离、培养和鉴定 采集健康志愿者外周血肝素抗凝,经淋巴细胞分离液获得PBMC,采用经典分化方案诱导其向DC分化[12];在培养第5天加入A549细胞裂解物(即肿瘤细胞裂解物,tumor cell lysate, TCL;32 mg/L);第6天加入R848 (2.5 mg/L)和Poly(I:C)(25 mg/L)[13-14];第7天收集DC,在显微镜下观察细胞的形态学特征,用流式细胞术(flow cytometry,FCM)分析DC表面分子的表达[15-16]。只加入TCL的DC为DC-TCL组,加入TCL和佐剂的DC为DC-R848+Poly(I:C)组,未加入TCL和佐剂的DC为DC-medium组。
2.2A549细胞裂解物的制备 培养A549细胞于RPMI-1640培养基(含10%胎牛血清、1%青霉素和1%链霉素)中,待细胞融合到80%~90%进行细胞传代,收集处于对数期的A549细胞,计数,液氮和37 ℃水浴锅中反复冻融5次,3 000 r/mim离心10 min,吸取上清即为TCL,BCA法测定蛋白浓度,在未加入任何佐剂的情况下,向DC培养基中加入不同蛋白浓度的TCL,通过检测DC培养上清中的IL-12 p70的水平,筛选最佳抗原浓度[17]。
2.3FCM分析DC表面分子 收集经培养7 d后的DC,PBS洗涤后调整至1×109/L,各取100 μL细胞悬液,分别加入PE-CD11c单抗、APC-CD86单抗、APC-CD80单抗、APC-CD83单抗和APC-CD14单抗各10 μL,经过4 ℃孵育20 min,PBS洗涤2次,调整至1×109/L,FCM分析这些表面分子的表达[18]。
2.4细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)的培养 利用密度梯度离心法从外周血中分离PBMC,贴壁2 h后收获悬浮细胞即为T淋巴细胞[1]。将实验分为3组,DC-R848+Poly(I:C)组、DC-TCL组和DC-medium组的DC分别与T淋巴细胞按1∶10的比例混合培养,加入IL-2、IL-15和IL-21(均20 μg/L);第3天予以半量换液处理并加添加上述细胞因子;第7天收获细胞即为CTL。收集细胞上清液和细胞沉淀,通过ELISA检测培养上清液IFN-γ和TNF-α含量。
2.5乳酸脱氢酶(lactate dehydrogenase, LDH)释放实验 为检测CTL的细胞毒效应,取A549细胞为靶细胞,以每孔2×104的密度接种于96孔板中,贴壁4~6 h后去上清,接种上述各组的CTL,以5∶1、10∶1和20∶1为效靶比,1% NP-40为靶细胞最大释放孔,16 h后于光学显微镜下观察细胞形态变化,拍照,离心5 min后,收集上清。LDH法检测其杀伤作用[酶标仪测波长为492 nm处的吸光度(A)],以下列公式计算效应细胞的杀伤活性[13, 19]。细胞杀伤率(%)=(实验组A值-最小杀伤对照组A值)/(最大杀伤对照组A值-最小杀伤对照组A值)×100%。
3 统计学处理
实验数据采用Prism统计作图软件分析处理,多组之间比较采用单因素方差分析(one-way ANOVA),实验数据以均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结 果
1 DC的培养与表型鉴定
光学显微镜下观察,成熟的DC可见典型的细胞突起,见图1A;流式细胞术结果表明,90%以上的细胞表面有CD11c表达,见图1B;经过R848联合Poly(I:C)刺激的DC具有更长的细胞突起,见图1C;经R848联合Poly(I:C)刺激后CD83阳性表达率达80%以上,CD80阳性表达率达90%以上,而单核细胞的特征性标志CD14表达小于5%,DC-R848+Poly(I:C)组与DC-TCL组比较CD83和CD80表达明显增加(P<0.05),CD14表达显著降低(P<0.05),各组之间CD86表达无明显差异,见图1D。

Figure 1. Identification of dendritic cells (DC). A: the morphological observation of DC (×400); B: the expression level of CD11c on the DC surface; C: characteristics of DC in different groups; D: CD80/CD83/CD86/CD14 expression on the DC surface in different groups. Mean±SD.n=3.*P<0.05vsDC-medium group;#P<0.05vsDC-TCL group.
图1鉴别树突状细胞
2 筛选A549细胞裂解物作为抗原的最佳浓度
在未加入联合佐剂的情况下,DC培养基中加入不同蛋白浓度的TCL,通过检测DC上清中的IL-12 p70的水平,筛选出最佳抗原浓度为32 mg/L,见图2。
3 R848和Poly(I:C)刺激后的DC培养上清中 IL-12 p70的含量
ELISA结果显示,经过R848和Poly(I:C)刺激后,DC分泌IL-12 p70的量较DC-TCL组显著增加,差异有统计学显著性(P<0.01),见图3。
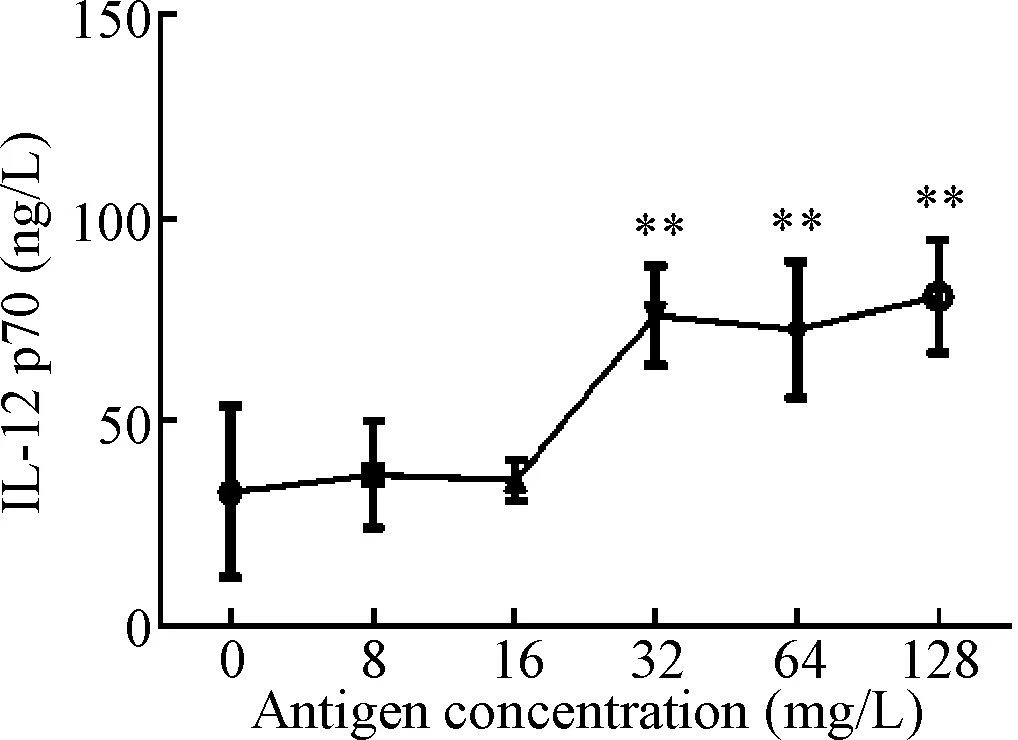
Figure 2. IL-12 p70 level in the culture supernatant of DC treated with different concentrations of antigen was tested by ELISA. Mean±SD.n=3.**P<0.01vs0 mg/L.
图2ELISA法检测经过不同浓度的抗原处理后DC培养上清液中IL-12p70的含量

Figure 3. IL-12 p70 level of each group was detected by ELISA. Mean±SD.n=3.**P<0.01vsother groups.
图3ELISA法检测培养7d后DC培养上清液中IL-12p70的含量
4 抗原致敏DC诱导的CTL对A549细胞的特异性杀伤效果
LDH释放实验显示,效靶比为10∶1和20∶1时,DC-R848+Poly(I:C)组CTL对A549细胞的杀伤率明显增高(P<0.01),而DC-medium组与DC-TCL组之间无明显差异;当效靶比为5∶1时,各组CTL对A549细胞的杀伤作用无明显差异,见图4。
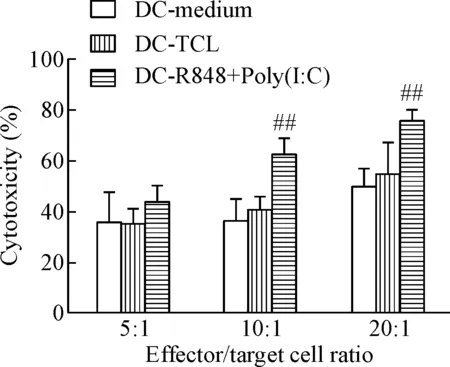
Figure 4. Cytotoxicity was tested by LDH assay. Mean±SD.n=3.##P<0.01vsother groups.
图4检测不同效靶比的效应T细胞对靶细胞的杀伤能力
5 DC与T细胞共培养上清液中IFN-γ和TNF-α的水平
ELISA结果表明,经DC-R848+Poly(I:C)组DC与T细胞共培养上清液中IFN-γ和TNF-α含量与DC-medium和DC-TCL组相比均显著升高(P<0.01),见图5。

Figure 5. The levels of IFN-γ(A) and TNF-α(B) in the co-culture (7 d) supernatant of DC and T cells (1∶10) detected by ELISA. Mean±SD.n=3.**P<0.01vsother groups.
图5DC与T细胞(1∶10)共培养7d后检测细胞上清中IFN-γ和TNF-α的水平
讨 论
在肺癌中非小细胞肺癌占85%,其中腺癌占50%以上。由于早期肺腺癌不易发现及晚期患者由于转移耐药等原因,5年生存率不足15%[20]。近年来免疫靶向治疗发展迅速,为肺癌的治疗带来了曙光[21]。
DC是最有效的抗原呈递细胞。未成熟的DC抗原摄取能力强,通过内吞作用捕获外源性的抗原,释放到其细胞质间隔中;成熟的DC抗原呈递能力增强,并经过主要组织相容性复合体I类抗原呈递途径,呈递给CD8+T细胞,并诱导产生肿瘤抗原特异性的CTL,在免疫治疗中发挥重要作用[18, 20, 22]。
机体的免疫功能与肿瘤的发生、发展密切相关,其中T细胞的作用尤为关键。CTL的主要组织相容性I类复合体有肿瘤来源的多肽,这样就能够锁定并激活和它结合的T细胞抗原受体,使T细胞增殖并产生抗肿瘤特性[23]。经过抗原刺激的DC能将抗原呈递为表位的小分子,以抗原肽的形式与CD8+T细胞的主要组织相容性I类复合体相结合,并且T细胞能识别DC表面共刺激分子CD80(B-7.1)和CD86(B-7.2)信号,由此DC活化了T细胞,诱导T细胞产生特异性的细胞毒作用。成熟活化的T细胞通过分泌炎性细胞因子发挥特异性的抗肿瘤效应,IFN-γ和TNF-α是最主要的抗肿瘤炎性因子[4]。在本实验中,通过R848和Poly(I:C)刺激后的DC可诱导T细胞成为CTL,使CTL发挥对A549细胞的特异性杀伤作用,并随着效靶比的提高而增强,CTL分泌IFN-γ和TNF-α的能力也较DC-TCL组和DC-medium组显著提高。
TLR激动剂能改变抗原的物理性状,延缓抗原降解,从而增强DC对抗原的摄取和呈递能力,更有效刺激淋巴细胞的增殖和分化。理想的佐剂须安全且无长期毒副作用。R848是一种咪唑喹啉类化合物,为水溶性合成小分子,可以通过TLR7/TLR8-MyD88依赖性信号通路活化免疫细胞[8],由于其内毒素含量很低,不影响正常细胞的生理功能。Poly(I:C)是TLR3激动剂,能促进DC成熟、趋化迁移和促炎细胞因子的产生[24]。基于文献报道,目前仍然缺少致敏DC的特异性的抗原,全细胞裂解物含有最广谱的抗原,可能是刺激DC抗原递呈的最佳抗原[25-26]。
本研究结果显示,经过R848和Poly(I:C)的刺激后的DC,其表面分子CD11c、 CD80和CD83表达明显升高,而单核细胞的特征性标志CD14表达小于5%。IL-12 p70是肿瘤免疫中很重要的免疫启动因子,DC是分泌IL-12 p70最主要的免疫细胞,IL-12 p70的分泌能激活NK细胞和CTL的免疫活性。经过R848和Poly(I:C)刺激后的DC,其上清中IL-12 p70的含量可达300 ng/L以上,显著高于DC-TCL组和DC-medium组,而DC-TCL组和DC-medium组的IL-12 p70水平无明显差异。这是由于病原体相关分子模式是通过结合DC表面特定受体来增强其抗原呈递能力的,单使用TCL不足以刺激DC抗原交叉呈递作用,无法有效活化初始T细胞。研究表明TLR激动剂结合DC表面受体,是形成DC抗原呈递电位的有效佐剂[27-28]。
本研究也发现,经过R848和Poly(I:C)刺激后的DC致敏效应T细胞中CD4+/CD25+/Foxp3+Treg细胞的数量减少,并刺激产生了分泌IFN-γ的肿瘤抗原特异性CD8+T细胞。据文献报道,TLR4激动剂单磷脂酰A、TLR9激动剂CpG、TLR4激动剂LPS等也能刺激DC分化成熟[24, 29]。本课题组也将对其它TLR激动剂进行研究。本实验发现R848和Poly(I:C)对DC刺激后,DC的表面成熟分子显著上调,将抗原递呈给T细胞,经刺激后的DC诱导的T细胞分泌TNF-α和IFN-γ能力显著提高(P<0.01),而DC-TCL组和DC-medium组T细胞分泌TNF-α和IFN-γ能力无明显差异,且R848和Poly(I:C)刺激后的DC可明显提高致敏T细胞对肺腺癌A549细胞的杀伤效果。
[参考文献]
[1] Karachaliou N, Gonzalez-Cao M, Sosa A, et al. The combination of checkpoint immunotherapy and targeted therapy in cancer[J]. Ann Transl Med, 2017, 5(19):388.
[2] Varricchi G, Galdiero MR, Tocchetti CG. Cardiac toxicity of immune checkpoint inhibitors: cardio-oncology meets immunology[J]. Circulation, 2017, 136(21):1989-1992.
[3] 黄立锋, 姚咏明, 盛志勇. 树突状细胞与调节性T细胞相互作用研究进展[J]. 中国病理生理杂志, 2008,24(3):610-616.
[4] Alvarez-Dominguez C, Calderón-Gonzalez R, Terán-Navarro H, et al. Dendritic cell therapy in melanoma[J]. Ann Transl Med, 2017, 5(19):386.
[5] Humeniuk P, Dubiela P, Hoffmann-Sommergruber K. Dendritic cells and their role in allergy: uptake, proteoly-tic processing and presentation of allergens[J]. Int J Mol Sci, 2017, 18(7):E1491.
[6] Osada T, Clay TM, Woo CY, et al. Dendritic cell-based immunotherapy[J]. Int Rev Immunol, 2006, 25(5-6): 377-413.
[7] Li S, Wu J, Zhu S, et al. Disease-associated plasmacytoid dendritic cells[J]. Front Immunol, 2017, 8:1268.
[8] Drake MG, Kaufman EH, Fryer AD, et al. The therapeutic potential of Toll-like receptor 7 stimulation in asthma[J]. Inflamm Allergy Drug Targets, 2012, 11(6):484-491.
[9] Pantel A, Teixeira A, Haddad E, et al. Direct type I IFN but not MDA5/TLR3 activation of dendritic cells is required for maturation and metabolic shift to glycolysis after poly IC stimulation[J]. PLoS Biol, 2014, 12(1):e1001759.
[10] Minoda Y, Virshup I, Leal Rojas I, et al. Human CD141+dendritic cell and CD1c+dendritic cell undergo concordant early genetic programming after activation in humanized miceinvivo[J]. Front Immunol, 2017, 8:1419.
[11] Lövgren T, Sarhan D, Truxová I, et al. Enhanced stimulation of human tumor-specific T cells by dendritic cells matured in the presence of interferon-γ and multiple toll-like receptor agonists[J]. Cancer Immunol Immunother, 2017, 66(10):1333-1344.
[12] 巴俊慧, 吴本权, 王艳红, 等. MUC1 mRNA 体外负载树突状细胞诱导细胞毒性 T 细胞对非小细胞肺癌的杀伤作用[J]. 中国病理生理杂志, 2014, 30(9):1574-1579.
[13] Ishikawa S, Ishikawa T, Tezuka C, et al. Efficacy of juzentaihoto for tumor immunotherapy in B16 melanoma metastasis model[J]. Evid Based Complement and Alternat Med, 2017, 2017:6054706.
[14] 张文颖, 袁海花, 姜 斌, 等. TRAIL 基因修饰的树突状细胞诱导黑色素瘤细胞凋亡的实验研究[J]. 现代免疫学, 2017, 37(5):390-394.
[15] Guo M, Dou J. Advances and perspectives of colorectal cancer stem cell vaccine[J]. Biomed Pharmacother, 2015, 76:107-120.
[16] Mosińska P, Gabryelska A, Zasada M, et al. Dual functional capability of dendritic cells-cytokine-induced killer cells in improving side effects of colorectal cancer therapy[J]. Front Pharmacol, 2017, 8:126.
[17] 王士猛. 下调 TCF3 抑制非小细胞肺癌细胞的增殖和迁移能力[J]. 中国病理生理杂志, 2017, 33(2):289-296.
[18] Wurz GT, Kao C, Wolf M, et al. Tecemotide: an antigen-specific cancer immunotherapy[J]. Hum Vaccin Immunother, 2014, 10(11):3383-3393.
[19] Choi YJ, Park SJ, Park YS, et al. EpCAM peptide-primed dendritic cell vaccination confers significant anti-tumor immunity in hepatocellular carcinoma cells[J]. PLoS One, 2018, 13(1):e0190638.
[20] Lu W, Zhang H, Li Y, et al. Gastric cancer-derived heat shock protein-gp96 peptide complex enhances dendritic cell activation[J]. World J Gastroenterol, 2017, 23(24):4390-4398.
[21] Zang H, Peng J, Wang W, et al. Roles of microRNAs in the resistance to platinum based chemotherapy in the non-small cell lung cancer[J]. J Cancer, 2017, 8(18):3856-3861.
[22] Maybruck BT, Pfannenstiel LW, Diaz-Montero M, et al. Tumor-derived exosomes induce CD8+T cell suppressors[J]. J Immunother Cancer, 2017, 5:65.
[23] Shime H, Maruyama A, Yoshida S, et al. Toll-like receptor 2 ligand and interferon-γ suppress anti-tumor T cell responses by enhancing the immunosuppressive activity of monocytic myeloid-derived suppressor cells[J]. Oncoimmunology, 2018, 7(1):e1373231.
[24] Li J, Yang F, Wei F, et al. The role of toll-like receptor 4 in tumor microenvironment[J]. Oncotarget, 2017, 8(39):66656-66667.
[25] Belmans J, Van Woensel M, Creyns B, et al. Immunotherapy with subcutaneous immunogenic autologous tumor lysate increases murine glioblastoma survival[J]. Sci Rep, 2017, 7(1):13902.
[26] Grant ML, Shields N, Neumann S, et al. Combining dendritic cells and B cells for presentation of oxidised tumour antigens to CD8+T cells[J]. Clin Transl Immunol, 2017, 6(7):e149.
[27] Mehrotra S, Britten CD, Chin S, et al. Vaccination with poly(IC:LC) and peptide-pulsed autologous dendritic cells in patients with pancreatic cancer[J]. J Hematol Oncol, 2017, 10:82.
[28] Guo X, Wu N, Shang Y, et al. The novel Toll-like receptor 2 agonist sUP3 enhances antigen presentation and T cell activation by dendritic cells[J]. Front Immunol, 2017, 8:158.
[29] Wang X, Dong L, Ni H, et al. Combined TLR7/8 and TLR9 ligands potentiate the activity of aSchistosomajaponicumDNA vaccine[J]. PLoS Negl Trop Dis, 2013, 7(4):e2164.
