十二指肠乳头癌临床分析:附80例报告
2018-05-07夏华陆晔斌周军张志鹏陈泓西孙维佳
夏华,陆晔斌,周军,张志鹏,陈泓西,孙维佳
(中南大学湘雅医院 胰腺胆道外科,湖南 长沙 410008)
十二指肠乳头癌是指发生在十二指肠乳头区域(包含乳头内胆管及胰管)的恶性肿瘤,其是壶腹周围癌中比较罕见的肿瘤,占胃肠道恶性肿瘤的0.2%,壶腹周围癌的20%左右[1-2],但因其位置特殊,常常早期就可出现胆道梗阻而出现症状。目前手术切除主要有两种方式:局部切除和胰十二指肠切除术。Halsted[3]是第一个在1898年完成壶腹癌局部切除术的学者,Walter Kausch和George Hirschel分别于1912年及1914年完成壶腹癌的胰十二指肠切除术[4-5]。考虑到胰十二指肠切除术后高并发症及病死率,而局部切除术在某些方面一定程度上能取得与胰十二指肠切除术的疗效[6],故越来越多的临床中心在某些病例选择上尝试采用局部切除术,但此术式仍需要更多的研究来证明。本文回顾分析我院2010年3月—2017年3月收治的80例十二指肠乳头肿瘤,结果报告如下。
1 资料与方法
1.1 一般资料
本组患者男46例,女34例;年龄33~77岁,平均57.6岁,其中33~40岁6例,41~50岁13例,51~60岁26例,61~70岁30例,71岁以上5例。
1.2 临床表现
皮肤瘙痒、进行性黄疸60例(75.0%),腹痛不适40例(50.0%),畏寒、发热4例(5.0%),食欲不振、消瘦3例(3.75%),检查发现十二指肠乳头肿物2例(2.5%)。
1.3 辅助检查
所有病例碱性磷酸酶及谷氨酰转肽酶均有不同程度的增高(100%),总胆红素升高70例(87.5%),CA199升高40例(50.0%)。B超检查62例,51例提示肝内外胆管有不同程度的扩张或(和胰管扩张),提示低位胆道梗阻,阳性率为82.26%,其中3例疑诊为胆总管结石可能。CT检查58例,34例发现十二指肠乳头壶腹部肿物,18例提示胆总管下端截断,肝内外胆管扩张,阳性率达89.66%。MRI检查46例,40例均发现肝内外胆管不同程度的扩张,且18例发现十二指肠乳头部肿物,阳性率达91.3%。33例行胃镜/十二指肠镜检查,30例可发现十二指肠乳头隆起,阳性率达93.75%。ERCP检查35例,其中33例发现十二指肠乳头糜烂肿大,阳性率达94.29%,12例行鼻胆管引流术。
1.4 手术方式
16例行十二指肠乳头局部切除术,64例行胰十二指肠切除术。局部切除手术方式:先探查腹腔,有淋巴结肿大则送淋巴结活检,作Kocher切口游离十二指肠及胰头,探查十二指肠乳头肿瘤,纵行切开十二指肠前壁3~5 cm,显露乳头肿瘤,确定能行局部切除则先切除胆囊,切开胆总管向下置入吸痰管至十二指肠乳头引出以做牵引。再行胰管插管,用丝线将肿瘤提起,以胆道探子为支撑,环绕肿瘤周围0.5~2.0 cm切开,边切边以4-0可吸收线将胆总管及胰管开口管壁与十二指肠后壁黏膜连续缝合,重新开口。横行4-0的可吸收线缝合十二指肠降部前壁切口,近端留置T管引出体外,缝合胆管壁,留置一硅胶带侧孔吸痰管(下端通过胆总管十二指肠开口,以作支撑和引流用)及T管引出体外,距屈氏韧带20 cm左右处留置一空肠造瘘管以备空肠营养用,置腹腔引流管于十二指肠降部后方自右侧腹壁引出体外(图1)。

图1 术中照片 A:十二指肠切开后十二指肠乳头部肿瘤;B:肿瘤切除后胰胆管吻合十二指肠壁Figure 1 Intraoperative views A: Tumor at the duodenal papilla after incision of the duodenum; B: Suture the duodenal wall with the pancreatic duct and common bile duct
1.5 统计学处理
采用SPSS 19.0分析软件进行统计学处理,连续变量间比较采用独立样本t检验,分类变量间比较采用χ2检验或Fisher精确检验,所有统计分析均以P<0.05为有显著性检验水准。
2 结 果
2.1 病检结果
十二指肠乳头局部切除术组共16例,13例为十二指肠乳头腺癌,其中2例有淋巴结转移;1例为十二指肠乳头神经内分泌癌,2例为十二肠乳头腺瘤局部癌变。胰十二指肠切除术组共64例,61例为十二指肠乳头腺癌,2例为十二指肠乳头神经内分泌癌,1例为十二指肠乳头腺瘤局部癌变(表1)。
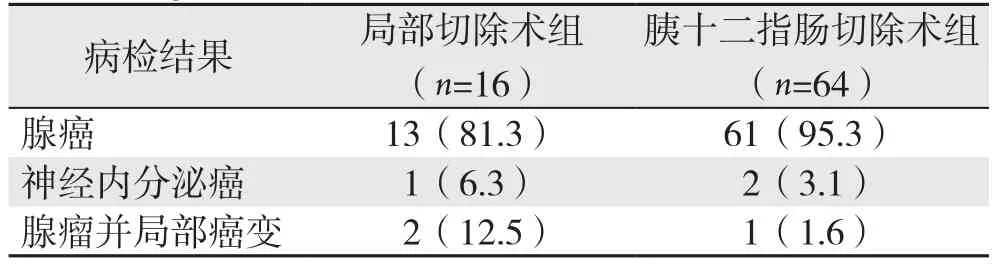
表1 两组病检结果[n(%)]Table 1 Results of the pathological examination of the two groups [n (%)]
2.2 术中及术后情况
局部切除组术中出血量为(159.38±71.22)mL,胰十二指肠术组为(462.19±359.12)mL,两组间差异有统计学意义(P=0.000);局部切除组住院时间为(22.75±8.42)d,胰十二指肠切除组为(27.45±13.13)d,两者间无统计学差异(P=0.178);局部切除组住院费用为(59 336.93±26 336.83)元,胰十二指肠切除术组为(94 373.77±42 764.70)元,两者间有统计学差异(P=0.003)。
2.3 术后并发症
局部切除术组有1例出现1项或多项并发症(1/16),并发症发生率为6.25%,胰十二指肠切除术组有24例出现1项或多项并发症(24/64),并发症发生率为37.5%,两组间差异有统计学意义(P=0.035)。局部切除术组未出现胰瘘,而在胰十二指肠切除术组出现13例(13/64),发生率为20.31%。胰十二指肠切除术组术后死亡2例(2/64),其中1例因术后出现胃十二指肠动脉出血,栓塞止血,随之出现急性肾功能不全,腹腔严重感染导致感染性休克死亡。另外1例因术后胰瘘致腹腔内大出血,导致失血性休克死亡。局部切除组无术后死亡病例(表2)。
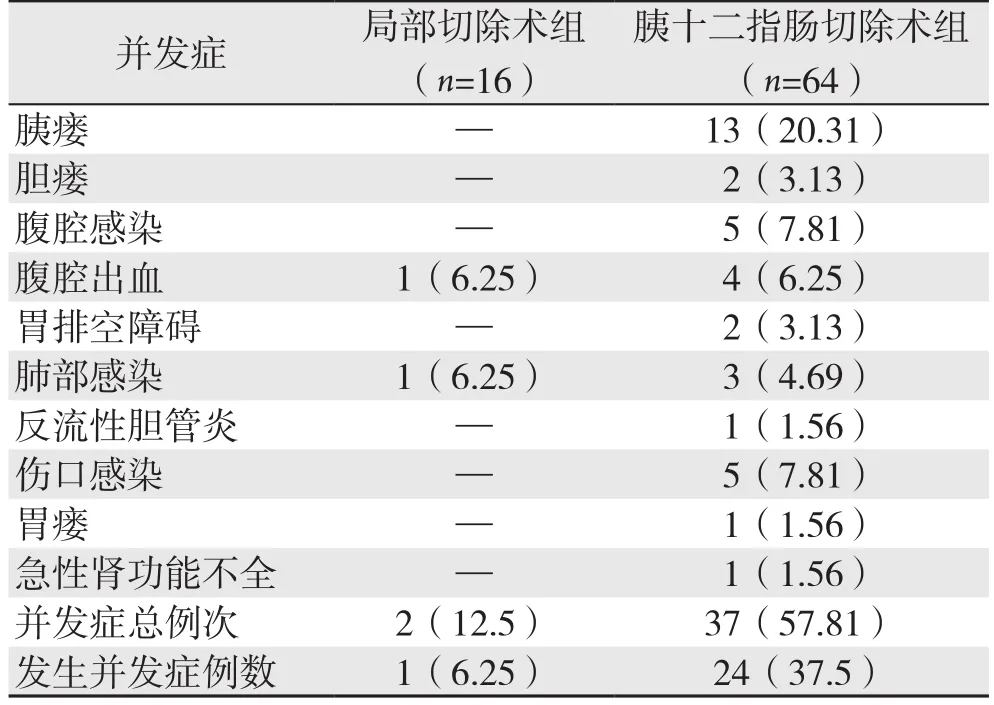
表2 两组术后并发症发生情况[n(%)]Table 2 Complications of the two groups [n (%)]
2.4 术后生存情况
通过电话或者门诊等形式进行随访。有效随访为65例,其中局部切除组11例,胰十二指肠切除术组54例,随访率为81.25(65/80)。采用Kaplan-Meier法进行生存分析。局部切除组11例,术后1年生存率为90.9%,3年生存率为56.8%,5年生存率为4 5.5%;胰十二指肠切除术组中54例,1年生存率为90.3%,3年生存率为74.6%,5年生存率为56.5%。应用Log-rank法进行生存函数组间比较,两组间差异无统计学意义(P=0.503)(图2)。
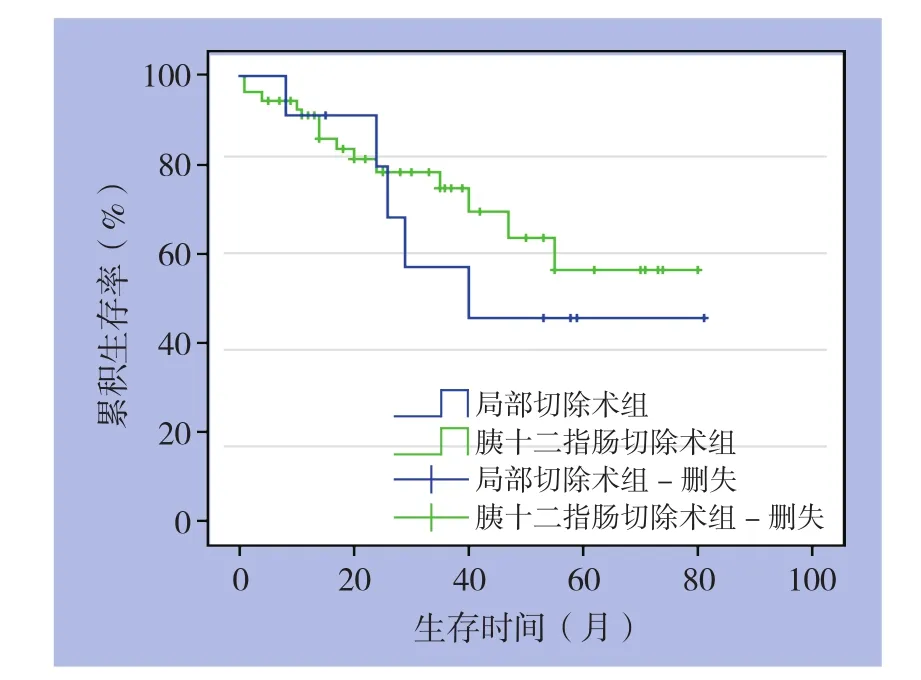
图2 两组患者术后生存曲线图Figure 2 Survival curves of the two groups of patients
3 讨 论
十二指肠乳头癌因其位置特殊,常影响胆汁及胰液的分泌,多数患者以加重性梗阻性黄疸为首发症状[7],本资料中黄疸占75.0%,腹痛占50.0%,畏寒、发热占5.0%,消瘦3.75%,体检发现占2.5%。临床上术前检查大多采用彩超作为筛查手段,但常常以肝内外胆管扩张为主,本资料80例病例中62例行彩超,51例提示肝内外胆管扩张,检出率为82.26%;CT可以直接显示肿瘤的大小,还可了解有无远处转移,淋巴结转移,血管侵犯等,但对于微小的十二指肠乳头肿瘤可能诊断不明确,需联合其他检查,本资料58例行CT检查,但只有34例发现十二指肠乳头壶腹部肿瘤,18例提示胆总管下端截断,虽然总体阳性率达89.66%左右,这更进一步提示对于十二指肠乳头处微小肿瘤,CT对其并不十分敏感。MRCP虽然能胰胆管成像,但因其无法直视观察观察乳头病变情况,也不能取活检,故检出率不如十二指肠镜及ERCP,本组资料十二指肠镜和ERCP检出率可达93.75%、94.29%。相对于十二指肠镜检查,ERCP还可以对黄疸的患者行鼻胆管引流,从而减轻肝功能损伤,提高手术耐受性,本组资料有12例梗阻性黄疸的患者行鼻胆管引流,术后复查肝功能,总胆红素及直接胆红素均有不同程度的下降,提示肝功能有所改善。
十二指肠乳头肿瘤切除有3种主要手术方式:内镜下肿瘤局部切除、外科肿瘤局部切除术、胰十二指肠切除术。内镜下肿瘤局部切除术多适用于:⑴ 更小的腺瘤(<3 cm);⑵ 无乳头固定,表面黏膜脆,溃疡、出血等恶性征象;⑶ 患者身体条件不允许或者拒绝行大手术等。内镜下肿瘤局部切除术是一种较为满意的选择,许多研究[8-9]已经报道了此手术有较低的并发症发生率及病死率,但其远期生存仍需要更多的研究证明。内镜下局部切除比较常见的并发症有胰腺炎、出血、穿孔、胰胆管狭窄等可能,需要常规防止胰管支架,而且需要有丰富经验的内镜医师才能完成,难度较大[10-11]。开放性肿瘤局部切除术更适应于:⑴ 一些较大的腺瘤(>3 cm),伴或不伴非典型增生;⑵ 一些小的神经内分泌肿瘤者;⑶ 早期(T1-2N0M0)恶性肿瘤者;⑷ 患者身体条件不允许或者拒绝行胰十二指肠切除术等。其相比内镜下局部切除优势明显,它可以围绕肿瘤周围行圆周完整切除[12]。胰十二指肠切除术因其根治性手术,对于某些侵犯性肿瘤而言,其清扫淋巴结彻底,目前已成为首选手术方式[13-14]。
尽管随着近年来各临床中心技术水平的提高,胰十二指肠切除后病死率低于5%,但术后并发症仍高达30%~50%,其中胰瘘最为常见,高达20%~26%[15-17]。本资料胰十二指肠切除术组64例中术后死亡2例,其中1例因术后出现胃十二指肠动脉出血,栓塞止血,随之出现急性肾功能不全,腹腔严重感染导致感染性休克死亡。另外1例因术后胰瘘致腹腔内大出血,导致失血性休克死亡,病死率为3.1%。出现1项或多项并发症24例,并发症发生率为37.5%,其中胰瘘13例,胰瘘率高达20.31%,其中局部切除术组术后无死亡,术后1例子出现并发症,明显低于胰十二指肠切除术组,差异有统计学意义(P<0.05)。
对比其他壶腹周围癌,特别是胰头癌,十二指肠乳头癌的术后5年生存率可达30%~60%[18-19]。十二指肠乳头癌切除术后复发与许多因素有关,这些因素包括手术切缘是否有癌组织残留、淋巴结是否有转移、肿瘤大小、是否有神经周侵犯、肿瘤侵袭程度、是否有血管侵犯、肿瘤分化程度等[20-23],一些研究者[24-26]认为是否有淋巴结转移可能是最能影响术后预后因素之一,而且还被认为是决定术后辅助治疗的重要因素。本组资料中,局部切除术组中,有2例十二指肠乳头癌伴有淋巴结转移,1例胰头后方淋巴结转移,清扫淋巴结,可见淋巴结有癌转移,另1例肠系膜根部淋巴结转移,与家属谈话后,患者家属坚持要求行局部切除术。局部切除术组术后5年生存率有45.5%,与十二指肠切除术组56.5%的5年生存率无显著性差异(P>0.05),考虑局部切除组病例较少,可能存在一定偶然性,但仍可反映局部切除术对某些选择性病例效果明显。
不少研究报道对比胰十二指肠切除术,局部切除可以取得与之相当的效果,但需严格把握适应症,而且术前评估尤为重要,术中行局部切除术应该注意:⑴ 结合术前影像学检查,探查十二指肠乳头肿块情况,比如肿块大小,活动度,表面有无溃疡、出血、有无浸润,有无远处脏器及淋巴结转移等;⑵ 切除肿块采取围绕肿块环形切除,切除范围为距离肿瘤边缘1~1.5 cm,术中常规将胆管胰管及十二指肠切缘行快速冷冻病理切片证实有无瘤组织残留。若发现残留,则扩大切除范围或改行胰十二指肠切除术;⑶ 重建时一般采取边切边缝的方法,可以分别将胆管及胰管分别缝合在十二指肠后壁上,也可先行胆胰管成形后再与十二指肠缝合。胰管、胆管常规放置内置引流管作引流,以减少术后胆汁漏、胰瘘、吻合口狭窄等可能;⑷ 为防止术后十二指肠腔狭窄,多采用纵切横缝的方法。
综上,笔者认为,对于十二指肠乳头恶性肿瘤应首选胰十二指肠切除术,对于某些早期恶性肿瘤,无淋巴结转移,无法耐受根治性手术的老年患者,术中强调对周边及基底部切缘行冰冻检查,以确保切缘阴性,局部切除术可以作为一种安全有效的手术方式实施。
[1]Kim WS, Choi DW, Choi SH, et al. Clinical significance of pathologic subtype in curatively resected ampulla of vater cancer[J].J Surg Oncol, 2012, 105(3):266–272. doi: 10.1002/jso.22090.
[2]Shinkawa H, Takemura S, Kiyota S, et al. Long-term outcome of surgical treatment for ampullary carcinoma[J].Hepatogastroenterology, 2012, 59(116):1010–1012. doi: 10.5754/hge10788.
[3]Halsted W. Contributions to the surgery of the bile passages,especially of the common bile-duct[J]. Boston Med Surg J, 1899,141(26):645–661.
[4]Howard JM. Development and progress in resective surgery for pancreatic cancer[J].World J Surg, 1999, 23(9):901–906.
[5]Busnardo AC, DiDio LJ, Tidrick RT, et al. History of the pancreas[J]. Am J Surg, 1983, 146(5):539–550.
[6]陈继业, 蔡守旺, 董家鸿. 局部切除治疗T1和T2期Vater壶腹癌的临床观察[J]. 中国普通外科杂志, 2014, 23(3):283–286.doi:10.7659/j.issn.1005–6947.2014.03.003.Chen JY, Cai SW, Dong JH. Local resection for T1-T2 carcinoma of the ampulla of Vater[J]. Chinese Journal of General Surgery, 2014,23(3):283–286. doi:10.7659/j.issn.1005–6947.2014.03.003.
[7]杜晓辉, 李荣, 蒋彦永, 等. 十二指肠乳头癌的诊断与外科治疗[J]. 中国普通外科杂志, 2006, 15(2):134–136. doi:10.3969/j.issn.1005–6947.2006.02.014.Du XH, Li R, Jiang YY, et al. Diagnosis and surgical treatment of duodenal papilla carcinoma[J]. Chinese Journal of General Surgery,2006, 15(2):134–136. doi:10.3969/j.issn.1005–6947.2006.02.014.
[8]Napoleon B, Gincul R, Ponchon T, et al. Endoscopic papillectomy for early ampullary tumors: long-term results from a large multicenter prospective study[J]. Endoscopy, 2014, 46(2):127–134.doi: 10.1055/s-0034–1364875.
[9]Dubois M, Labgaa I, Dorta G, et al. Endoscopic and surgical ampullectomy for non-invasive ampullary tumors: Short-term outcomes[J]. Biosci Trends, 2017, 10(6):507–511. doi: 10.5582/bst.2016.01193.
[10]Salmi S, Ezzedine S, Vitton V, et al. Can papillary carcinomas be treated by endoscopic ampullectomy?[J]. Surg Endosc, 2012,26(4):920–925. doi: 10.1007/s00464–011–1968–7.
[11]齐志鹏, 孙迪, 周平红,等. 内镜十二指肠乳头肿瘤切除术临床评价(附36例报告)[J]. 中国实用外科杂志, 2017, 37(8):888–891.Qi ZP, Sun D, Zhou PH, et al. Clinical efficacy of endoscopic resection of duodenal papilla tumor: A report of 36 cases[J].Chinese Journal of Practical Surgery, 2017, 37(8):888–891.
[12]Mansukhani VM, Desai GS, Mouli S, et al. Transduodenal ampullectomy for ampullary tumors[J]. Indian J Gastroenterol,2017, 36(1):62–65. doi: 10.1007/s12664–016–0726–0.
[13]Winter JM, Cameron JL, Olino K, et al. Clinicopathologic analysis of ampullary neoplasms in 450 patients:implications for surgical strategy and long-term prognosis[J]. J Gastrointest Surg, 2010,14(2):379–387. doi: 10.1007/s11605–009–1080–7.
[14]de Castro SM, van Heek NT, Kuhlmann KF, et al. Surgical management of neoplasms of the ampulla of Vater: local resection or pancreatoduodenectomy and prognostic factors for survival[J].Surgery, 2004, 136(5):994–1002.
[15]Inoue Y, Hayashi M, Hirokawa F, et al. Clinicopathological and operative factors for prognosis of carcinoma of the ampulla of vater[J]. Hepatogastroenterology, 2012, 59(117):1573–1576. doi:10.5754/hge10742.
[16]Yoon YS, Kim SW, Park SJ, et al. Clinicopathologic analysis of early ampullary cancers with a focus on the feasibility of ampullectomy[J]. Ann Surg, 2005, 242(1):92–100.
[17]Kapoor VK. Complications of pancreato-duodenectomy[J].Rozhledy, 2016, 95(2):53–59.
[18]Fischer HP, Zhou H. Pathogenesis of carcinoma of the papilla of Vater[J]. J Hepatobiliary Pancreat Surg, 2004, 11(5):301–309.
[19]Norero E, Viñuela E, Báez S, et al. Results of pancreaticoduodenectomy in the treatment of periampullary tumors[J]. Rev Med Chil, 2011, 139(8):1015–1024. doi: /S0034–98872011000800006.
[20]Lemke J, Schäfer D, Sander S, et al. Survival and prognostic factors in pancreatic and ampullary cancer[J]. Anticancer Res, 2014,34(6):3011–3020.
[21]黄秀芸, 王向阳, 杨瑜明, 等. 壶腹腺癌胰十二指肠切除术后预后相关因素分析[J]. 中国普通外科杂志, 2016, 25(9):1247–1252.doi:10.3978/j.issn.1005–6947.2016.09.004.Huang XY, Wang XY, Yang YM, et al. Prognostic factors for adenocarcinoma of the ampulla of Vater after pancreaticoduodenectomy[J]. Chinese Journal of General Surgery,2016, 25(9):1247–1252. doi:10.3978/j.issn.1005–6947.2016.09.004.
[22]Chen SC, Shyr YM, Wang SE. Longterm survival after pancreaticoduodenectomy for periampullary adenocarcinomas[J].HPB (Oxford), 2013, 15(12):951–957. doi: 10.1111/hpb.12071.
[23]Pomianowska E, Westgaard A, Mathisen Ø, et al. Prognostic relevance of number and ratio of metastatic lymph nodes in resected pancreatic, ampullary, and distal bile duct carcinomas[J]. Ann Surg Oncol, 2013, 20(1):233–241. doi: 10.1245/s10434–012–2592-z.
[24]Chen S C, Shyr Y M, Chou S C, et al. The role of lymph nodes in predicting the prognosis of ampullary carcinoma after curative resection[J]. World J Surg Oncol, 2015, 13:224. doi: 10.1186/s12957–015–0643–1.
[25]Narang AK, Miller RC, Hsu CC, et al. Evaluation of adjuvant chemoradiation therapy for ampullary adenocarcinoma: the Johns Hopkins Hospital-Mayo Clinic collaborative study [J]. Radiat Oncol, 2011, 6:126. doi: 10.1186/1748–717X-6–126.
[26]Lee JH, Lee KG, Ryou H, et al. Signif i cance analysis of histologic type and perineural invasion as prognostic factors after curative resection of ampulla of Vater carcinoma[J]. Hepatogastroenterology,2010, 57(99/100):646–652.
