银屑病甲损害与亚临床指伸肌腱附着点炎的相关性研究
2018-05-07王秀环孙勇虎于咏梅孙大庆李建可张福仁
王秀环 孙勇虎 于咏梅 孙大庆 李建可 杨 青 张福仁
关节病型银屑病(psoriatic arthritis,PsA)是一种慢性侵蚀性、致残性的关节疾病,在银屑病中的发病率为20%~30%。各种影像学研究表明银屑病中有相当比例未确诊的PsA,早期的诊断和治疗可以阻止临床和放射学上的进展。因此,有必要建立一个临床指标来检测PsA的发生风险[1]。附着点炎是指肌腱、韧带、关节囊附着于骨的部位发生的炎症,被认为是PsA的早期炎症反应的中心[2,3]。在银屑病和PsA患者中,均发现了无症状附着点炎的存在。银屑病甲损害临床可见(图1),且PsA患者中甲损害的发生率明显高于银屑病患者[4-9]。Meta分析认为甲损害是PsA发展最相关的因素。因此,本研究通过超声检查调查银屑病甲损害与手指远端指间关节水平亚临床指伸肌腱附着点炎的关系,探讨甲损害作为关节病型银屑病风险预测指标的价值。
1 对象与方法
1.1 临床资料 研究对象为2016年9月至2017年11月在我院就诊的银屑病患者,年龄均>18岁。有甲损害的患者作为甲损害组,无甲损害的患者作为甲正常组。既往有关节病型银屑病(符合CASPAR诊断标准[10])或其他骨关节炎病史(如类风湿性关节炎、强直性脊柱炎、痛风等)、近期有甲外伤或其他可产生指甲病变的疾病(如斑秃、天疱疮、麻风、梅毒、慢性湿疹、扁平苔藓、手足癣等)、甲真菌病史、3个月内接受过系统治疗的患者均从本次研究中排除。分别记录患者的一般情况和病程,并对银屑病皮损严重情况进行PASI评分。
1.2 仪器与方法
1.2.1 仪器 本研究采用Philips IU22彩色超声诊断仪,5~17 MHz的宽频线阵探头。
1.2.2 指伸肌腱的超声检查 患者取坐位于检查者对侧,手背向上平放于检查床上。在手指远端指间关节背侧涂适量的耦合剂,以保证超声波的传播。将探头放在被检查手指背侧中间位置,调整探头位置,使长轴和短轴位都能够清晰显示指伸肌腱的附着点,并冻结、保存图像。逐个手指检查远端指间关节、并记录是否有亚临床附着点炎。对附着点炎的解释基于2007年风湿病学临床试验观察小组(Outcome Measure in Rheumatology in Clinical Trails,OMERACT)超声组对于附着点炎的共识(两个平面观察肌腱是否失去正常结构回声或增粗;附着点处能量多普勒信号增多;伴或不伴骨质侵蚀等改变)[11]。
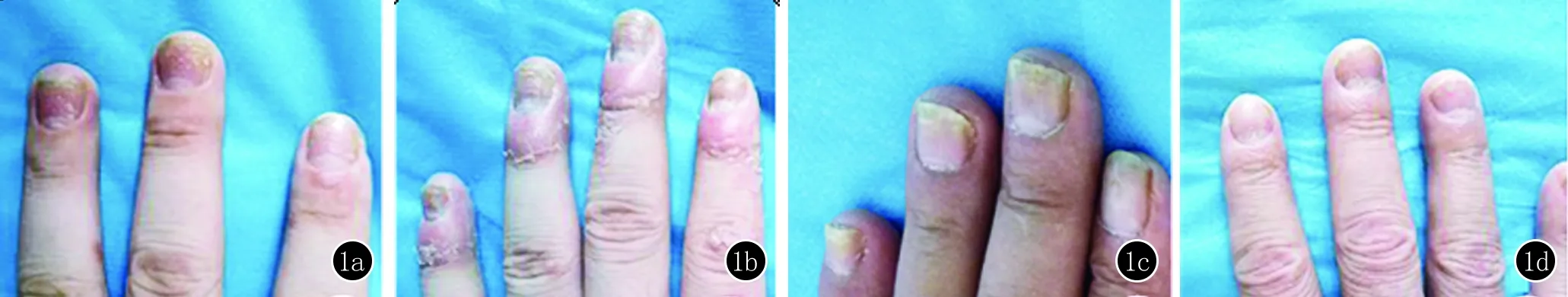
1.2.3 指甲的测量 在被检查者指甲上涂适量的耦合剂,采用多平面扫描,自指甲正中向两侧、从甲半月向指甲末端扫描,使能够观察整个指甲。在指甲的正中长轴位置冻结并保存图像。正常的甲板超声表现为三层结构,两条高回声带(腹侧甲板和背侧甲板)及中间的低回声带。甲板的厚度表示为背侧甲板上缘和腹侧甲板下缘之间的距离。在甲床、甲母水平自腹侧甲板下缘至远节指骨骨质表面做垂线,二者之间的距离分别记为甲床厚度和甲母厚度(图2)。
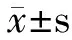
1a:顶针样凹陷 1b:指甲变色1c:甲剥离1d:甲板缺如
图1 银屑病甲损害
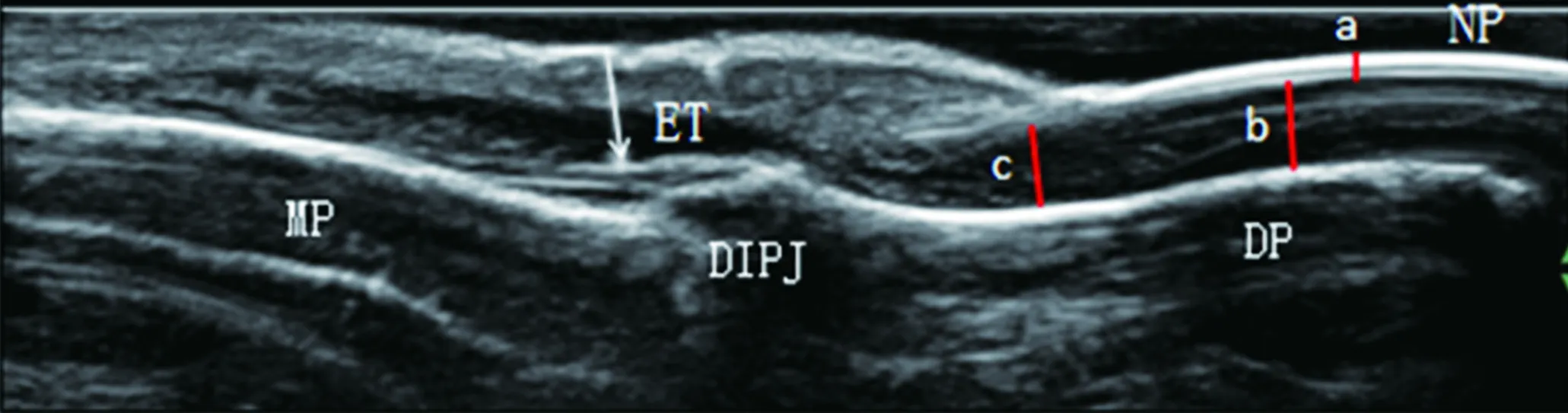
a:甲板厚度:背侧甲板和腹侧甲板的最大距离 b:甲床厚度:甲床水平腹侧甲板至远节指骨骨质表面的距离 c:甲母厚度:甲母水平腹侧甲板至远节指骨骨质表面的距离
图2 超声可以清晰的显示甲板、甲床、甲母及指伸肌腱附着点的结构
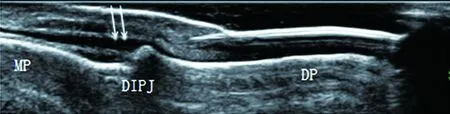
图3 附着点炎:指伸肌腱附着点处明显增粗,回声减低(双箭头);DIPJ:远端指间关节;DP:远节指骨;MP:中节指骨
2 结果
2.1 一般资料 本次研究中,共纳入96例银屑病患者,均无关节炎的临床症状,年龄18~69岁,其中甲损害组45例,甲正常组51例。两组患者的性别、年龄均无统计学差异。甲损害组的银屑病病程和PASI评分与甲正常组相比亦无统计学差异(表1)。
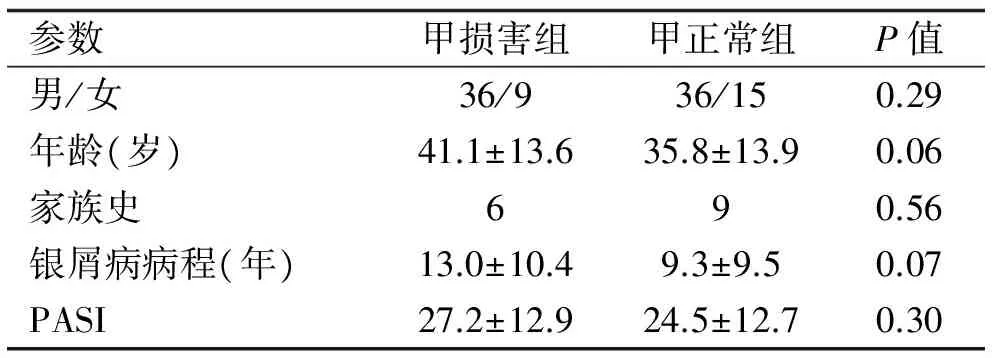
表1 银屑病患者基本临床特征
2.2 两组患者亚临床附着点炎的发生率 共对960个手指远端指间关节进行高频超声检查,均未发现手指骨质侵蚀等关节炎表现。正常指伸肌腱的超声图像表现为平滑的线样低回声结构(图2),发生炎症的附着点明显增粗、回声减低(图3)。超声检查发现甲损害组45例患者中16例有亚临床附着点炎(35.5%),甲正常组5例有亚临床附着点炎(9.8%),采用χ2检验对两组结果进行比较,P=0.002(P<0.01),差异有统计学意义。与甲正常组相比,甲损害组发生附着点炎的相对危险度OR为3.5(95%CI: 1.4-8.9)。
2.3 超声测量甲板、甲母和甲床厚度的比较 对超声测量的甲损害组和甲正常组指甲厚度的比较采用独立样本的t检验,结果发现甲损害组甲母厚度与甲正常组比较明显增厚,差异有统计学意义(1.66 VS 1.52,P<0.001);2组患者甲床厚度相比差异亦有统计学意义(1.75 VS 1.47,P<0.001);而甲板厚度相近(0.70 VS 0.70,P=0.85),见表2。

表2 两组银屑病患者指甲厚度的比较
3 讨论
附着点炎被认为是关节病型银屑病的特征性病理改变[12]。近些年,随着高频超声技术的发展,银屑病患者附着点炎特别是亚临床附着点炎的存在逐渐得到了皮肤科医师的重视。许多学者对银屑病甲损害与附着点炎的关系做了研究,但得出了不同的结论。
2007年,Tan等[13]通过组织病理学和MR检查证实甲损害与指伸肌腱存在解剖学联系。Gutierrez等[14]的研究显示银屑病患者下肢附着点炎的发生率较正常对照组明显增多(32.9% VS 8.4%,P<0.0001)。Acquitter等[15]通过超声对银屑病患者上下肢肌腱和手足指(趾)甲进行系统检查,发现亚临床附着点炎的发生率为20.8%,与对照组相比无明显统计学差异(55 VS 53,P=0.66),肌腱的厚度亦无明显差异。Castellanos-Gonzlez等[16]对银屑病患者双手指伸肌腱附着点及甲损害做了相关研究,发现甲损害组附着点炎较正常甲组明显增多,但无统计学意义(31.1% VS 13.8%,P=0.07),但是NAPSI评分与附着点炎显著相关。本次研究中,我们得出了与Gutierrez相似的结论,银屑病甲损害组45例患者中16例有亚临床指伸肌腱附着点炎,较甲正常组(5/51)明显增多。
我们猜测不同的研究结果可能是研究者对附着点炎的定义理解不同。我们采用的2007年OMERACT对附着点炎的解释,而部分研究者使用GUESS评分系统或其他方法,但目前尚无一个统一的标准;另一个原因可能是部分研究者将下肢肌腱附着点纳入检查的范围,但下肢肌腱如跟腱、股四头肌肌腱更容易受到外伤和重力的影响,附着点炎的发生率可能会高于上肢。
本次研究中,我们发现甲损害组与甲正常组相比,亚临床附着点炎发生的相对危险度为3.5,95%CI为1.4-8.9,这与既往的研究结果是相符合的。2014年,一个对4146例患者研究的回归模型显示甲损害是关节病型银屑病最相关的因素(OR=2.93, 95%CI: 2.51-3.42)[17]。Wilson等对1593例银屑病患者随访观察30年后,得出结论有甲损害的银屑病患者发展为关节病型银屑病的机会是无甲损害患者的3倍(HR=2.93, 95%CI:1.68-5.12)[18]。
目前,临床上对于指甲病变的评价主要采用银屑病指甲病变严重程度评分PNSS、NAPSI和mNAPSI[16]。我们用超声测量甲板、甲母和甲床的厚度,发现甲损害组甲母、甲床的平均厚度分别为1.66 mm、1.75 mm,均较甲正常组明显增厚,而甲板的厚度相近(0.70 VS 0.70 mm,P=0.85)。Acquitter和Aydin也得出了相似的结论[15,19],这个结果也与临床上银屑病指甲病变评分系统的研究结果是一致的[20,21]。这些研究结果说明超声可以有效的评价银屑病甲损害。甲损害临床可见,且表现形式多样。目前,甲剥离被认为是甲损害中与关节病型银屑病相关性最大的分型。遗憾的是,我们并没有对患者的甲损害的分型进行记录。鉴于指甲与远端指间关节之间的解剖关系,有学者推测甲根部或者甲母的炎症改变导致甲板的干细胞分化,引起甲板病变;同时炎症向近端漫延至远节指骨,随后侵及远端指间关节引起附着点炎或关节囊的改变。到目前为止,部分临床医师及患者仍认为银屑病甲损害会随着皮损好转而治愈,对其危害性重视不足。
本次研究的局限性在于超声操作者和体格检查者均为作者本人,尽管为减少误差,每个结果均测量三次取平均值,测量结果仍可能存在偏倚;其次,本次研究共纳入96例银屑病患者,样本量较小,统计结果缺乏说服力。
尽管本次研究证明银屑病甲损害与亚临床附着点炎显著相关,间接证实了先前的研究结果即甲损害是关节病型银屑病的临床预测指标,但目前附着点炎仍未纳入PsA的诊断标准中,对于促进PsA的后续发展的因素并不十分清楚[18,22],因此对于甲损害与关节病型银屑病之间的关系仍需要更多的研究来证实。
[1] Armstrong AW, Schupp C, Bebo B.Psoriasis comorbidities: results from the National Psoriasis Foundation Surveys 2003 to 2011[J].Dermatology,2012,225(2):121-126.
[2] Raposo I, Torres T.Nail psoriasis as a predictor of the development of psoriatic arthritis[J].Actas Dermosifiliogr,2015,106(6):452-457.
[3] Ash ZR, Tinazzi I, Gallego CC, et al.Psoriasis patients with nail disease have a greater magnitude of underlying systemic subclinical enthesopathy than those with normal nails[J].Ann Rheum Dis,2012,71(4):553-556.
[4] Rouzaud M, Sevrain M, Villani AP, et al.Is there a psoriasis skin phenotype associated with psoriatic arthritis? Systematic literature review[J].Eur Acad Dermatol Venereol,2014,28:17-26.
[5] Langley RG, Dauden E.Treatment and management of psoriasis with nail involvement: a focus on biologic therapy[J].Dermatology,2010,221:29-42.
[6] Baran R.The burden of nail psoriasis: an introduction[J].Dermatology,2010,221:1-5.
[7] Armesto S, Esteve A, Coto-Segura P, et al.Nail psoriasis in individuals with psoriasis vulgaris: a study of 661 patients [in Spanish][J].Actas Dermosifiliogr,2011,102(5):365-372.
[8] Jiaravuthisan MM, Sasseville D, Vender RB, et al.Psoriasis of the nail: anatomy, pathology, clinical presentation, and a review of the literature on therapy[J].Am Acad Dermatol,2007,57(1):1-27.
[9] Gladman DD, Antoni C, Mease P, et al.Psoriatic arthritis: epidemiology, clinical features, course, and outcome[J].Ann Rheum Dis,2005,64(Suppl 2):ii14-17.
[10] Talor W, Gladman D, Hilliwell P, et al.Classification criteria for psoriatic arthritis: development of new criteria from a large international study[J].Arthritis Rheum,2006,54(8):2665-2673.
[11] Wakefield RJ, Balint PV, Szkudlarek M, et al.Musculoskeletal ultrasound including definitions for ultrasonographic pathology[J].Rheumatol,2005,32(12):2485-2487.
[12] McGonagle D, Conaghan PG, Emery P.Psoriatic arthritis: A unified concept twenty years on[J].Arthritis Rheum,1999,42(6):1080-1086.
[13] Tan AL, Benjamin M, Toumi H, et al.The relationship between the extensor tendon enthesis and the nail in distal interphalangeal joint disease in psoriatic arthritis-a high-resolution MRI and histological study[J].Rheumatol Oxf Engl,2007,46(2):253-256.
[14] Gutierrez M, Filippucci E, De Angelis R, et al.Subclinical entheseal involvement in patients with psoriasis: an ultrasound study[J].Semin Arthritis Rheum,2011,40(5):407-412.
[15] Acquitter M, Misery L, Saraux A,et al.Detection of subclinical ultrasound enthesopathy and nail disease in patients at risk of psoriatic arthritis[J].Joint Bone Spine,2017,84(6):703-707.
[16] Castellanos-González M, Joven BE, Snchez J, et al.Nail involvement can predict enthesopathy in patients with psoriasis[J].J Dtsch Dermatol Ges,2016,14(11):1102-1107.
[17] Langenbruch A, Radtke MA, Krensel M,et al.Nail involvement as a predictor of concomitant psoriatic arthritis in patients with psoriasis[J].Br J Dermatol,2014,171(5):1123-1128.
[18] Wilson FC, Icen M, Crowson CS, et al.Incidence and clinical predictors of psoriatic arthritis in patients with psoriasis: a population-based study[J].Arthritis Rheum,2009,61(2):233-239.
[19] Aydin SZ, Castillo-Gallego C, Ash ZR, et al.Ultrasonographic assessment of nail in psoriatic disease shows a link between onychopathy and distal interphalangeal joint extensor tendon enthesopathy[J].Dermatol Basel Switz,2012,225(3):231-235.
[20] Williamson L, Dalbeth N, Dockerty JL, et al.Extended report: nail disease in psoriatic Arthritis-clinically important, potentially treatable and often overlooked[J].Rheumatology (Oxford),2004,43(6):790-794.
[21] Rich P, Scher RK.Nail Psoriasis Severity Index: A useful tool for evaluation of nail psoriasis[J].Am Acad Dermatol,2003,49(2):206-212.
[22] Maejima H, Taniguchi T, Watarai A, et al.Evaluation of nail disease in psoriatic arthritis by using a modified nail psoriasis severity score index[J].Int J Dermatol,2010,49(8):901-906.
