携带TBX18的慢病毒载体转染脂肪干细胞并诱导其向起搏样细胞分化的研究*
2018-05-07王方嫒邹强谌晶晶单迎光黄从新
王方嫒 邹强 谌晶晶 单迎光 黄从新
TBX18是保守的转录因子 Tbox家族中与心脏静脉极相关的TBX1亚族中的一员,是新的祖细胞标志因子之一。在心脏发育过程中,众多转录因子参与窦房结的生长发育,包括Tbx18、Tbx3、SHOX2、Isl1等,TBX18在这些转录因子的上游,基因谱系分析表明在心脏流出道区域,表达TBX18的间质祖细胞分化为具有起搏功能的心肌细胞并最终形成窦房结[1-2]。
本实验室前期以腺病毒为载体过表达TBX18能诱导脂肪干细胞(ADSCs)向起搏样细胞分化,随后使用经皮微创的注射方式[3],将携带TBX18的腺病毒载体注入三度房室传导阻滞的犬模型中成功构建异位起搏节律点,然而腺病毒的表达时限较短且不能整合到宿主的染色体中,将TBX18导入细胞或动物体内构建生物起搏表达持续时间短。笔者探索携带TBX18转录因子的慢病毒载体转染ADSCs,使其整合到宿主细胞的染色体中以实现目的基因长期持久的表达,观察其能否诱导ADSCs向起搏细胞分化,进而研究TBX18慢病毒载体构建生物起搏的可行性。
1 材料与方法
1.1材料
低糖 DMEM(L-DMEM)培养基、胎牛血清( G ibco 公司 ) ,羊抗兔 α-SMA 多克隆抗体、驴抗羊 IgG 多克隆抗体 ( Chem icon 公司), I 型胶原酶、胰蛋白酶 (Sigma 公司)、Tbx18慢病毒、GFP慢病毒(汉恒公司),SPF级雌性SD大鼠,重约40~50 g,来自武汉大学动物试验中心。
1.2方法
1.2.1ADSCs的分离与培养 取大鼠双侧腹股沟脂肪垫约5 mL,取下后先在 PBS 液中漂洗 2 次,再移入超净台中,用PBS 液漂洗 3 次,后用眼科剪仔细地去除结缔组织及血管内皮,剪成 1 mm3左右的小块;将剪碎的脂肪组织置于装有 L-DMEM培养基的离心管中,加入 0.1%(质量分数)的 I 型胶原酶,置于37 ℃水浴箱中缓慢震荡 45 min;加入等量的10%FBS的DMEM培养基终止消化,用100 μm的滤网过滤以除去其中未消化的组织,将上层液体移至新的离心管中,1 200 r/min 离心 5 min;将上清液轻轻吸出,将细胞沉淀用完全培养基(含10%FBS)重悬并稀释,再次离心1 200 r/min 离心 5 min;将上清液吸出,用完全培养基重悬,悬浮细胞经血细胞计数板计数后,按3×104cells/mL 密度接种于培养皿后置于 37 ℃、5% CO2培养箱培养;48 h 后换液,以后隔2~3 d换一次液;并用相差显微镜观察细胞形态变化,贴壁细胞至 80%~90%融合时,用0.25%胰蛋白酶消化传代。
1.2.2人TBX18慢病毒制备 pHBLV-CMV-MCS-3flag-EF1-ZSgreen-puro载体(汉恒公司提供)酶切线性化并胶回收;聚合酶链式反应(PCR)扩增 TBX18的开放阅读框,酶切完成后 回 收 胶;采用HB-infusionTM无缝克隆试剂盒对将 酶切后的片段和酶切后的载体进行克隆连接;转化感受态细胞DH5a;将转化后的TBX18平板挑菌,提取质粒后酶切鉴定,用293细胞进行扩增,直至获得大量纯化的TBX18慢病毒载体。
1.2.3病毒转染效率 确定ADSCs最适感染复数(MOI值),取第 3 代 ADSCs 接种入24 孔板中,待生长至 50%融合时,分别以 MOI=0,20,50,80,100 转染携带Tbx18慢病毒,然后加入无血清DMEM 培养基使总体积为1 ml,混匀,置于CO2培养箱中培养,感染后24 h,用新鲜的完全培养基替换含病毒的培养液,继续 37℃培养。感染后48、72 h通过荧光显微镜观察。同时各感染细胞分别加入 0.25%胰蛋白酶消化,250 μl PBS 重悬后于 200 目滤网过滤送检,应用流式细胞仪对GFP阳性细胞率进行定量分析。
1.2.4转染细胞中目的蛋白的分析 取第 3 代 ADSCs 接种入6孔板中,待生长至 50%融合时,弃培养基,PBS洗3遍,随机分为TBX18组、GFP组、null组三组,每组设三个平行孔。TBX18组转染TBX18慢病毒,GFP组转染等量的GFP慢病毒作为空病毒对照组,null组不转染病毒作为空白对照组。加入按最适MOI计算所需的慢病毒量(所需病毒液的体积=细胞数×MOI/病毒滴度),然后加入无血清DMEM 培养基使总体积为 2 ml,混匀,置于CO2培养箱中培养,感染后24 h,用新鲜的完全培养基替换含病毒的培养液。转病毒7天后,用TBS缓冲液润洗待测细胞2~3次,加入适当体积的细胞总蛋白提取试剂裂解。收集细胞并在4°C 2 000 r/min离心5 min,吸取上清,即为总蛋白溶液。使用BCA蛋白质浓度测定试剂盒测定样品的蛋白浓度。按照每泳道40 ug总蛋白进行12%聚丙烯酰胺凝胶(SDS-PAGE)电泳。用5%脱脂奶粉TBST溶液封闭和稀释一抗,GAPDH(以1∶10 000稀释),TBX3(以1∶1 000稀释),SHOX2(以1∶500稀释),ISL1(以1∶1 000稀释),缝隙连接蛋白Cx45(以1∶1 000稀释)、Cx43(以1∶2 000稀释)、Cx 30.2(以1∶1 000稀释)、肌钙蛋白(cTnI)(以1∶1 000稀释)、α-肌动蛋白(SMA)(以1∶5 000稀释)和GADPH(以1∶10 000稀释)。封闭1h后,一抗4°C过夜;后用TBST溶液冲洗。二抗采用HRP-GoatantiRabbit(以1∶10 000稀释)孵育30min,并用TBST冲洗。用化学发光检测法显影。各条带扫描后采用图像分析系统分析平均灰度值,自以GADPH校正计算相对表达量。GFP组及null组的检测方法同前。
1.2.5α-SMA的检测 取第3代 ADSCs 接种入6孔板中,待生长至70%融合时,弃培养基,PBS洗3遍,随机分为TBX18组、GFP组两组,TBX18组转染TBX18慢病毒,GFP组转染等量的GFP慢病毒作为空病毒对照组。分别以最适MOI转染TBX18慢病毒及GFP慢病毒,培养48 h 后换液,72 h 后置于荧光显微镜下观察。弃去培养基,PBS洗涤 2 次,4%多聚甲醛固定 15 min,用 PBS 洗三遍,0.2% Triton X-100 通透 15 min,PBS 洗三遍,5% 羊血清封闭 30 min,加入一抗(羊抗兔 α-SMA,1∶100),4℃湿盒内过夜,用 PBS 洗3 遍,加驴抗羊 IgG 的二抗(1∶400),室温避光放 2 h,PBS 洗 3遍。弃掉洗涤液,最后用 DAPI 复染细胞核。甘油封固后,荧光显微镜下观察结果。
1.2.6TBX18,HCN4mRNA的检测 取第 3 代 ADSCs 接种入6孔板中,待生长至50%融合时,弃培养基,PBS洗3遍,随机分为TBX18组、GFP组两组,TBX18组转染TBX18慢病毒,GFP组转染等量的GFP慢病毒作为空病毒对照组。分别以最适MOI转染TBX18慢病毒及GFP慢病毒,培养48 h 后换液,72 h 后置于荧光显微镜下观察。分别采用实时 RT-PCR 方法检测第7、14、21、28天细胞TBX18及HCN4 mRNA水平,以 NAGPH作为内参校正后计算的相对表达量。弃去培养基,PBS 洗 2 次,采用 Trizol 试剂提取总 RNA。取少量 RNA溶液用 TE 稀释(1∶100) 后,读取其在分光光度计 260 nm 和280 nm 处的吸收值,进行 RNA 的浓度和纯度的测定。进行变性琼脂糖凝胶电泳,并在紫外透射光下观察其完整性。cDNA的合成体系:5 ×AMV Buffer 2.0 μL,dNTP Mixture 2.0 μL,AMV 1.0 μL,Oligo dT1.0 μL,RNase Inhibitor 1.0 μL,总RNA13 μL(2 μg),加入逆转录酶 0.5 μL,37°C水浴 60min。然后 95 °C干浴 3min。PCR使用 SYBR Green I PCR 试剂盒。引物设计:在http://www.ncbi.nlm.nih.gov检索 TBX18和HCN4。引物序列如下:TBX18 5′-TGCTGTCCCTGCTACACATC-3′,5′-GCTGTAGGTCTCTGCCAAGG-3′;HCN4 5′-CACTAAGGGCAACAAGGAGACC-3′, 5′-TCTTTGTTGCCCTTAGTGAGC-3′反应体系为:加入 SYBR Green 1 染料 10μL,引物混合物 1 μL,cDNA 5 μL,PCR 反应条件为93°C,2 min。
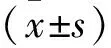
2 结果
2.1脂肪干细胞的表型特征
脂肪干细胞进行原代培养,接种4 h后开始贴壁,显微镜下观察多呈圆形或椭圆形,细胞核居中。接种后24 h,细胞换液, 基本为贴壁细胞,有突起伸出,为多边形、三角形或呈长梭形。纤维细胞样形态,漩涡状或辐射状生长。原代培养的细胞 7 d 左右可达 80%~90% 融合,细胞集落间相互重叠交叉 ,可以传代。传代后细胞 24 h 贴壁,增长迅速,2~3 d 可传一代,经 3 ~ 4代传代纯化,细胞逐渐朝一个方向排列,胞体细长,类似成纤维细胞样形态,漩涡状或辐射状生长。图1。

图1 光镜下第三代ADSCs形态(× 200)
2.2病毒转染效率
病毒转染后72 h 后置于荧光显微镜下观察,三组均有绿色荧光表达,MOI=20 组荧光亮度较弱,荧光细胞数量较少;50、80及100 组荧光亮度及表达的细胞数目相似。但 MOI 值过高可能会造成细胞毒性,MOI=80时细胞增殖减慢,胞体皱缩。当MOI=100则出现细胞漂浮、死亡现象(图 2)。因此我们选用 MOI=50 作为今后的转染剂量。经过持续观察,发现细胞体积变大,长度增长,核仁变大增多,一直有荧光表达。
A: 20 B: 50 C: 80 D: 100

MOIn0205080100转染效率6045.6±3.287.7±2.188.7±2.792.3±2.4
2.3三组转染细胞目的蛋白比较
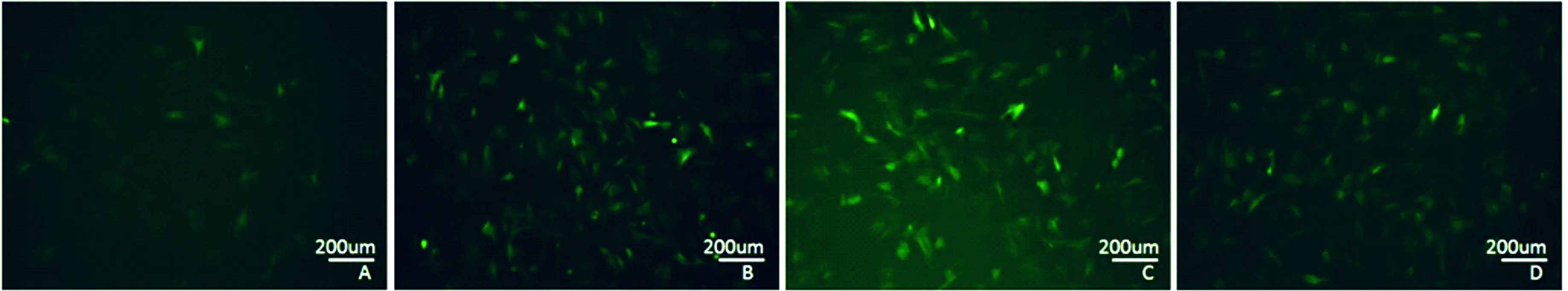
TBX18组Tbx3、SHOX2、ISL1、cTN1、α-SMA、HCN4和Cx45、Cx30.2的蛋白表达水平显著高于GFP组和null组,而Cx43与GFP组差异不大,但显著低于null组(P<0.05,图3、表2)。
2.4TBX18组及GFP组转染细胞的α-SMA比较
TBX18组α-SMA阳性细胞显著增加,荧光显微镜下可见细胞发出红色荧光,GFP组均未见表达(图4)。
2.5TBX18组及GFP组转染细胞的TBX18,HCN4表达水平比较TBX18组可检测到持续的TBX18及HCN4表达,且表达量显著高于GFP组(P<0.05;表3)。
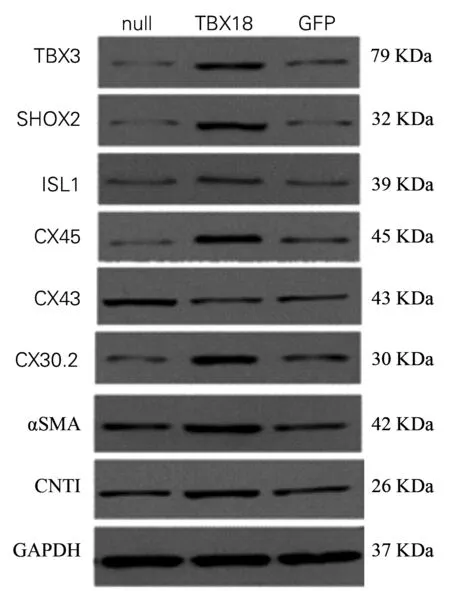
图3转录因子(TBX3、ISL1、SHOX2)、缝隙连接蛋白(CX45、CX43、CX30.2),cTNI、α-SMA的蛋白表达

表2 三组转染细胞目的蛋白相对含量比较
注:与null组比较,*P<0.05;与GFP组比较,#P<0.05
3 讨论
ADSCs 是源于脂肪组织的成体干细胞,具有自我更新和多向分化潜能且具有一定免疫调节功能的生物细胞,可抑制T淋巴细胞增殖和活化,不会引起免疫排斥反应[4]。还具有取材简便,来源广泛,患者创伤小,不存在伦理问题等重要特性,有望成为构建具有完整生物学功能的生物起搏细胞。
以往的基因治疗方法大多是通过腺病毒作为载体将TBX18导入细胞或动物体内。与腺病毒相比,慢病毒最大优点是在感染分裂期细胞的同时,还可感染静止期的细胞,目的基因可经过病毒整合酶作用整合与宿主染色体组相融合,且在细胞分裂和分化过程中不会丢失,具有感染范围广和可在体内外长期、稳定表达优势[5-6]。除此之外,因为慢病毒是一种复制活性的假病毒,比腺病毒更具安全性,并且本研究应用的第四代慢病毒包装系统,相较于第三代包装系统,其将 pol基因分离出来,使gag、pol和env成为 3个独立载体,而不是两个载体,进一步提高了生物安全性且尚未发现慢病毒具有致瘤活性。
A~D为TBX18组, E~H为GFP组,图中蓝色为细胞核,绿色为病毒转染细胞,红色为α-SMA表达细胞(×400)
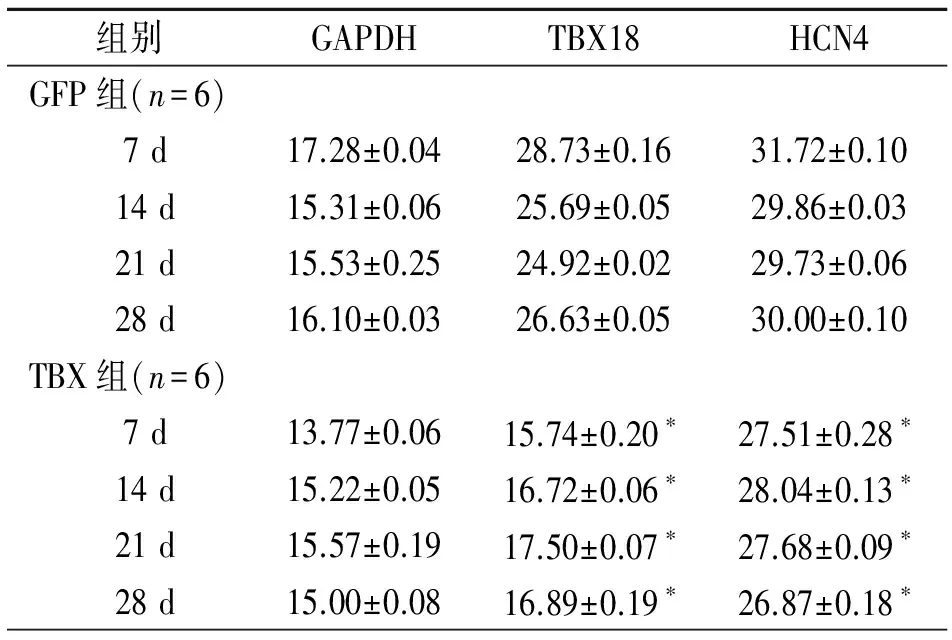
组别GAPDHTBX18HCN4GFP组(n=6) 7d17.28±0.0428.73±0.1631.72±0.10 14d15.31±0.0625.69±0.0529.86±0.03 21d15.53±0.2524.92±0.0229.73±0.06 28d16.10±0.0326.63±0.0530.00±0.10TBX组(n=6) 7d13.77±0.0615.74±0.20∗27.51±0.28∗ 14d15.22±0.0516.72±0.06∗28.04±0.13∗ 21d15.57±0.1917.50±0.07∗27.68±0.09∗ 28d15.00±0.0816.89±0.19∗26.87±0.18∗
注:与GFP组相应时间点比较,*P<0.05
本研究初步探讨了慢病毒介导TBX18诱导ADSCs分化为起搏样细胞。笔者的结果显示TBX18慢病毒载体体外能转染入ADSCs ,细胞的形态发生了变化,肌管样细胞明显增多,TBX18转染的ADSCs中cTN1和α-SMA的蛋白表达水平显著高于GFP组和null组,说明诱导分化细胞已经具有心肌细胞的特征,而且TBX18可上调Tbx3、Shox2、ISL1、HCN4和Cx45、Cx30.2的蛋白表达水平的同时下调Cx43的表达,说明部分已经有向起搏细胞分化。诱导4周后,转染的ADSCs仍表达相对较高的荧光强度,并且RT-PCR证实TBX18组TBX18及HCN4在慢病毒转染的1~4周内有持续表达,且显著高于GFP组,说明慢病毒适用于长时间观察细胞在体内外的生物学行为,比腺病毒更有可能构建长期的生物起搏活性。
虽然我们通过细胞形态学变化和特异基因及缝隙连接蛋白的表达显示ASDCs已有向起搏样细胞转化,但本实验仍然存在一些不足:只检测到HCN4蛋白的分子水平表达,未用膜片钳检测到起搏电流,未充分验证分化细胞的起搏功能以及未深入探讨其内在机制。这些还需进一步研究。
1 Mommersteeg MT,Dominguez JN,Wiese C,et al.The sinus venosus progenitors seperate and diversify from The first and second heart fields early in development[J].Cardiovasc Res,2010,87(1):92
2 Wiese C,Greskamp T,Airik R, et al. Formation of the sinus node head and differentiation of sinus node myocardium are independently regulated by Tbx18 and Tbx3[ J].Circ Res,2009,104 (3):388
3 单迎光,赵庆彦,黄鹤,等.在体经皮微创注射TBX18构建生物起搏点[J].中国心脏起搏与心电生理杂志,2016,30(6):527
4 Rehman J, Traktuev D, Li J, et al. Secretion of angiogenic andantiapoptotic factors by human adipose stromal cells[J]. Circulation,2004,109(10):1 292
5 Kubo S, Kataoka M, Tateno C, et al.In vivo stable transduction ofhumanized liver tissue in chimeric mice via high-capacity adenoviruslentivirus hybrid vector[J].Hum Gene Ther, 2010, 21 ( 1 ) :40
6 Montini E, Cesana D, Schmidt M, et al. Hematopoietic stem cell gene transfer in a tumor-prone mouse model uncovers low genotoxicity of lentiviral vector integration[J].Nat Biotechnol, 2006, 24( 6) :687
