钾离子电池关键材料的研究进展
2018-05-05李文挺安胜利邱新平
李文挺,安胜利,邱新平
钾离子电池关键材料的研究进展
李文挺1,2,3,安胜利2,3,4,邱新平1
(1清华大学化学系,北京 100084;2北京科技大学冶金与生态学院,北京 100083;3内蒙古科技大学材料与冶金学院, 内蒙古 包头 014010;4鄂尔多斯应用技术学院,内蒙古 鄂尔多斯 017000)
钾具有资源丰富、价格低廉以及较低的电化学电势的特点,利用其开发的钾离子电池具有低成本、长寿命、能量密度高等特点,可满足储能领域需要。然而,钾离子半径大和质量大,给电池电极材料与电解质材料开发提出新的挑战。近年来,在电动汽车与储能应用等重大需求的牵引下,人们对钾离子电池的高容量电极材料和电解液进行了大量的研究工作。其中普鲁士蓝及其类似物、过渡金属氧化物和聚阴离子材料等正极材料展现了应用前景;负极材料主要包括碳基、钛基和合金类材料;电解质材料有酯类电解质和醚类电解质,这些研究成果为钾离子电池的基础与应用研究提供了重要的指导意义。
钾离子电池;正极材料;负极材料;电解质
近年来,人类过度使用化石能源引起的能源与环境危机严重影响了人类社会的可持续发展,解决这一矛盾重要途径的是使用太阳能、风能、潮汐能等清洁可再生能源。可再生能源存在间歇性和随机性特点[1],需要高效的储能设备。电化学储能具有方便、高效等优点,被认为是一种较理想的储能方式。近年来,我国对电化学储能方式进行了大量示范应用,所涉及的电池体系有锂离子电池、液流电池、铅酸电池等,锂离子电池因其寿命长、能量效率高,较其它电池体系更显优势。然而,由于锂离子电池是电动汽车的主力电源,电动汽车的快速发展加剧了锂资源短缺,推高了锂离子电池的价格,给锂离子电池在电动汽车以及储能系统规模化应用带来挑战,迫切需要开发出无资源限制、能量密度高的二次电池体系,以满足日益增长的电动汽车与储能系统的需求。一种电池系能否适用于储能系统,除其电化学特性外,还需要考虑其经济性,可以采用式(1)估算储存1度电时储能系统给电价额外增加的成本:
E=B/B/+(1/-1)×(1)
式中,E是储能系统输出1 kW·h电能需要额外增加的成本,B是1 kW·h电池的成本,B是电池的寿命,是电池的效率,是电价。表1是利用该式计算的不同电池体系的结果,计算时,我们使用的电价以0.5元/(kW·h)计,以全充全放容量衰减至80%时的循环次数作为电池的使用寿命。从表中可以看出,电池的成本、使用寿命以及电池的效率是决定储能系统额外成本的关键。一般水溶液电池系统如铅酸、液流电池的能量效率低,因此其输出1 kW·h电池,需要消耗更多的电量。
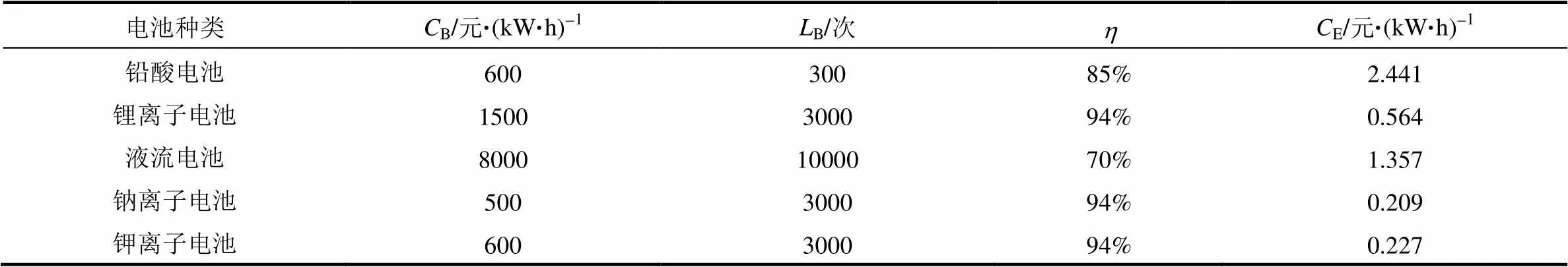
表1 几种电池系统储能的额外成本
锂离子电池采用非水溶液作为电解质,具有较高的能量效率、长的循环性能、同时具有能量密度高、充放电倍率高等一系列显著优点,该电池体系自20世纪90年代开始商业化应用以来,已广泛应用于电子产品、电动汽车、规模化储能系统中,然而由于全球锂资源储量的限制(以碳酸锂计大约58M吨,可开采储量为25M吨,预计可开采时间不超50年),已严重制约了其在大规模储能领域内的应用,急需开发新一代高能量密度、低成本的储能体系。
钠和锂在同一主族,且具有相似的物化性质,自然界中储量丰富,价格低廉,因此钠离子电池被当做最有希望替代锂离子电池的储能设备,得到学术界的广泛关注[2-5],但因钠离子半径大(1.02Å)和标准电极电势(-2.71V. SHE)高,钠离子电池的能量密度和功率密度仍然和锂离子电池有较大差距[3-4,6-7]。
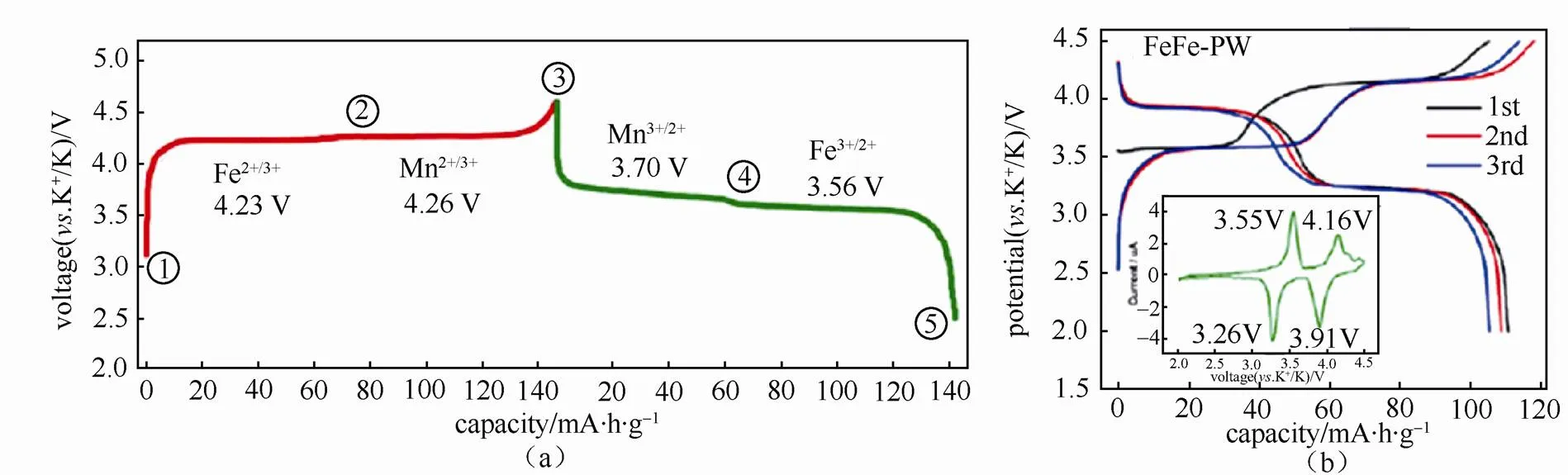
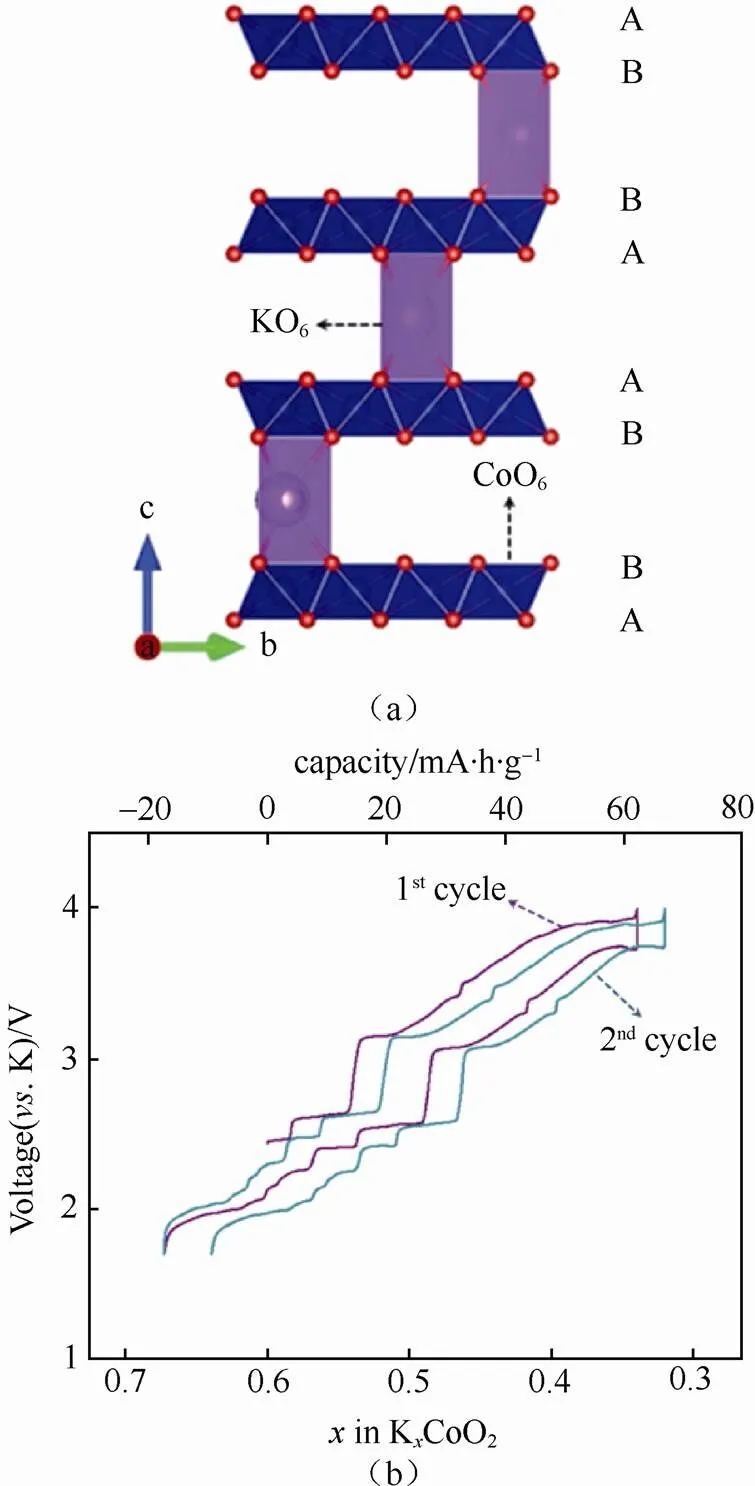
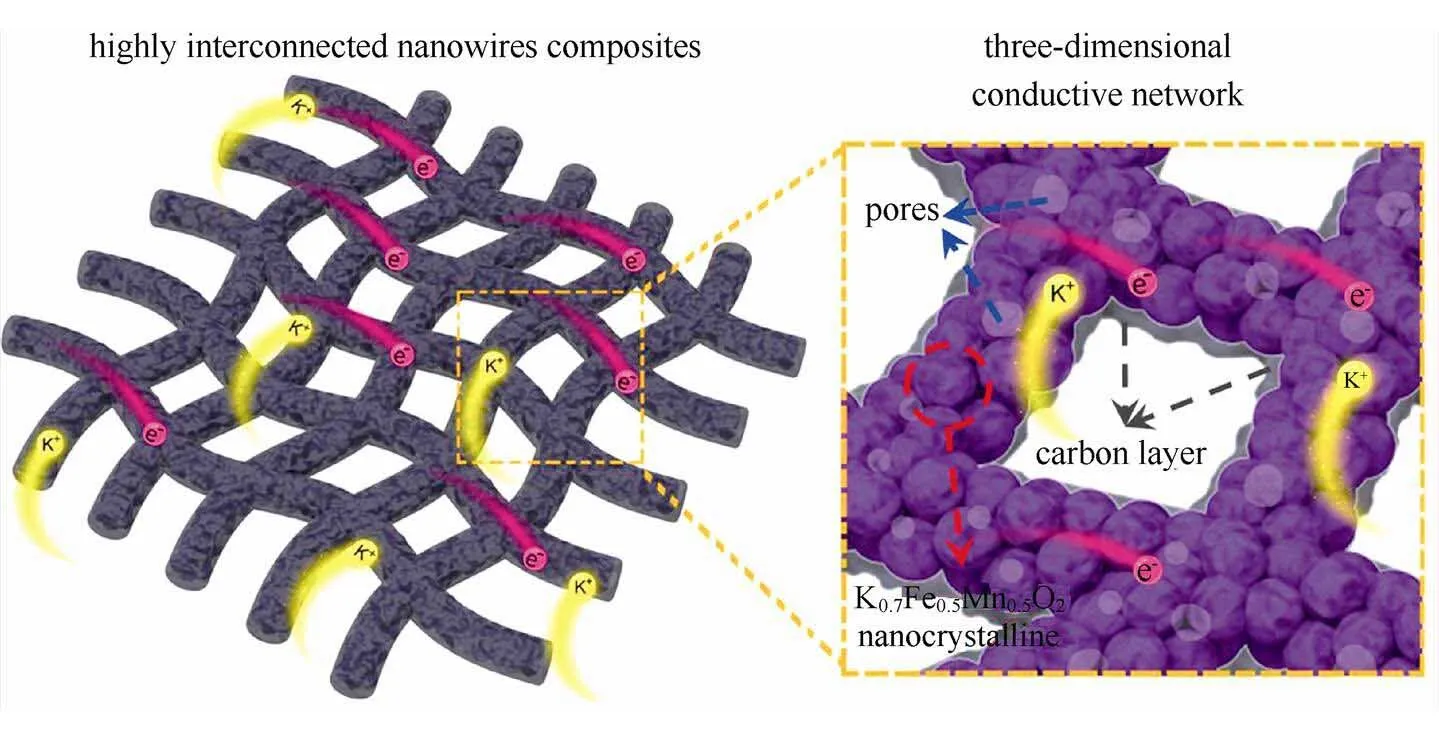
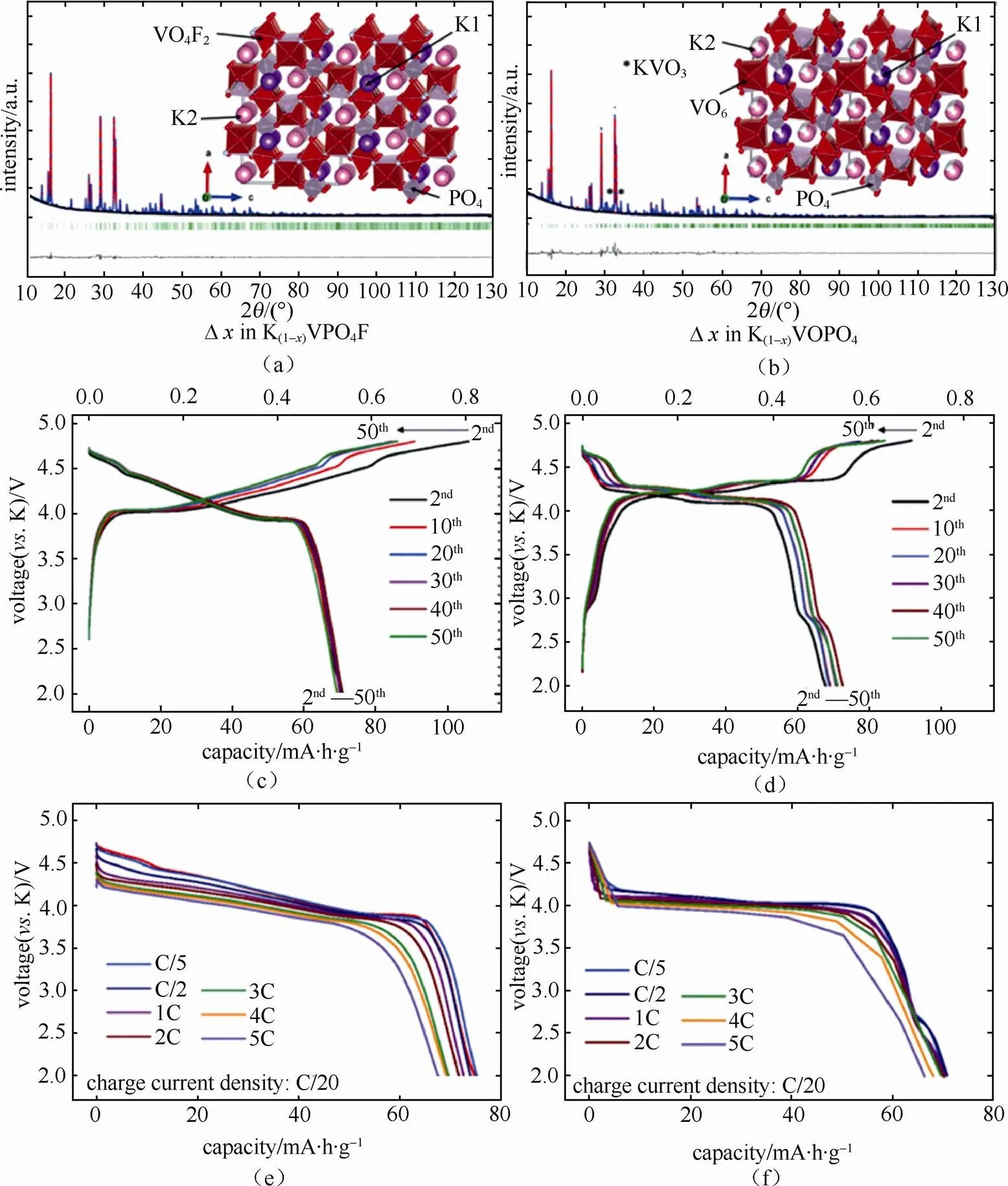
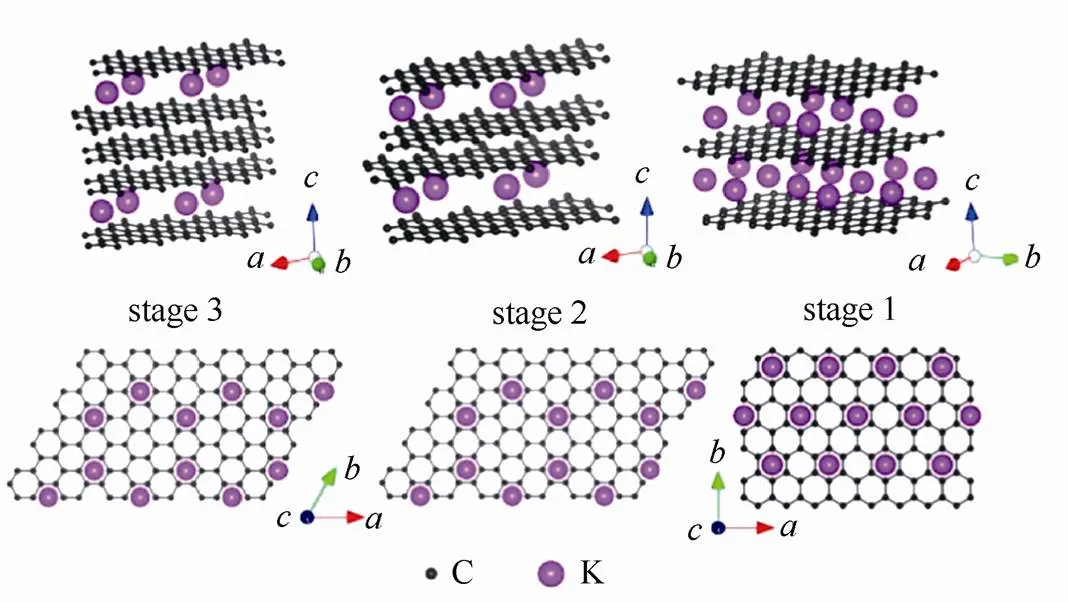
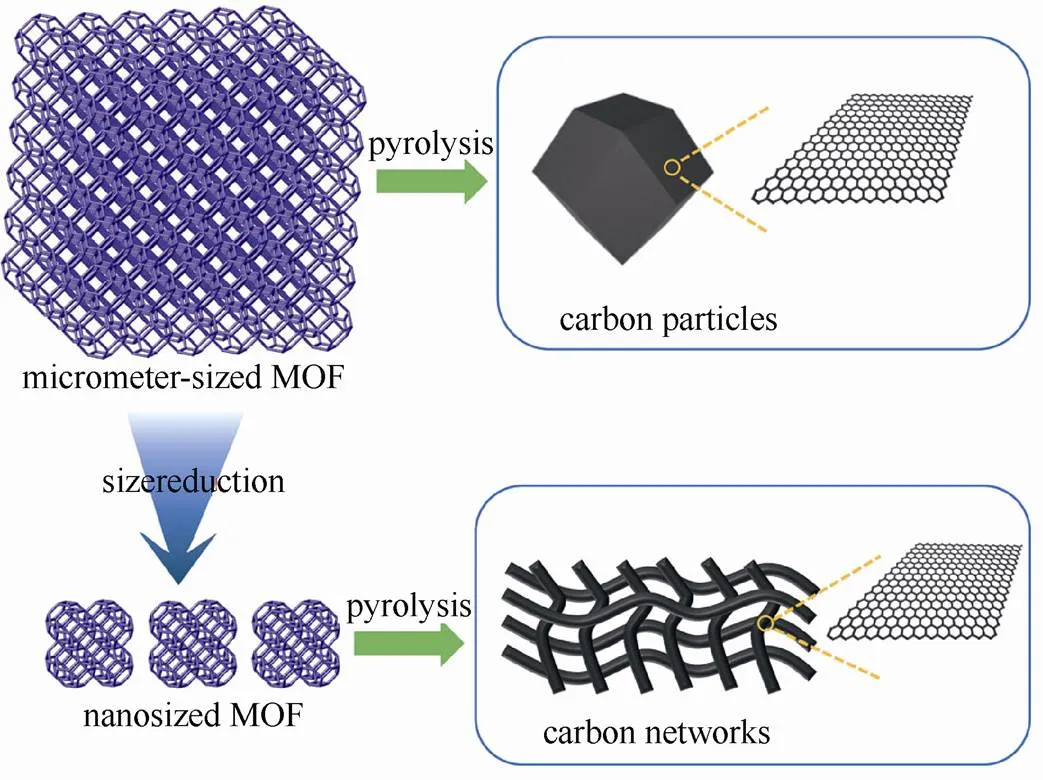
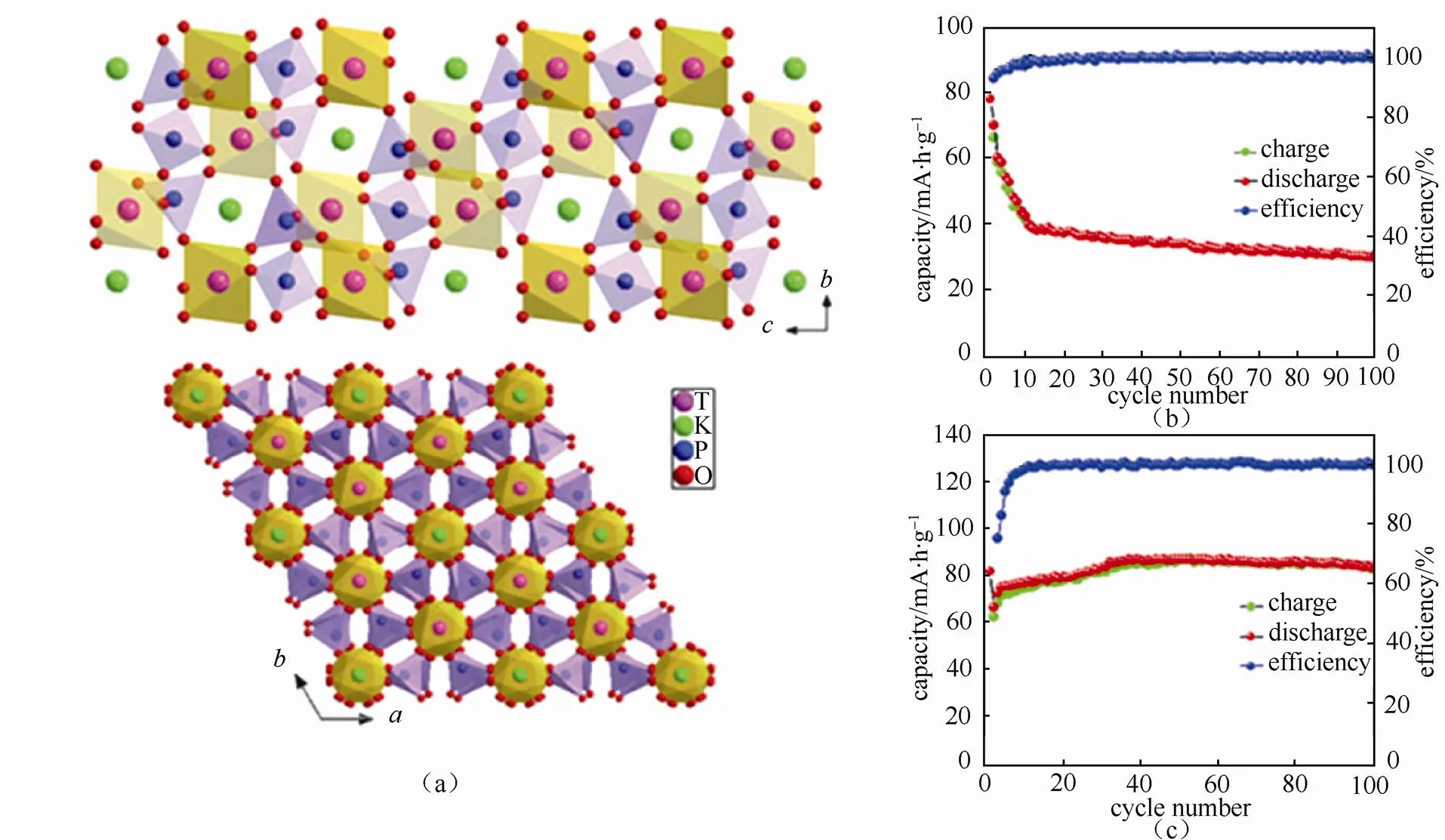
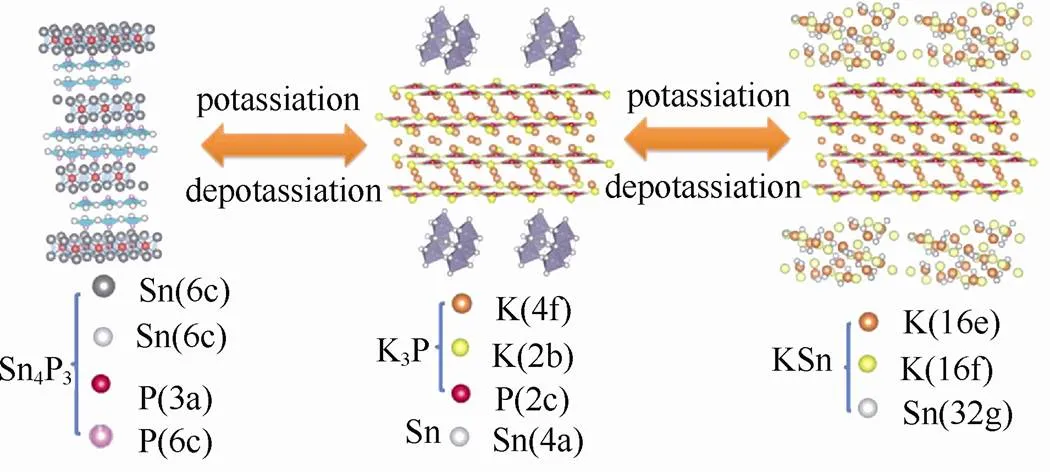
钾属碱金属元素,其化学性质以及储量与钠元素相似,作为电池材料具有以下优势:①资源丰富,钾资源在地球上的储量丰富,占地壳的2.09%,与钠资源(2.36%)接近,是锂资源(0.0017%)的1000多倍[8],钾的价格相对锂资源要低很多,目前工业级的钾金属价格90000元/吨,钠金属价格21000元/吨,锂金属价格800000元/吨[9](如表2所示);②电极电势低,锂钠钾同属第一主族,在有机非水电解质溶液中,K/ K+的电极电势比Na/ Na+和Li/ Li+的都要低,例如:在PC溶液中锂钠钾的电极电势(对标准氢电极)高低次序为:K(-2.88V) 表2 钾离子电池的价格优势 图1 液态钾钠合金负极和固体钾和钠负极对比[11] 普鲁士蓝(PB)及其类似物(PBAs)由于具独特的三维隧道结构,可使碱金属离子在其晶格中进行可逆脱嵌,表现出良好的电化学性能。普鲁士蓝类化合物可用AMa[Mb(CN)6]·H2O通式表示,其中A代表碱金属元素,Ma和Mb分别代表过渡金属元素,其结构为面心立方结构。过渡金属离子分别与氰根中的C和N形成六配位,碱金属离子处于三维通道结构和配位孔隙中[14]。普鲁士蓝类似物NaMFe(CN)6·H2O作为非水基钠离子电池正极材料,目前已经进行了广泛的研究[15-18]。但普鲁士蓝及其类似物最开始只用于水基钾离子电池[19-20],EFTEKHARI最早把普鲁士蓝作为非水基钾离子电池的正极材料进行研究,发现其具有良好的电化学性能[21]。 普鲁士蓝及其化合物的电化学性能主要和其离子迁移数、过渡金属和结晶水有关。①正负极之 间可逆钾离子的数目对电池的电化学性能有很大 影响,理论上增加正极材料的钾离子的含量可以 提高电池的能量密度。研究发现普鲁士蓝类化合物KMnFe(CN)6正极材料由于可容纳接近两个钾离子,因而具有较高的理论容量。GOODENOUGH等[22]合成的普鲁士蓝类化合物K1.89Mn[Fe(CN)6]0.92·0.75H2O,具有3.6 V的高放电电压和高的可逆容量142 mA·h/g。②普鲁士蓝类似物中一般含有两种不同自旋态的过渡金属,在循环过程中发生相应的价态变化,用Mn替换KMFe(CN)6·H2O正极材料中过渡金属M,得到在充放电时包含Mn3+/Mn2+和Fe3+/Fe2+两对氧化还原反应[如图2(a)所示][22],其中Mn与N相配位,处于高自旋状态,Fe与C相链接,处于低自旋状态。当用M=Fe时,制备得到K1.68Fe1.09Fe(CN)6·2.1H2O正极材料[23],在3.9V和3.3 V电位有两个平台,分别对应C边和N边Fe3+/Fe2+氧化还原反应[如图2(b)所示],分别对应高自旋状态的Fe变价和低自旋状态的Fe变价。③普鲁士蓝化合物中存在一定量的结晶水,结晶水的存在占据钾离子的位置,影响材料储钾能力,同时影响循环过程中钾离子的迁移。结晶水的存在主要由于材料合成过程中存在大量空隙,结晶水进一步祛除,其可逆容量,循环寿命和库仑效率都得到进一步提高[22]。 图2 (a)KxMnFe(CN)6的恒电流充放电曲线;(b)KxFeFe(CN)6的充放电平台[22-23] 除了以上因素外,材料的晶粒尺寸对也其电化学性能有很大影响,如通过柠檬酸共沉淀法制备的纳米K1.7Fe[Fe(CN)6]0.9,当晶粒尺寸达到20 nm时[24],接近140 mA·h/g的理论容量,并拥有两个清晰的电压平台3.2 V和4.0 V,当晶粒尺寸增大后,其电化学性能下降。 综上所述,普鲁士蓝类化合物作为钾离子电池正极材料有以下几种优势:① 成本低,其原材料主要是Fe和Mn,资源比较丰富且价格较低;② 电化学性能好,具有良好的循环稳定性和倍率性,因此普鲁士蓝类化合物是较理想的钾离子电池正极 材料。 过渡金属氧化物AMO2(A=Li、Na、K等,M=Co、Ni、Mn等)具有毒性小,成本低且合成工艺简单的特点,在锂、钠离子电池得到广泛应 用[25-30]。早在1975年就有关于钾钴复合氧化物(KCoO2)结构的报道[31],但当时并没有研究其电化学性能。HIRONAKA课题组最早研究了KCoO2正极材料的电化学性能[32],他们发现在2.0~3.9V电压区间,KCoO2具有多个放电电压平台,KCoO2工作电压与CoO2的层间距有关,该材料的其可逆容量在60 mA·h/g左右,且具有较好的循环稳定性和倍率性。对P2结构的KCoO2的进一步研究结果表明[33], K+的可逆嵌入/脱嵌区间在0.33<<0.68,其结构和电化学性能如图3所示。 KCoO2材料中的Co成本高且有毒,而Mn相对于Co具有资源丰富和价格低廉的特点,采用锰的化合物作为电极材料受到广泛关注,VAALMA等[34]通过对K2MnO4进行热处理得到层状K0.3MnO2,他们发现层状K0.3MnO2的初始电容量为136 mA·h/g,在1.5~3.5 V范围内具有良好的循环特性,但当上限电压提高到4.0 V时,局部结构破坏,造成容量的不可逆衰减。 向锰氧化物中引入其它元素,可以进一步提高其容量,如采用 K0.67Ni0.17Co0.17Mn0.66O2层状材料,在保证其循环稳定性的前提下可提高其上限电压,材料的可逆容量达到76.5 mA·h/g,其充放电过程涉及Mn3+/Mn4+和Ni2+/Ni4+两组氧化还原反应[35],但该材料的结构仍不太稳定,总体容量仍偏低,难以满足实际应用,为此利用静电纺丝技术制备的K0.7Fe0.5Mn0.5O2纳米线(图4)[36],由于具有稳定的结构和快速的K+扩散通道,在20 mA/g的测试条件下,其初始放电容量达到178 mA·h/g,极大提高了过渡金属氧化物的电化学性能。 图3 (a)K0.6CoO2的结构图;(b)K0.6CoO2的充放电 曲线[33] 图4 K0.7Fe0.5Mn0.5O2纳米线的示意图和e-/K+的三维离子迁移路径[36] 聚阴离子正极材料可以用AM[(XO)]通式表示,其中A代表碱性金属Li、Na和K,M为过渡金属离子,X代表P、V、S、Si等元素,从结构上看,以X多面体与M多面体通过共边或共点连接而形成多面体框架,而A离子位于间隙中[37]。聚阴离子材料具有开放结构、较低的离子扩散活化能和稳定的电压平台,其稳定的共价结构使其具有较高的热力学稳定性以及高电压氧化稳定性,该类材料在锂离子电池和钠离子电池中得到了广泛研 究[38-41]。XU等[42]最先报道了K3V2(PO4)3和K3V2(PO4)3/C正极材料,K3V2(PO4)3/C具有3D孔状结构,有利于钾离子的脱嵌/嵌入,其放电电压平台3.6~3.9 V区间,具有良好的循环性能,但充放电容量较低,仅为77 mA·h/g和54 mA·h/g。 为提高钾离子电池聚阴离子化合物正极材料的电化学性能,使用混合的阴离子引入强吸电子基团,可以提高材料的电压。KOMABA等[35]报道了4 V级的KVPO4F和KVOPO4材料(结构如图5所示),通过引入强电负性的F和O,提高了材料的工作电压,从而提高材料的能量密度。KVPO4F和KVOPO4正极材料中钾离子嵌入/脱嵌过程中,主要对应是V3+/V4+和V4+/V5+中心离子的两种氧化还原反应,KVPO4F正极材料的放电容量可达92 mA·h/g,KVOPO4的放电容量为84 mA·h/g,钾离子的嵌入/脱嵌均具有较好可逆性。除了以上磷酸盐类聚阴离子,人们还研究了硫酸盐类聚阴离子电极材料,发现KFeSO4F的电化学性能相对同类型的锂离子和钠离子正极材料,具有更好的电化学性能[44]。 图5 (a)和(b)KVPO4F和KVOPO4的XRD精修图和晶体结构简图;(c)和(d)KVPO4F和KVOPO4的充放电曲线;(e)和(f)KVPO4F和KVOPO4的循环性能[35] 聚阴离子化合物具有稳定的框架结构以及较大的钾离子传输间隙,具有长的循环稳定性和安全性,提高材料的电子电导率,可以获得优异的电化学性能,具有潜在的应用前景。通过选择不同的阴离子基团,构造出混合阴离子体系,可以获得新的结构和新的材料体系。 除了以上几种正极材料外,在钾离子电池中,一些有机材料亦表现出较好的电化学性能,如对菲四甲酸二酐[3,4,9,1,0-perylene-tetracarboxylic- dianhydride (PTCDA)][45-46],其可逆容量可达到131 mA·h/g,但该材料存在容量衰减快的问题,再如1,4-苯醌聚合物(PAQS)的可逆容量达到了 200 mA·h/g[47],是目前发现的可逆容量最高的钾离子正极材料,但该类材料的稳定性问题仍未解决,50次循环后仅可保持75%的容量。 碳基材料具有成本低且环保可再生的特点,是研究得较多的一种负极材料。石墨作为碳基材料的一员,在锂离子电池中具有372 mA·h/g的理论容量,已经得到商业化应用,但实验结果证明钠离子由于不能嵌入到石墨层状结构中,所以石墨不能作为钠离子电池的负极材料[48]。钾是可直接与石墨发生嵌入反应的另外一种碱元素,形成KC8,理论容量为319 mA/g[49]。钾离子亦可以通过电化学方法嵌入到石墨中,可逆容量可达到273 mA·h/g[10,12]。与锂在石墨中的嵌入反应相似,钾离子在石墨嵌入时,会发生阶变,经历KC24->KC16->KC8,对应着3阶向2阶和1阶的转变。作为钾离子电池负极材料,石墨具有高的可逆容量和良好的倍率性,但由于钾离子体积过大,引起石墨结构变形,存在容量快速衰减的缺点。石墨类碳材料作为钾离子电池的负极材料,钾嵌入电极电势在0.23 V(K/K+),较钾沉积电极势高,这可抑制了钾枝晶的产生[9]。但石墨作为负极材料存在两个重大问题:①钾离子嵌入/脱嵌过程中引起的体积变化非常巨大,造成电容衰减迅速且初始库伦效率低;②由于钾离子半径较大,存在钾离子扩散速率慢的缺点,对其倍率性造成负面的影响[50]。 图6 不同的K-GICs的结构简图[50] 人们通过以下方法解决钾离子电池石墨负极出现体积膨胀与钾离子扩散性的问题,主要包括: ①采用多孔结构的材料,例如利用金属有机框架(MOFs)合成了3D结构的石墨材料(合成过程如图7),这样不但增大了电化学反应比表面积,同时缩短了钾离子在碳中的扩散路程,倍率性和循环稳定性明显增加[51];再如,采用静电纺丝制造工艺合成的具有空间网状的3D多孔NFC,同样使得石墨电化学性能得到改善[52],解决了循环寿命低、倍率性差的问题,且缓和了由于体积膨胀造成的结构变形问题,在20 mA/g的条件下NFC的容量达到 270 mA·h/g,在1200次循环过程中电容衰减平均每次衰减0.01%,超过了目前相同条件下所有钾离子电池负极材料,在7.7 A/g的条件下仍可保持 100 mA·h/g的高容量;②原子掺杂,KEITH等[53]通过N掺杂获得了高容量的石墨负极材料,使其容量达到350 mA·h/g。除了N掺杂外,还有B和F掺杂碳材料,甚至有双原子P和O共掺杂还有N和O共掺杂等[54-57],原子掺杂不仅提高了材料的倍率性,同时也使得碳材料本身空位和缺陷增加,调高了材料的储钾能力,提高了材料的容量。 图7 3D结构的石墨合成过程[51] 软碳因具有结晶度低、晶粒尺寸小、晶面间距大以及与电解液的相容性好的特点,可用作钾离子电池负极材料[10,58],如在900 ℃条件下煅烧3,4, 9,10-苝四酸二酐(PTCDA),通过热分解合成了非石墨的软碳材料,该材料在C/40、C/1、C/2和5C条件下的容量分别为273 mA·h/g、210 mA·h/g、 185 mA·h/g和140 mA·h/g的高电容量[59-60],且循环稳定性较石墨好,在2C条件下循环50次可保留81.4%的电容量。 碳材料的微观结构和钾离子脱嵌过程中的材料结构变化直接影响着钾离子电池的电化学性能,但是目前相关研究仅停留在简单的体系甄选阶段,对钾离子脱嵌机制尚需要进一步研究,只有深入的机理研究才能有效指导新材料的开发和性能的改进。 钛基材料具有成本低、循环稳定性好、结构稳定等优点,钾离子在其中的嵌入电极电势较低,可用作钾离子电池的负极材料,目前已被研究的钛基材料主要包括氧化钛TiO2、钛酸盐[61-62](例如K2Ti8O17)、钛磷酸盐[63](KTi2(PO4)3)和碳化钛类化合物[64-66](Ti3C2)等,但这类材料导电性差,需通过掺杂、碳包覆等手段进行改性,例如通过水热法合成纳米立方相的KTi2(PO4)3[63],其结构如图8(a)所示,初始放电容量为75.6 mA·h/g,且具有接近100%的库仑效率,但其第二次放电电容衰减严重,通过碳包覆可改善KTi2(PO4)3正极材料的循环稳定性[如图8(c)所示]。 图8 (a)KTi2(PO4)3的结构图;(b)和(c)KTi2(PO4)3和KTi2(PO4)3/C的循环性能[63] 合金类材料具有导电性好和理论容量高的优点,日益受到人们的关注。合金类负极材料的储钾机理和碳材料还有钛基材料不同,主要是利用钾的合金化反应实现的,但会发生体积膨胀的问题,造成容量的衰减。目前钾离子电池的合金负极材料研究相对较少,已知的有Sb基,Sn基和P基合金负极材料。 早在1993年SANGSTER等[67]对K-Sb体系进行了研究,发现K和Sb可以生成多种化合物,而金属Sb具有褶皱的层状结构原子堆积的空间利用率仅为39%,有利于K的迁移[68],同时Sb具有良好的导电性,因此Sb作为一种非常有潜力的储钾负极材料日益受到人们的关注。吴屹影教授最早把Sb基材料作为钾离子电池负极材料进行了研究,合成的Sb-C材料可与钾形成立方相的合金化合物是K3Sb,其理论容量是660 mA·h/g,实际测得的可逆容量为650 mA·h/g(总容量的98%)[69]。 金属Sn也是一种重要的储钾负极材料,但纯Sn由于存在体积膨胀问题产生电容衰减快,不能直接作为负极材料,需要对其进行改性。目前已报道的研究中主要有三种方法:①与碳形成Sn-C复合物;②Sn的微纳米化;③Sn-P复合物。GLUSHENKOV等[70]通过机械球磨法将Sn和石墨混合合成了Sn-C复合物,在25 mA/g条件下其可逆容量为150 mA·h/g,钾与锡的合金化反应主要通过两步进行,先形成K4Sn相,完全嵌钾后形成KSn相,充放电过程中部分Sn会发生粉化现象,降低了钾离子电池的容量[71]。为解决此问题,进一步合成了Sn4P3/C复合材料,其具有良好的电化学性能,在50 mA/g条件下具有384.8 mA·h/g的可逆容量,且放电平台为 0.1 V相对钠离子电池要高,避免了枝晶的产生提高了钾离子电池的安全性。通过原位XRD对钾离子的嵌入/脱嵌机理进行了研究,发现其反应过程分两步进行(图9),降低了材料的结构变形,提高其稳定性[72]。 图9 Sn4P3/C复合材料的嵌钾/脱钾过程[72] P可以和K形成多种化合物,具有2594mA·h/g的理论容量[73],但也存在导电性差和脱钾过程中体积膨胀的问题,从而限制了其作为钾离子电池的应用。对P基负极材料进行研究,发现其具有很高的容量但衰减迅速,不具有实际应用效果。Sultana等[74]对P基负极材料进行了改性,采用黑磷和C混合合成BP-C复合材料,首次循环容量达到了617mA·h/g,是相同条件下石墨负极材料容量的两倍。磷基负极材料在拥有高比容量、良好循环稳定性等较优电化学性能的同时,其制备工艺复杂、成本高昂的问题也直接影响了该材料的商业化应用。因此,磷基负极材料组分及其结构的优化、高效低成本制备工艺的开发将成为今后的研究重点。 除了以上几种负极材料外,另外一些负极材料,如金属氧化物[75-76]、金属硫化物[77-78],有机物[79-80]等均可以作为储钾负极材料。例如MoS2作为钾离子电池负极材料,200次循环充放电后其容量损失量仅为2.5%,具有良好的稳定性。对苯二甲酸钾(K2TP)具有层状结构,有利于钾离子的嵌入/脱嵌。LEI等[80]报道在200 mA/g的条件下具有229 mA·h/g的稳定可逆容量,500次充放电后可保持94.6%的可逆容量,而且0.6 V的电压平台可抑制枝晶的产生,具有良好的电化学性能,是一种非常有前景的钾离子负极材料。 至今钾离子电池负极材料取得了一定的成果,但由于负极材料的种类不同,其机理和存在的问题也不同,在未来钾离子电池商业化进程中,还需对其进行改善,探索适合工业化生产的廉价负极材料。 电解质是钾离子电池的重要组成部分,负责在正负极材料之间传输钾离子,其黏度、离子电导率、热稳定性、电化学窗口等性质直接影响着整个电池的电化学性能和安全性。有机的电解质溶质基本全部采用KFSI、KPF6和KClO4,溶剂为酯类(PC、EC和DEC等)和醚类(DME),功能添加剂为FEC。目前钾离子电池尚处于发展初期阶段,在电解质方面研究较少。 KOMABA等[12,81]研究了电解质溶质和功能添加剂对钾离子电池电化学性能的影响。在EC:DEC电解液中,KFSI与KPF6和KClO4相比具有较高的溶解度,但在KFSI基电解液中,会出现Al腐蚀现象,造成高电压条件下不可逆现象的出现。当电解质溶质换成KPF6且添加FEC后,钾金属为负极的钾离子半电池的库仑效率和循环稳定性得到提高。但添加剂FEC的添加,使得以石墨为负极的K离子全电池的容量和循环性能变差。 不同的电解液溶剂对钾离子电池的电化学性能有一定的影响,以EC:PC为溶剂相对于EC:DEC和EC:DMC溶剂,钾离子电池具有更高的库仑效率和稳定性,因为DEC和DMC在低电压条件下发生分解,影响了电池的电化学性能[50]。 固态电解质与有机电解液相比,机械强度和热稳定性更好,但目前针对钾离子电池的固体电解质还未研究。 钾离子电池因钾资源储量丰富、成本低廉等优势已在新型二次电池领域受到越来越多的关注。本文主要针对目前钾离子电池正极材料,负极材料和电解质的进展进行了总结,相对于钠离子电池和锂离子电池,钾离子电池具有更高的电压和良好的倍率性,但对其的研究尚处于初期阶段,还存在诸多问题亟待解决:①正极材料的比容量低,限制了电池的比容量,通过本体掺杂和表面改性技术,制备结构稳定的高容量正极材料是提高电池比能量的有效途径;②钾离子电池的充电机理尚不明确,有待进一步深入研究;③电解液的电化学窗口比较窄,限制了电池的工作电压;④与非水基锂离子电池和钠离子电池类似,非水基钾离子电池也存在一定的安全问题,但目前针对此问题的研究较少,需进一步探究。如何通过优化电池制备工艺和电解质体系,选取合适的正负极材料,实现大容量、长寿命、高功率、低成本、高安全性,使其切实在大规模储能中发挥作用,是未来该电池体系的发展方向。 [1] 钱江锋. 先进储钠电极材料及其电化学储能应用[D]. 武汉: 武汉大学, 2012. QIAN Jiangfeng. Advanced Na-storage materials and their electrochemical energy storage applications[D]. Wuhan: Wuhan University, 2012. [2] CARMICHAEL R S. Physical properties of rocks and minerals[M]. Boca Raton: CRC press, 1989. [3] KUNDU D, TALAIE E, DUFFORT V, et al. The emerging chemistry of sodium ion batteries for electrochemical energy storage[J]. Angewandte Chemie International Edition, 2015, 54(11): 3431-3448. [4] YABUUCHI N, KUBOTA K, DAHBI M, et al. Research development on sodium-ion batteries[J]. Chemical Reviews, 2014, 114(23): 11636-11682. [5] 张宁, 刘永畅, 陈程成, 等. 钠离子电池电极材料研究进展[J]. 无机化学学报, 2015, 31(9): 1739-1750. ZHANG Ning, LIU Yongchang, CHEN Chengcheng, et al. Research on electrode materials for sodium-ion batteries[J]. Chinese Journal of Inorganic Chemistry, 2015, 31(9): 1739-1750. [6] SHANNON R D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides[J]. Acta Crystallographica section A: Crystal Physics, Diffraction, Theoretical and General Crystallography, 1976, 32(5): 751-767. [7] MARCUS Y. Thermodynamic functions of transfer of single ions from water to nonaqueous and mixed solvents: Part 3-Standard potentials of selected electrodes[J]. Pure and Applied Chemistry, 1985, 57(8): 1129-1132. [8] HUNT C P, MOSKOWITZ B M, BANERJEE S K. Physical properties of rocks and minerals[M]. Boca Raton: CRC Press, 1989. [9] ZOU X, XIONG P, ZHAO J, et al. Recent research progress in non-aqueous potassium-ion batteries[J]. Physical Chemistry Chemical Physics, 2017, 19(39): 26495-26506. [10] JIAN Z, LUO W, JI X. Carbon electrodes for K-ion batteries[J]. Journal of the American Chemical Society, 2015, 137(36): 11566-11569. [11] XUE L, GAO H, ZHOU W, et al. Liquid K-Na alloy anode enables dendrite-free potassium batteries[J]. Advanced Materials, 2016, 28(43): 9608-9612. [12] KOMABA S, HASEGAWA T, DAHBI M, et al. Potassium intercalation into graphite to realize high-voltage/high-power potassium-ion batteries and potassium-ion capacitors[J]. Electrochemistry Communications, 2015, 60: 172-175. [13] OKOSHI M, YAMADA Y, KOMABA S, et al. Theoretical analysis of interactions between potassium ions and organic electrolyte solvents: a comparison with lithium, sodium, and magnesium ions[J]. Journal of the Electrochemical Society, 2017, 164(2): A54-A60. [14] BARPANDA P, YE T, NISHIMURA S, et al. Sodium iron pyrophosphate: A novel 3.0V iron-based cathode for sodium-ion batteries[J]. Electrochemistry Communications, 2012, 24: 116-119. [15] LU Y, WANG L, CHENG J, et al. Prussian blue: A new framework of electrode materials for sodium batteries[J]. Chemical Communications, 2012, 48(52): 6544-6546. [16] YOU Y, WU X L, YIN Y X, et al. High-quality prussian blue crystals as superior cathode materials for room-temperature sodium-ion batteries[J]. Energy & Environmental Science, 2014, 7(5): 1643-1647. [17] YUE Y F, BINDER A J, GUO B K, et al. Mesoporous prussian blue analogues: Template-free synthesis and sodium-ion battery applications[J]. Angewandte Chemie, 2014, 126(12): 3198-3201. [18] SONG J, WANG L, LU Y, et al. Removal of interstitial H2O in hexacyanometallates for a superior cathode of a sodium-ion battery[J]. Journal of the American Chemical Society, 2015, 137(7): 2658-2664. [19] WESSELLS C D, PEDDADA S V, HUGGINS R A, et al. Nickel hexacyanoferrate nanoparticle electrodes for aqueous sodium and potassium ion batteries[J]. Nano Letters, 2011, 11(12): 5421-5425. [20] PADIGI P, THIEBES J, SWAN M, et al. Prussian green: a high rate capacity cathode for potassium ion batteries[J]. Electrochimica Acta, 2015, 166: 32-39. [21] EFTEKHARI A. Potassium secondary cell based on Prussian blue cathode[J]. Journal of Power Sources, 2004, 126(1): 221-228. [22] XUE L, LI Y, GAO H, et al. Low-cost high-energy potassium cathode[J]. Journal of the American Chemical Society, 2017, 139(6): 2164-2167. [23] WU X, JIAN Z, LI Z, et al. Prussian white analogues as promising cathode for non-aqueous potassium-ion batteries[J]. Electrochemistry Communications, 2017, 77: 54-57. [24] HE G, NAZAR L F. Crystallite size control of prussian white analogues for nonaqueous potassium-ion batteries[J]. ACS Energy Letters, 2017, 2(5): 1122-1127. [25] LI X, CHENG F, GUO B, et al. Template-synthesized LiCoO2, LiMn2O4, and LiNi0.8Co0.2O2nanotubes as the cathode materials of lithium ion batteries[J]. the Journal of Physical Chemistry B, 2005, 109(29): 14017-14024. [26] MYUNG S T, KUMAGAI N, KOMABA S, et al. Effects of Al doping on the microstructure of LiCoO2cathode materials[J]. Solid State Ionics, 2001, 139(1): 47-56. [27] PENG Z S, WAN C R, JIANG C Y. Synthesis by sol–gel process and characterization of LiCoO2cathode materials[J]. Journal of Power Sources, 1998, 72(2): 215-220. [28] BILLAUD J, CLÉMENT R J, ARMSTRONG A R, et al. β-NaMnO2: a high-performance cathode for sodium-ion batteries[J]. Journal of the American Chemical Society, 2014, 136(49): 17243-17248. [29] SU D, WANG C, AHN H, et al. Single crystalline Na0.7MnO2nanoplates as cathode materials for sodium-ion batteries with enhanced performance[J]. Chemistry-A European Journal, 2013, 19(33): 10884-10889. [30] KOMABA S, YABUUCHI N, NAKAYAMA T, et al. Study on the reversible electrode reaction of Na1–xNi0.5Mn0.5O2for a rechargeable sodium-ion battery[J]. Inorganic Chemistry, 2012, 51(11): 6211-6220. [31] FOUASSIER C, DELMAS C, HAGENMULLER P, Evolution structurale et proprietes physiques des phases AMO2(A= Na, K; M= Cr, Mn, Co)(≤1)[J]. Materials Research Bulletin, 1975, 10(6): 443-449. [32] HIRONAKA Y, KUBOTA K, KOMABA S. P2-and P3-KCoO2as an electrochemical potassium intercalation host[J]. Chemical Communications, 2017, 53(26): 3693-3696. [33] KIM H, KIM J C, BO S H, et al. K-ion batteries based on a P2‐type K0.6CoO2cathode[J]. Advanced Energy Materials, 2017, doi: 10.1002/aenm.201700098. [34] VAALMA C, GIFFIN G A, BUCHHOLZ D, et al. Non-aqueous K-ion battery based on layered K0.3MnO2and hard carbon/carbon black[J]. Journal of the Electrochemical Society, 2016, 163(7): A1295-A1299. [35] LIU C, LUO S, HUANG H, et al. K0.67Ni0.17Co0.17Mn0.66O2: A cathode material for potassium-ion battery[J]. Electrochemistry Communications, 2017, 82: 150-154. [36] WANG X, XU X, NIU C, et al. Earth abundant Fe/Mn-based layered oxide interconnected nanowires for advanced K-ion full batteries[J]. Nano Letters, 2016, 17(1): 544-550. [37] MASQUELIER C, CROGUENNEC L. Polyanionic (phosphates, silicates, sulfates) frameworks as electrode materials for rechargeable Li (or Na) batteries[J]. Chemical Reviews, 2013, 113(8): 6552-6591. [38] BO S H, WANG F, JANSSEN Y, et al. Degradation and (de) lithiation processes in the high capacity battery material LiFeBO3[J]. Journal of Materials Chemistry, 2012, 22(18): 8799-8809. [39] REYNAUD M, ATI M, MELOT B C, et al. Li2Fe(SO4)2as a 3.83V positive electrode material[J]. Electrochemistry communications, 2012, 21: 77-80. [40] JIAN Z, ZHAO L, PAN H, et al. Carbon coated Na3V2(PO4)3as novel electrode material for sodium ion batteries[J]. Electrochemistry Communications, 2012, 14(1): 86-89. [41] ZHU C, SONG K, VAN AKEN P A, et al. Carbon-coated Na3V2(PO4)3embedded in porous carbon matrix: An ultrafast Na-storage cathode with the potential of outperforming Li cathodes[J]. Nano Letters, 2014, 14(4): 2175-2180. [42] HAN J, LI G N, LIU F, et al. Investigation of K3V2(PO4)3/C nanocomposites as high-potential cathode materials for potassium-ion batteries[J]. Chemical Communications, 2017, 53(11): 1805-1808. [43] CHIHARA K, KATOGI A, KUBOTA K, et al. KVPO4F and KVOPO4toward 4 volt-class potassium-ion batteries[J]. Chemical Communications, 2017, 53(37): 5208-5211. [44] RECHAM N, ROUSSE G, SOUGRATI M T, et al. Preparation and characterization of a stable FeSO4F-based framework for alkali ion insertion electrodes[J]. Chemistry of Materials, 2012, 24(22): 4363-4370. [45] XING Z, JIAN Z, LUO W, et al. A perylene anhydride crystal as a reversible electrode for K-ion batteries[J]. Energy Storage Materials, 2016, 2: 63-68. [46] CHEN Y, LUO W, CARTER M, et al. Organic electrode for non-aqueous potassium-ion batteries[J]. Nano Energy, 2015, 18: 205-211. [47] JIAN Z, LIANG Y, RODRÍGUEZ-PÉREZ I A, et al. Poly (anthraquinonyl sulfide) cathode for potassium-ion batteries[J]. Electrochemistry Communications, 2016, 71: 5-8. [48] GE P, FOULETIER M. Electrochemical intercalation of sodium in graphite[J]. Solid State Ionics, 1988, 28: 1172-1175. [49] DRESSELHAUS M S, DRESSELHAUS G. Intercalation compounds of graphite[J]. Advances in Physics, 1981, 30(2): 139-326. [50] ZHAO J, ZOU X, ZHU Y, et al. Electrochemical intercalation of potassium into graphite[J]. Advanced Functional Materials, 2016, 26(44): 8103-8110. [51] ZHANG W, JIANG X, WANG X, et al. Spontaneous weaving of graphitic carbon networks synthesized by pyrolysis of ZIF-67 crystals[J]. Angewandte Chemie International Edition, 2017, 129(29):8435. [52] ZHAO X, XIONG P, MENG J, et al. High rate and long cycle life porous carbon nanofiber paper anodes for potassium-ion batteries[J]. Journal of Materials Chemistry A, 2017, 5(36): 19237-19244. [53] SHARE K, COHN A P, CARTER R, et al. Role of nitrogen-doped graphene for improved high-capacity potassium ion battery anodes[J]. ACS Nano, 2016, 10(10): 9738-9744. [54] GONG S, WANG Q. Boron-doped graphene as a promising anode material for potassium-ion batteries with a large capacity, high rate performance, and good cycling stability[J]. the Journal of Physical Chemistry C, 2017, 121(44): 24418-24424. [55] JU Z, ZHANG S, XING Z, et al. Direct synthesis of few-layer F-doped graphene foam and its lithium/potassium storage properties[J]. ACS Applied Materials & Interfaces, 2016, 8(32): 20682-20690. [56] MA G, HUANG K, MA J S, et al. Phosphorus and oxygen dual-doped graphene as superior anode material for room-temperature potassium-ion batteries[J]. Journal of Materials Chemistry A, 2017, 5(17): 7854-7861. [57] ADAMS R A, SYU J M, ZHAO Y, et al. Binder-free N-and O-rich carbon nanofiber anodes for long cycle life K-ion batteries[J]. ACS Applied Materials & Interfaces, 2017. 9(21): 17872-17881. [58] JIAN Z, XING Z, BOMMIER C, et al. Hard carbon microspheres: potassium-ion anode versus sodium-ion anode[J]. Advanced Energy Materials, 2016, 6(3):doi: 10.1002/aenm-201501874. [59] WEN Y, HE K, ZHU Y, et al. Expanded graphite as superior anode for sodium-ion batteries[J]. Nature Communications, 2014, 5: 4033. [60] BOMMIER C, JI X. Recent development on anodes for Na-ion batteries[J]. Israel Journal of Chemistry, 2015, 55(5): 486-507. [61] HAN J, XU M, NIU Y, et al. Exploration of K2Ti8O17as an anode material for potassium-ion batteries[J]. Chemical Communications, 2016, 52(75): 11274-11276. [62] KISHORE B, VENKATESH G, MUNICHANDRAIAH N. K2Ti4O9: A promising anode material for potassium ion batteries[J]. Journal of The Electrochemical Society, 2016, 163(13): A2551-A2554. [63] HAN J, NIU Y, BAO S, et al. Nanocubic KTi2(PO4)3electrodes for potassium-ion batteries[J]. Chemical Communications, 2016, 52(78): 11661-11664. [64] ER D, LI J, NAGUIB M, et al. Ti3C2MXene as a high capacity electrode material for metal (Li, Na, K, Ca) ion batteries[J]. Acs Applied Materials & Interfaces, 2014, 6(14): 11173-11179. [65] LIAN P, DONG Y, WU Z S, et al. Alkalized Ti3C2MXene nanoribbons with expanded interlayer spacing for high-capacity sodium and potassium ion batteries[J]. Nano Energy, 2017, 40: 1-8. [66] NAGUIB M, ADAMS R A, ZHAO Y, et al. Electrochemical performance of mxenes as K-ion battery anodes[J]. Chemical Communications, 2017, 53(51) 6883. [67] SANGSTER J, PELTON A D. The K-Sb (potassium-antimony) system[J]. Journal of Phase Equilibria, 1993, 14(4): 510-514. [68] SONGSTER J, PELTON A D. The Na-Sb (sodium-antimony) system[J]. Journal of Phase Equilibria, 1993, 14(2): 250-255. [69] MCCULLOCH W D, REN X, YU M, et al. Potassium-ion oxygen battery based on a high capacity antimony anode[J]. ACS Applied Materials & Interfaces, 2015, 7(47): 26158-26166. [70] SULTANA I, RAMIREDDY T, RAHMAN M M, et al. Tin-based composite anodes for potassium-ion batteries[J]. Chemical Communications, 2016, 52(59): 9279-9282. [71] WANG Q, ZHAO X, NI C, et al. Reaction and capacity fading mechanisms of tin nanoparticles in potassium-ion batteries[J]. the Journal of Physical Chemistry C, 2017,121(23):12652-12657. [72] ZHANG W, MAO J, LI S, et al. Phosphorus-based alloy materials for advanced potassium-ion battery anode[J]. Journal of the American Chemical Society, 2017, 139(9): 3316-3319. [73] SANGSTER J M. KP (potassium-phosphorus) system[J]. Journal of Phase Equilibria and Diffusion, 2010, 31(1): 68-72. [74] SULTANA I, RAHMAN M M, RAMIREDDY T, et al. High capacity potassium-ion battery anodes based on black phosphorus[J]. Journal of Materials Chemistry A, 2017, 5(45): 23506-23512. [75] HU Z, ZHOU C, RAMANUJAM P R, et al. Rapid reversible electromigration of intercalated K ions within individual MoO3nanobundle[J]. Journal of Applied Physics, 2013, 113(2): 024311. [76] SULTANA I, RAHMAN M M, MATETI S, et al. K-ion and Na-ion storage performances of Co3O4-Fe2O3nanoparticle-decorated super P carbon black prepared by a ball milling process[J]. Nanoscale, 2017, 9(10): 3646-3654. [77] REN X, ZHAO Q, MCCULLOCH W D, et al. MoS2as a long-life host material for potassium ion intercalation[J]. Nano Research, 2017, 10(4): 1313-1321. [78] LAKSHMI V, CHEN Y, MIKHAYLOV A A, et al. Nanocrystalline SnS2coated onto reduced graphene oxide: Demonstrating feasibility of a non-graphitic anode with sulfide chemistry for potassium-ion batteries[J]. Chemical Communications, 2017, 53(59): 8272. [79] DENG Q, PEI J, FAN C, et al. Potassium salts of para-aromatic dicarboxylates as the highly efficient organic anodes for low-cost K-ion batteries[J]. Nano Energy, 2017, 33: 350-355. [80] LEI K, LI F, MU C, et al. High K-storage performance based on the synergy of dipotassium terephthalate and ether-based electrolytes[J]. Energy & Environmental Science, 2017, 10(2): 552-557. [81] BIE X, KUBOTA K, HOSAKA T, et al. A novel K-ion battery: Hexacyanoferrate (II)/graphite cell[J]. Journal of Materials Chemistry A, 2017, 5(9): 4325-4330. Research on key materials for potassium ion batteries LI Wenting1,2,3, AN Shengli2,3,4, QIU Xinping1 (1Key Laboratory of Organic Optoelectronics and Molecular Engineering, Department of Chemistry, Tsinghua University, Beijing 100084, China;2School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing, Beijing 100083, China;3School of Material and Metallurgy, Inner Mongolia University of Science and Technology, Baotou 014010, Inner Mongolia, China;4Ordos Insititute of Technology, Ordos 017000, Inner Mongolia, China) Potassium ion batteries can meet the requirements of energy storage system owing to their advantages of low cost, long life and high energy density, since potassium is the element with abundant resource, low price and low electrochemical potential. However, challenges coming from disadvantages of larger and heavier of potassium ion still confront of the development of electrode materials and electrolyte for potassium ion batteries. In recent years, the high capacity electrode materials and electrolyte of potassium ion batteries have been studied extensively under the traction of electric vehicles and energy storage applications. The cathode materials such as Prussian blue and its analogues, transition metal oxides and polyanionic materials show the application prospect. Available anode materials consist of carbon, titanium and alloy materials. Effective electrolytes involve ester-based electrolytes and ether-based electrolytes. These results are significant for the basic and applied research of potassium ion batteries. potassium ion batteries; cathode; anode; electrolyte 10.12028/j.issn.2095-4239.2018.0018 TK 02 A 2095-4239(2018)03-0365-11 2018-02-03; 2018-03-21。 国家重点研发计划项目(2016YFB0901703)。 李文挺(1990—),男,博士研究生,主要研究方向为钾离子电池功能材料,E-mail:liwenting@mail.tsinghua.edu.cn; 邱新平,教授,主要从事锂离子电池、直接醇燃料电池及储能电堆为主的先进化学电源的基础及应用研究,E-mail:qiuxp@mail.tsinghua. edu.cn。

1 钾离子电池正极材料
1.1 普鲁士蓝及其类似物正极材料
1.2 过渡金属氧化物正极材料KxMO2
1.3 聚阴离子正极材料
1.4 其它正极材料
2 钾离子电池负极材料
2.1 碳基负极材料
2.2 钛基负极材料
2.3 合金类负极材料
2.4 其它负极材料
3 电解质材料
4 结 语
