黄芪总苷对阿霉素诱导损伤足细胞的保护作用*
2018-05-05宋元春赛依帕
宋元春,赛依帕,高 霞,罗 璇
甘肃省人民医院儿科,甘肃 兰州 730000
黄芪总苷(total astragalus glycosides,AST)是中药黄芪有效提取成分之一,已有研究[1-4]表明黄芪总苷具有抗氧化、抗衰老、抗肿瘤、抗病毒、消炎镇痛、减轻心脑组织缺血再灌注损伤等多种药理作用。
足细胞即肾小球脏层上皮细胞,具有抵抗肾小球内压力、合成基底膜完整的各种成分和血管内皮生长因子,能维持肾小球毛细血管袢的空间结构及肾小球内皮细胞的功能完整性等功能[5]。足细胞是参与各种原发性或继发性肾小球疾病进展的关键细胞,其损伤是各种肾脏疾病进行性病变的基本特征[6]。
课题组前期研究采用阿霉素(ADR)对体外培养的足细胞进行模型构建,同时以黄芪总苷溶液对ADR诱导的足细胞损伤进行干预,发现黄芪总苷可维持ADR损伤的MPC5足细胞内氧化应激环境的平衡、改善迁移能力、抑制细胞骨架重排与破坏及抑制细胞凋亡,从而发挥对损伤的MPC5足细胞的保护作用。但是其保护作用的具体分子机制尚不明确。因此,本实验同样采用ADR构建体外足细胞损伤模型并经不同浓度的黄芪总苷处理,观察黄芪总苷对足细胞中基质金属蛋白酶(MMPs)和凋亡相关蛋白表达的影响,探讨黄芪总苷发挥保护作用的潜在分子机制。
1 材料与方法
1.1 主要材料与试剂 小鼠足细胞系(mouse podocyte clone 5,MPC5)购于美国 CHI Scientific公司;胎牛血清(美国Hyclone公司);培养基(美国Gibco公司);盐酸阿霉素(武汉鑫伟烨化工有限公司,注册证号:H20130186);黄芪总苷(上海晶都生物技术有限公司,纯度≥98%);Bax、Bcl-2、GAPDH、MT1、Nephrin 抗体及二抗(英国 Abcam 公司);BCA蛋白定量试剂盒(北京康为世纪生物科技有限公司);ELISA试剂盒(上海酶联生物技术有限公司)。
1.2 实验方法
1.2.1 足细胞的培养 将冻存的足细胞复苏后,置于含10%胎牛血清的低糖DMEM培养基中,于5%CO2、37℃的饱和湿度培养箱内培养,待细胞融合至70%左右进行传代,分组处理。
1.2.2 实验分组 将MPC5足细胞分为空白对照组(完全培养基)、ADR 损伤组(ADR 0.5 μmol/L)、低浓度黄芪总苷治疗组(ADR 0.5 μmol/L+黄芪总苷50 μg/mL)、中浓度黄芪总苷治疗组(ADR 0.5 μmol/L+黄芪总苷100μg/mL)及高浓度黄芪总苷治疗组(ADR 0.5μmol/L+黄芪总苷200μg/mL)。各组分别处理24小时后进行实验。
1.2.3 蛋白质印迹法(Western blot) 使用RIPA裂解液提取各组细胞总蛋白并对蛋白质进行定量,每孔60 μg上样,随后进行聚丙烯酰胺凝胶电泳,结束后将凝胶上的蛋白转至PVDF膜,封闭1~2小时,按1∶1 000比例加入相应兔抗小鼠多克隆抗体 Bcl-2、Bax、P53、MT1 及 Nephrin,4℃孵育24小时,用TBST洗1次,加入HRP标记的二抗(1∶5000),室温孵育2小时,TBST洗膜3次,5 min/ 次,最后采用ECL化学发光法及凝胶成像仪进行曝光,采用quantity one软件测定蛋白灰度。
1.2.4 酶联免疫吸附法(ELISA)检测MMP-2和MMP-9 具体步骤严格按ELISA试剂盒说明书进行。
1.3 统计学方法 数据采用SPSS 20.0软件进行统计分析,计量资料以(±s)表示,采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 黄芪总苷对ADR诱导的损伤足细胞MMPs蛋白质表达水平的影响 ADR可显著下调MMP-2和MMP-9蛋白质表达水平(P<0.05);低、中、高浓度黄芪总苷均可上调ADR损伤组MMP-2和MMP-9蛋白质表达水平(P<0.05),见表1。
表1 各组足细胞MMP-2、MMP-9相对表达水平(±s) ng/mL
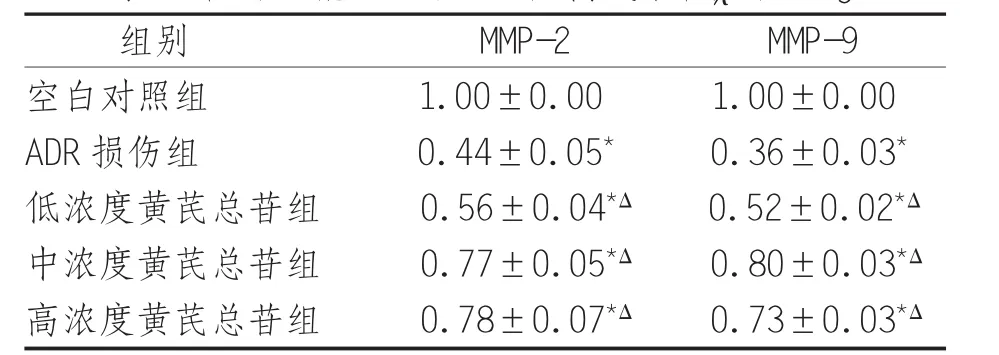
表1 各组足细胞MMP-2、MMP-9相对表达水平(±s) ng/mL
注:*表示与空白对照组比较,P<0.05;△表示与ADR损伤组比较,P<0.05
组别 M M P-2 M M P-9空白对照组 1.0 0±0.0 0 1.0 0±0.0 0 A D R损伤组 0.4 4±0.0 5* 0.3 6±0.0 3*低浓度黄芪总苷组 0.5 6±0.0 4*Δ 0.5 2±0.0 2*Δ中浓度黄芪总苷组 0.7 7±0.0 5*Δ 0.8 0±0.0 3*Δ高浓度黄芪总苷组 0.7 8±0.0 7*Δ 0.7 3±0.0 3*Δ
2.2 黄芪总苷对ADR诱导的损伤足细胞MT1、Nephrin及凋亡相关蛋白表达水平的影响 与空白对照组相比,ADR可显著上调P53、Bax的表达水平(P<0.05),下调 Bcl-2、MT1、Nephrin 蛋白表达水平(P<0.05);与ADR损伤组相比,低浓度黄芪总苷组MPC5足细胞Bcl-2及MT1蛋白表达水平上调(P<0.05),而Bax、p53及Nephrin表达水平无明显变化(P>0.05);与ADR损伤组比较,中、高浓度黄芪总苷干预的足细胞内Bax表达量明显下降,Bcl-2、MT1表达量有所升高,中浓度黄芪总苷干预的足细胞内Nephrin表达量有所上调,中、高浓度黄芪总苷干预的足细胞内p53表达量均有所降低(P<0.05),见表 2,图 1。
表2 各组足细胞相关蛋白相对表达量(±s)

表2 各组足细胞相关蛋白相对表达量(±s)
注:*表示与空白对照组比较,P<0.05;△表示与ADR损伤组比较,P<0.05
组别 B a x B c l-2 M T 1 N e p h r i n p 5 3空白对照组 1.0 0±0.0 0 1.0 0±0.0 0 1.0 0±0.0 0 1.0 0±0.0 0 1.0 0±0.0 0 A D R损伤组 1.4 0±0.0 9* 0.5 1±0.0 3* 0.4 0±0.0 6* 0.6 2±0.0 1* 2.3 9±0.2 9*低浓度黄芪总苷组 1.4 2±0.1 0* 0.7 3±0.0 4*Δ 0.6 0±0.1 3*Δ 0.6 5±0.0 5* 2.3 0±0.1 6*中浓度黄芪总苷组 1.1 7±0.1 8 Δ 0.8±0.0 9*Δ 1.0 5±0.1 8 Δ 0.7 2±0.0 5*Δ 1.1 9±0.1 7 Δ高浓度黄芪总苷组 1.1 8±0.0 8 Δ 1.0 3±0.0 3 Δ 0.8 5±0.1 2 Δ 0.6 2±0.0 1* 1.4 8±0.2 4*Δ

图1 各组足细胞相关蛋白表达水平
3 讨论
MMPs是一组同源的锌、钙依赖性内肽酶,主要分为6大类,MMP-2、MMP-9属于Ⅳ型胶原酶/明胶酶类[7]。在生理情况下,足细胞可分泌Ⅳ型胶原补充到肾小球基底膜上,维持多形性胶质母细胞(GBM)的正常新陈代谢。病理量的MMP-2、MMP-9会降解Ⅳ型胶原,不利于足细胞的黏附,继而破坏GBM的完整性,促使肾间质纤维化[8-9]。我们前期研究结果表明ADR能严重破坏足细胞的细胞核及细胞骨架结构的完整性,还可增加足细胞迁移性能。这些改变不但可导致足细胞足突消失、细胞表型改变,还可诱导足细胞凋亡,并且足细胞从稳定型转为迁移型,最终导致足细胞脱落,破坏基底膜的完整性[10-11]。有研究[12-13]报道,ADR 对足细胞迁移能力的促进及细胞损伤可能与MMP-2、MMP-9的异常表达存在密切关系。本研究采用ELISA法检测了各组MMP-2、MMP-9的表达水平,结果显示,ADR可显著降低MMP-2、MMP-9的表达水平,而黄芪总苷可上调MMP-2、MMP-9的表达水平。因此,黄芪总苷对ADR损伤的足细胞增殖能力及迁移能力的保护作用可能与改善MMP-2、MMP-9的异常表达有关。
p53可调节各种基因的表达,包括细胞凋亡,生长抑制及抑制细胞周期进程,分化和加速DNA修复等[14-15]。细胞凋亡途径目前已公认的有3条:线粒体通路、死亡受体通路和内质网通路,其中前两条凋亡通路均有p53蛋白的参与[16]。ADR诱导损伤足细胞p53蛋白表达水平显著上调,黄芪总苷干预后p53表达水平有所下调,以100 μg/mL效果最佳。黄芪总苷对ADR诱导的损伤足细胞的保护作用极有可能与p53信号通路有关。ADR诱导的损伤足细胞促凋亡基因Bax和抗凋亡基因Bcl-2 蛋白表达水平明显改变,100、200 μg/mL 浓度黄芪总苷对损伤足细胞Bax的上调和Bcl-2下调有显著的抵御作用,提示黄芪总苷可能有抑制足细胞损伤加重及凋亡的作用。Nephrin表达的变化是足细胞损伤的主要标志物之一。有研究[17]证实,在阿霉素肾病大鼠模型中,Nephrin表达下调是蛋白尿产生的主要机制。本研究中100 μg/mL浓度黄芪总苷干预的足细胞nephrin表达较模型组上调。MT-1是足细胞特异表达的蛋白之一,对评价足细胞的活力和完整性有重要意义,在近端小管的表达强度明显高于远端小管和集合管[18]。本研究中MT-1表达水平在ADR诱导的损伤足细胞中显著下调,而在100 μg/mL浓度的黄芪总苷干预的足细胞内有所上调。
综上所述,黄芪总苷对ADR损伤的MPC5足细胞具有保护作用,这可能与黄芪总苷可以下调ADR损伤足细胞Bax、p53蛋白表达水平并上调MMP-2、MMP-9、MT1及Nephrin等蛋白表达水平有关。
[1]朱芬芳,李卫平,尹艳艳,等.黄芪总苷对缺氧/复氧诱导损伤细胞外信号调节蛋白激酶的影响[J].安徽医科大学学报,2009,44(4):471-475.
[2]张文,李维祖,李卫平,等.黄芪总苷防治地塞米松诱导小鼠记忆障碍和对APP及β-分泌酶mRNA表达的研究[J].中国中药杂志,2010,35(3):642-646.
[3]邹宇宏,杨雁,吴强,等.黄芪提取物的体外抗乙肝病毒作用[J].安徽医科大学学报,2003,38(4):267-269.
[4]黄小平,谭华,陈北阳,等.黄芪总苷和三七总皂苷配伍对脑缺血再灌注后MMP-1和TIMP-1表达的影响[J].中国中药杂志,2010,35(16):2187-2191.
[5]洪亦眉,陈朝红.足细胞损伤的病因和发病机制[J].肾脏病与透析肾移植杂志,2009,18(1):63-69.
[6]Shankl and SJ.Thepodocyte′sresponse toinjury:role in proteinuria and glomerulosclerosis[J].Kidney international,2006,69(12):2131-2147.
[7]Toth M,Chvyrkova I,Bernardo MM,et al.Pro-MMP-9 activation by the MT1-MMP/MMP-2 axis and MMP-3:role of TIMP-2 and plasma membranes[J].Biochem Biophys Res Commun,2003,308(2):386-395.
[8]Ahmad H,Bani-Hani,Matthew T.Cytokines in epithelial mesenchymal transition:a new insight into obstructive nephropathy[J].The Journal of Urology,2008,180(2):461-468.
[9]Lutz J,Yao Y,Song E,et al.Inhibition of matrix metall oproteinases during chronic allograft nephropathy in rats[J].Transplantation,2005,79(6):655-661.
[10]AsanumaK,Yanagida-AsanumaE,FaulC,etal.Synaptopodin orchestratesactin organization and cell motility via regulation of RhoA signaling[J].Nat Cell Biol,2006,8(5):485-491.
[11]Asanuma K,Kim K,Oh J,et al.Synaptopodin regulates the actin-bundling activity of alpha-actinin in an isoform-specific manner[J].J Clin Invest,2005,115(5):1188-1198.
[12]Merkle M,Ribeiro A,K¨ppelS,et al.TNF-α enhances TLR3-dependent effects on MMP-9 expression in human mesangial cells[J].Cell Biol Int,2012,36(12):1155-1160.
[13]Dong FQ,Li H,Wu F,et al.Effects of overexpression of decorin on matrix metalloproteinases 2 and 9 in rat mesangial and tubular cells[J].Zhonghua Yi Xue Za Zhi,2008,88(48):3444-3447.
[14]李开龙,陈林.p53在肾脏缺血再灌注损伤发生机制中的作用[J].国外医学:泌尿系统分册,2005,25(2):241-246.
[15]Ben-Porath I,Weinberg RA.The signals and pathways activating cellular senescene[J].Int J Biochem Cell Biol,2005,37(5):961-976.
[16]Morton JP,Kantidakis T,White RJ.RNA polymerase Ⅲtranscription is repressed in response to the tumour suppressor ARF[J].Nucleic acids Res,2007,35(9):3046-3052.
[17]Kato T,Mizuno S,Kamimoto M.The decreases of nephfin and nuclear WTl in podoeytes may cause albuminuria during the experimentalsepsis in mice[J].Biomed Res,2010,31(6):363-369.
[18]Wolff NA,Lee WK,Thévenod F.Role of Arf1 in endosomal trafficking of protein metal complexes and cadmium-metallothionein-1toxicityin kidney proximal tubule cells[J].Toxicol Lett,2011,203(3):210-218.
