颌骨骨化纤维瘤合并动脉瘤样骨囊肿的临床和影像学特征
2018-05-04朱文静张春叶王韶颖石慧敏
朱文静, 张春叶, 王韶颖, 石慧敏
骨化纤维瘤(Ossifying fibroma,OF)是由富于细胞的纤维组织和表现多样的矿化组织构成的良性纤维性骨肿瘤[1]。在2005年WHO头颈部肿瘤分类中将OF分为传统经典型(conventional OF,COF)和青少年型(juvenile OF,JOF),后者又分为青少年砂瘤型(juvenile psammomatoid OF,JPOF)和青少年小梁型(juvenile trabecular OF,JTOF)[2]。动脉瘤样骨囊肿(aneurysmal bone cyst,ABC)是一种良性肿瘤样骨病,由充满血液的大小不等的囊腔和结缔组织间隔组成,主要发生于长骨和脊柱[3-5],只有3%的ABC发生在头颈部区域,下颌骨是最常见的部位[6]。ABC可分为原发性和继发性,后者可继发于其它良性或恶性骨骼病变。目前国内外所有关于颌骨OF继发ABC的文献报道中受累病例数仅二十多例[7-13],非常少见。笔者搜集经病理证实的16例颌骨OF合并ABC患者的病例资料,回顾性分析其临床表现、影像特征和病理分型,旨在提高临床医师和放射科医师对这一复杂病变的认识。
材料与方法
1.病例资料
1996年1月~2017年6月本院经手术病理证实的颌骨骨化纤维瘤合并动脉瘤样骨囊肿患者共16例。合并动脉瘤样骨囊肿的病理诊断标准:病变伴有囊性变,囊腔内含有血液,囊壁可见多核巨细胞,可伴或不伴有反应性骨组织。记录所有患者的临床资料,包括年龄、性别、病程、症状、手术记录和预后等信息。
2.影像学检查
①X线全景片检查:使用Orthophos XG 3D Ceph X线机,60~90 kV,3~16 mA。②CT检查:使用Philips Brilliance 64排或GE LightSpeed 16排螺旋CT机,扫描参数:层厚5 mm,120 kV,50 mA,矩阵512×512,增强扫描对比剂为碘佛醇,剂量70~80 mL,注射流率2.5 mL/s;随后采用1.25 mm层厚进行薄层重建。③MRI检查:使用GE Signa TwinSpeed 1.5T磁共振扫描仪和头颈联合表面线圈,扫描序列和参数如下。①横轴面FRFSE T2WI:TR 4020~4820 ms,TE 84.8 ms,激励次数3;②FSE T1WI:TR 400~600 ms,TE 8.0~9.9 ms,激励次数2,层厚5 mm,层距1 mm,视野24 cm×18 cm,矩阵228×192;③横轴面和冠状面对比增强T1WI,对比剂为马根维显(Magnevist),剂量0.1 mmol/kg。
3.图像分析方法
由2位放射科医师分析患者的影像学资料,主要观察内容包括病变部位、大小、有无膨胀、内部密度或信号、强化方式、边界、骨皮质穿孔和牙根改变等。本组16例术前均行CT检查,其中6例行CT增强扫描,14例行X线全景片检查,3例行MRI检查。术后随访以患者最后一次影像检查确认有无复发。
结 果
1.临床表现及发病部位
16例中男4例,女12例;发病年龄11~52岁,平均(29.3±12.0)岁。患者术前病程3个月~7年,平均32个月。最常见的初发症状是颌骨缓慢生长的无痛性肿块(16例,100%),其它表现包括鼻塞5例(31.3%)、下唇麻木2例(12.5%)和酸胀感1例(6%)。3例在外院诊断为术后复发的患者,临床表现为近期肿瘤增大,1例伴下唇麻木。查体:肿块质地偏硬,无活动度,可有乒乓球样感(4例,25%)、压痛(2例,12.5%)及叩痛(1例,6%)。病变发生于下颌骨9例、上颌骨7例,其中累及上颌窦6例、累及鼻腔5例。
2.影像学表现
所有病例可见病变骨呈膨胀性改变,与周围正常组织之间分界清楚,邻近软组织无受累,病变最大截面积23 mm×12 mm~95 mm×79 mm,平均47 mm×36 mm。14例的全景X线片显示病变区正常骨质结构破坏,7例(7/14,50%)表现为低密度、其中1例出现液-液平,6例为混合密度(6/14,42.9%),1例表现为高密度(1/14,7.1%)。
16例CT平扫示病变内均可见囊性低密度区,CT值-3~18 HU;其中3例有液-液平(图1a),下层呈高密度影,CT值78~102 HU。14例(14/16)呈多房囊性结构,可见纤维或骨性分隔,其中8例有磨玻璃影(图1b、2b),CT值345~578 HU,且有1例伴散在钙化;6例无磨玻璃影且有2例伴散在钙化(图3a~b)。2例(2/16)表现为无分房的低密度影伴磨玻璃样改变,两种密度的病灶之间分界较清楚。病灶内部的征象中最常见的依次为囊性密度(16/16,100%)、分隔(14/16,87.5%)、磨玻璃影(10/16,62.5%)、散在钙化(3/16,18.8%)和液-液平(3/16,18.8%)。6例病变的边缘骨质不连续(6/16,37.5%)。6例行增强扫描,其中5例显示病灶内部的分隔明显强化及边缘强化,1例无明显强化。
结合X线全景片和CT检查,发现10例患者有牙根移位(10/16,62.5%),9例牙根吸收(9/16,56.3%),2例病变内含埋伏牙(2/16,7.7%)。
3例行MRI检查,病变在T1WI上呈低~等或稍高信号,T2WI上病灶内的囊性成分呈明显高信号,纤维分隔及骨性成分呈低信号。1例病变内可见多个液-液平,且增强后分隔及边缘呈明显强化(图1c~e)。
3.组织病理学表现
16例OF合并ABC 患者中,14例为COF合并ABC,2例为JOF合并ABC(其中1例确诊为JPOF)。肿瘤大体标本检查:灰白色境界清晰的肿块,切面呈砂砾样,病灶内可见囊性区,其内含暗红色血块样物。镜下表现:COF表现为细胞丰富的纤维组织背景中可见不同成分的矿化组织,矿化组织为牙骨质样或骨样组织(图1f);JPOF的表现与COF相似,但矿化组织主要为类似骨小体的小骨块(图2d);ABC区表现为飘带样的纤维囊壁样组织,内含小块骨组织和多核巨细胞(图3d)。
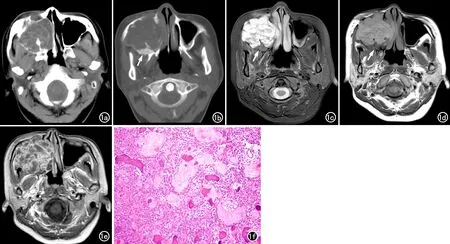
图1 右上颌骨COF合并ABC。a) CT软组织窗显示病变呈多囊状、膨胀性改变,其内有多个液-液平; b) CT骨窗显示病变后缘可见小片状磨玻璃样影(箭); c) T2W压脂像示病变为多囊状,囊液呈不均匀高信号,病灶内可见多个液-液平,病变后缘可见小片状低信号影(箭); d) T1WI示病变呈多囊状稍高信号改变,可见液-液平,其后缘可见小片状低信号影(箭); e) 增强扫描T1WI示病变内分隔及边缘有较明显强化; f) 镜下示COF区由纤维组织和矿化组织所构成(×100,HE)。

图2 左上颌骨JPOF合并ABC。a) X线片示病变以低密度为主(短箭),上缘呈高密度(长箭); b) 冠状面CT骨窗,显示病变上缘可见片状磨玻璃样影(箭); c) 冠状面CT软组织窗,显示多囊低密度为主的类圆形病灶,边界清晰,可见分隔(箭); d) 镜下示JPOF区由纤维组织和沙瘤样的骨小体组成(×100,HE)。图3 右下颌升支COF合并ABC。a) CT骨窗示病变呈膨胀性改变(箭),边缘骨质变薄、欠连续; b) CT软组织窗示病变内可见多发斑点片状钙化灶(箭); c) CT三位重组图像,显示右侧下颌骨呈膨胀性改变; d) 镜下示囊性变、出血区为ABC的特点,且可见多核巨细胞(×100,HE)。
4.手术及随访
所有病例均接受手术治疗,手术方式主要为刮除术9例,其中3例伴修复重建;完全切除术7例,其中5例行修复重建。1例局部刮治术为带瘤生存;3例在外院的初次手术选择保守方式(1例开窗术,2例修整术),术后出现复发,再行根治手术及修复。所有患者进行了术后随访,随访时间1~84个月,平均49个月;至末次随访时,15例患者无肿瘤复发证据,1例为带瘤生存。
讨 论
2005年WHO头颈部肿瘤分类中将牙骨质骨化纤维瘤重新命名为骨化纤维瘤并分为三大类型:经典型骨化纤维瘤(COF),青少年小梁状骨化纤维瘤(JTOF)和青少年砂瘤样骨化纤维瘤(JPOF)[2]。该肿瘤属于良性纤维性骨病变的一种,肿瘤组织具有向骨质和纤维组织双向分化的特点,临床上较少见,约占良性骨肿瘤的4.38%[14],而合并动脉瘤样骨囊肿(ABC)的病例则更少见。Yang等[10]追踪了438例副鼻窦骨化纤维瘤的患者,其中15例(3.42%)继发ABC。ABC因囊内壁无上皮细胞覆盖,曾被认为是反应性病变,且与外伤有关,但现在已被证明与USP6基因重排相关,具有肿瘤性质[15,16]。病理上如发现ABC以外的原发疾病,则诊断为继发性ABC,约占所有ABC的30%~50%[10,17]。在骨化纤维瘤的病例中,发生继发性ABC的情况是很少见的,相关的论著也非常少见,多数为个案报道。
骨化纤维瘤常发生于20~40岁的青年人,传统型OF的发病年龄约为35岁,女性多见[2,18];而青少年型发病年龄相对年轻,通常小于15岁[19]。本组病例发病年龄11~52岁,平均29岁,两例JOF的发病年龄分别为11和18岁,本组结果与以往的研究结果基本一致。ABC常发生于第二个十年,75%~90%的患者发生在20岁之前,发生于30岁以后者非常罕见[20],其发病年龄较经典型OF患者要早。本组OF合并ABC的病例显示,其发病年龄与原发疾病OF的发病年龄相一致,而不受继发性ABC的影响。
根据文献和本组16例患者的资料,OF好发于女性,本组中男女性别比例为1:3。临床上最常见的症状是无痛性肿块,偶见鼻塞、下唇麻木和眼球突出等伴发症状。OF可累及全身各部位的骨骼,其中85%累及颌面骨,尤以下颌骨常见,12%累及颅盖骨[21]。COF最常见于下颌骨,其次是上颌骨[22],JPOF最常见于副鼻窦的骨壁[19]。Su等[23]报道70%的OF发生于下颌骨,22%发生于上颌骨。本组研究中发生于下颌骨者略多于上颌骨,而后者中有85.7%(6/7)累及上颌窦及鼻腔。
OF的影像学表现较典型,表现为类圆形肿块呈膨胀性生长,边界清,CT骨窗上呈磨玻璃样高密度影,内部可有囊腔形成,有时可伴有点状更高密度钙化灶,部分病变周边可有蛋壳样骨壳形成,部分JOF可显示邻近骨皮质吸收变薄[10]。OF的MRI特征随其内部结构和成分的不同而变化,骨化及钙化成分在T1WI、T2WI上均呈低信号,增强后无强化;纤维组织成分在T1WI上呈低信号,T2WI上呈低~等或稍高信号,增强后明显强化。囊性骨化纤维瘤的分隔多粗细不均呈直线状,分房大小不等、形态不规则,与ABC的囊性分房形态不同。
ABC多表现为低密度骨质膨胀,单房或多房,呈类圆形,多房者其分房大小相似,边缘可有薄层骨壳,病灶内罕见钙化,增强后囊内间隔明显强化。由于囊腔内含有血液成分,可出现液-液平,MRI较CT和X线能更清晰地显示液-液平,在T2WI示囊腔上部呈高信号、下部呈等~低信号。液-液平是ABC的特征性征象之一,单纯的OF病灶通常无此特征。
本组16例患者的病变骨均呈膨胀性改变,边界清,根据病变内是否具有典型OF和ABC的密度或信号改变,笔者将其分为三种类型:典型OF合并ABC型(9/16)、OF为主型(3/16)和ABC为主型(4/16)。将钙化、磨玻璃影视为OF的特征性表现,将类圆形多房囊性及液-液平视为ABC的特征性表现。9例CT上显示磨玻璃影或钙化影,可支持OF的诊断;此外,该9例患者CT上同时具有多房囊性,分房呈类圆形、大小相似以及可有液-液平的征象,同时支持ABC的诊断,笔者将其归为典型OF合并ABC型。3例CT平扫表现为高密度磨玻璃影及斑片状低密度影,无类圆形囊性分房结构,无液-液平,故无继发性ABC的影像特征,笔者将其归为OF为主型。4例表现多房囊状低密度影,分房均匀,间隔强化,少数可见液-液平,无钙化或磨玻璃影等骨化结构,故无OF的影像特征,笔者将其归为ABC为主型。
Yang等[10]的研究结果亦显示,部分患者中继发性ABC可几乎占据整个病灶,掩盖了原发疾病OF的特征,此时原发疾病OF容易被忽视。CT可以更好地显示OF病灶中的骨化成分,而MRI可以更好地显示ABC内部的液体及出血成分,两种检查方法可互补,因此结合CT和MRI可以提高对OF合并ABC的检出率。
颌骨OF合并ABC主要应与纤维结构不良和一些牙源性肿瘤及恶性肿瘤进行鉴别[24]。当病变以OF为主时需与纤维结构不良鉴别:纤维结构不良病灶通常与周围正常骨质之间无明确分界,可以累及颅面部的多个骨骼,影像上表现为磨玻璃样影;而OF病灶与周围正常骨质的分界清晰,影像学表现各异,其内部结构根据所含软组织和骨组织成分的不同,在CT图像上可表现为低、高或混合密度,也可表现为磨玻璃样影。当病变以ABC为主且临床可扪及乒乓球样感时,需与成釉细胞瘤鉴别:前者病灶多呈类圆形,边缘多见硬化壳,囊内有时可见液-液平;而成釉细胞瘤边缘骨皮质以变薄吸收为主,边缘多见切迹,囊内无液-液平。有时OF合并ABC患者可出现下唇麻木的症状或局部侵袭性征象,如边缘骨皮质吸收中断等,尤其是JPOF,此时需与骨肉瘤尤其是毛细血管扩张性骨肉瘤、黏液表皮样癌等恶性肿瘤相鉴别,前者多无软组织肿块形成,而恶性肿瘤多见软组织侵犯及肿块形成。
颌骨OF合并ABC患者的预后是否与原发疾病的预后存在差异,目前尚无定论。本研究中有3例系术后复发患者,其中1例在接受开窗术后1个月即出现肿瘤复发,表现为肿瘤迅速增大;2例行局部修整术,分别在术后3年余和6年余出现肿瘤复发。本研究中行刮除术及切除术的患者在随访过程中均未发现复发征象。Titinchi等[25]认为OF的外科治疗方式主要取决于其临床和影像学表现,常用治疗方法为摘除术、刮治术和切除术。小病灶一般采用刮除术,更大的病变需要行手术切除术,多数研究者建议在最早阶段手术切除病变。
通过回顾性分析本组16例颌骨OF合并ABC患者的临床及影像学资料,笔者认为颌骨OF合并ABC具有较典型的临床和影像学特征,当青年人尤其是女性出现颌骨无痛性肿块、影像表现为膨胀性骨质破坏、边界清、呈多房囊性合并磨玻璃样影、囊内间隔强化伴散在钙化、牙根吸收或有液-液平者,应诊断为 OF合并ABC的可能性大。
参考文献:
[1] Eversole LR,Sabes WR,Rovin S.Fibrous dysplasia:a nosologic problem in the diagnosis of fibro-osseous lesions of the jaws[J].J Oral Pathol,1972,1(5):189-220.
[2] Barnes L,Eveson JW,Reichart P.World health organization classification of tumours:pathology and genetics of head and neck tumours[M].Lyon,IARC Press,2005:283-328.
[3] Vergel De Dios AM,Bond JR,Shives TC,et al.Aneurysmal bone cyst:a clinicopathologic study of 238 cases[J].Cancer,1992,69(12):2921-2931.
[4] Kransdorf MJ,Sweet DE.Aneurysmal bone cyst:concept,controversy,clinical presentation and imaging[J].Am J Roentgenol,1995,164(3):573-580.
[5] 何银,刘雨成.颌骨肿瘤性病变的CT诊断[J].放射学实践,2005,20(1):65-66.
[6] Segall L,Cohen-Kerem R,Ngan BY,et al.Aneurysmal bone cysts of the head and neck in pediatric patients:a case series[J].Int J Pediatr Otorhinolaryngol,2008,72(7):977-983.
[7] Wojno KJ,McCarthy EF.Fibro-osseous lesions of the face and skull with aneurysmal bone cyst formation[J].Skeletal Radiol,1994,23(1):15-18.
[8] Nasser MJ.Psammomatoid ossifying fibroma with secondary aneurysmal bone cyst of frontal sinus[J].Childs Nerv Syst,2009,25(11):1513-1516.
[9] Kendi AT,Kara S,Altinok D,et al.Sinonasal ossifying fibroma with fluid-fluid levels on MR images[J].AJNR,2003,24(8):1639-1641.
[10] Yang BT,Wang YZ,Wang XY,et al.Imaging study of ossifying fibroma with associated aneurysmal bone cyst in the paranasal sinus[J].Eur J Radiol,2012,81(11):3450-3455.
[11] Aadithya BU,Augustine J,Arora S,et al.Rare ediatric presentation of aneurysmal bone cyst with trabecular juvenile ossifying fibroma and ossifying fibroma[J].Int J Pediatr Otorhinolaryngol,2013,77(4):576-580.
[12] SNB,Rajesh A,NR P,et al.Mandibular aneurysmal bone cyst associated with cemento-ossifying fibroma:a case report[J].J Clin Diagn Res,2013,7(12):3092-3093.
[13] Reddy AV,Reddy KR,Prakash AR,et al.Juvenile ossifying fibroma with aneurysamal bone cyst:a case report[J].J Clin Diagn Res,2014,8(10):1-2.
[14] 粱碧玲.骨与关节疾病影像诊断学[M].北京:人民卫生出版杜,2006:408-409.
[15] Oliveira AM,Chou MM.USP6-induced neoplasms:the biologic spectrum of aneurysmal bone cyst and nodular fasciitis[J].Hum Pathol,2014,45(1):1-11.
[16] Jacquot C,Szymanska J,Nemana LJ,et al.Soft-tissue aneurysmal bone cyst with translocation t(17;17)(p13;q21) corresponding to COL1A1 and USP6 loci[J].Skeletal Radiol,2015,44(11):1695-1699.
[17] Mascard E,Gomez-Brouchet A,Lambot K.Bone cysts:unica-meral and aneurysmal bone cyst[J].Orthop Traumatol Surg Res,2015,101(Suppl 1):S119-S127.
[18] Triantafillidou K,Venetis G,Karakinaris G,et al.Ossifying fibroma of the jaws:A clinical study of 14 cases and review of literature[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2012,114(2):193-199.
[19] 韩婧,田臻,张春叶,等.颌骨青少年骨化纤维瘤——15例临床回顾分析[J].中国肿瘤临床杂志,2005,42(16):834-840.
[20] Nielsen GP,Fletcher JA,Oliveira AM.Aneurysmal bone cyst.In:Fletcher BJA,Hogendoorn PCW,Mertens F (editors).WHO classification of tumours of soft-tissue and bone[M].Lyon:IARC,2013:348-349.
[21] Khoury NJ,Naffaa LN,Shabb NS,et al.Juvenile ossifying fibroma:CT and MR findings[J].Eur Radiol,2002,12(S3):S109-S113.
[22] Liu JJ,Thompson LD,Janisiewicz AM,et al.Ossifying fibroma of the maxilla and sinonasal tract:case series[J].Allergy Rhinol (Providence),2017,8(1):32-36.
[23] Su L,Weathers DR,Waldron CA.Distinguishing features of focal cemento-osseous dysplasia and cemento-ossifying fibromas:a clinical and radiologic spectrum of 316 cases[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1997,84(5):540-549.
[24] 周永红,冯友权,谭志,等.扁骨和不规则骨动脉瘤样骨囊肿的影像诊断[J].放射学实践杂志,2008,23(8):907-910.
[25] Titinchi F,Morkel J.Ossifying fibroma:analysis of treatment methods and recurrence patterns[J].J Oral Maxillofac Surg,2016,74(12):2409-2419.
