注意力调控感觉信息处理的脑功能区研究
2018-05-04龚涛陈家英张丽胡理梁猛
龚涛, 陈家英, 张丽, 胡理, 梁猛
注意力是指人的心理活动集中指向于某种事物的能力[1]。它是信息加工过程中一项重要的心理调节机制,能够对有限的信息资源进行分配整合,使感知具备选择能力[2]。那么,注意力对外界传入信息的调控过程所涉及的脑功能区有哪些?这一问题目前尚无明确共识。大量功能影像学研究已经表明:对某种感觉输入信息施加注意力,可以增强负责处理该感觉模态信息的模态特异性感觉皮层的神经活动[3-5],提示了与感觉刺激模态相对应的感觉皮层的神经活动会受到注意力水平的调控。然而,感觉信息的处理还会涉及更高级的跨模态脑区[6-8],这些高级跨模态脑区也可能参与注意力调控过程。以往的相关研究中大多采用单一感觉模态刺激[3-8],而缺乏同一实验中多种感觉模态受注意力调控的实验证据。为此,我们利用功能磁共振(functional magnetic resonance imaging,fMRI)技术,在实验中令同一被试分别在注意触觉和视觉刺激条件下,接受3种不同感觉模态(触、视、听)的刺激,来考察不同感觉模态刺激所诱发的高级跨模态脑区的神经活动是否参与感觉信息处理的注意力调控过程。
材料与方法
被试为23例健康成人,男11例、女12例,年龄19~26岁,母语为汉语,除一例被试为左利手外、其余均为右利手,视力或矫正视力在正常范围。其中1例志愿者由于数据不全,未纳入到后续的统计分析中。
本次实验采用事件相关设计,共有三种不同模态(触觉、视觉和听觉)的感觉刺激。每种模态的刺激又分为标准和稀有两种类型:标准和稀有触觉刺激分别为30和20 Hz的电脉冲;标准和稀有视觉刺激分别为7.5和4.0 Hz闪烁的黑白棋盘格;标准和稀有听觉刺激分别为800和750 Hz的纯音刺激。每种刺激均持续500 ms。
实验共包含6个组块,每个组块内包含触觉、视觉和听觉刺激各10个,每种模态标准刺激和稀有刺激分别为8个和2个,刺激间隔时间为13、16和19 s,不同种类刺激和不同刺激间隔时间随机呈现。被试的注意力水平通过如下方式调节:在3个组块内,要求被试注意区分标准和稀有两种触觉刺激,而忽略视觉和听觉刺激,一旦稀有触觉刺激出现,被试需要以尽可能快的速度按键;在另外3个组块内,要求被试注意区分标准和稀有两种视觉刺激,而忽略触觉和听觉刺激,一旦稀有视觉刺激出现,被试同样需要以尽可能快的速度按键。每个组块开始前屏幕出现指令提示被试该组块需要区分哪种模态的刺激。注意触觉和注意视觉的组块交替呈现,呈现顺序在被试间均衡。
使用Siemens Trio 3.0T磁共振扫描仪和标准正交头颅线圈。分别行横轴面T1WI和T2*WI梯度回波序列平面回波成像(echo-planar imaging,EPI)。T1WI扫描参数:层厚1 mm,平面内分辨率1 mm×1 mm;EPI扫描参数:TR 3 ms,TE 30 ms,层数41,层厚3.5 mm,视野192 mm×192 mm,矩阵64×64。
数据预处理使用MATLAB平台DPARSFA软件包。首先进行时间校正(Slice Timing)和头动校正(Realign),其中两位被试的头动平均相对位移(framewise displacement,FD)>0.3 mm,其数据被排除。然后进行空间标准化(Normalize),将所有被试脑空间图像配准到Montreal Neurological Institute(MNI)标准空间,并将体素大小重采样为3 mm×3 mm×3 mm。最后采用半高全宽为8 mm的高斯核对图像进行空间平滑(Smooth)。
将预处理所得数据在MATLAB平台的SPM8软件中进行后处理。建立一般线性模型(general linear model,GLM)做个体水平的统计学分析。模型中包含十二种实验条件:2种注意条件(注意触觉、注意视觉)×3种刺激模态(触觉、视觉、听觉)×2种刺激类型(标准、稀有)。模型中同时包含每种刺激条件所对应的血流动态响应函数的时间和宽度的导数以及6个头动参数。根据本次研究目的共设计了2个t检验,分别对触觉刺激和视觉刺激条件下注意力所调控的脑区进行比较和分析。
将个体水平的统计结果通过单样本t检验进行组水平的统计分析,采用团块水平的校正方法(family-wise error,FWE)对统计结果进行多重比较校正(团块阈值定义为P<0.001,校正后P<0.05),分别得到两种条件下注意力所调控的脑区基于组水平的统计参数图。进一步对上述阈值下得到的两种条件组水平统计参数图取交集,得到触觉和视觉信息处理过程中注意力所调控的公共脑区。
结 果
1.触觉信息处理受注意力调控的脑区
触觉信息处理过程中受注意力调控的脑区及相关参数见表1。
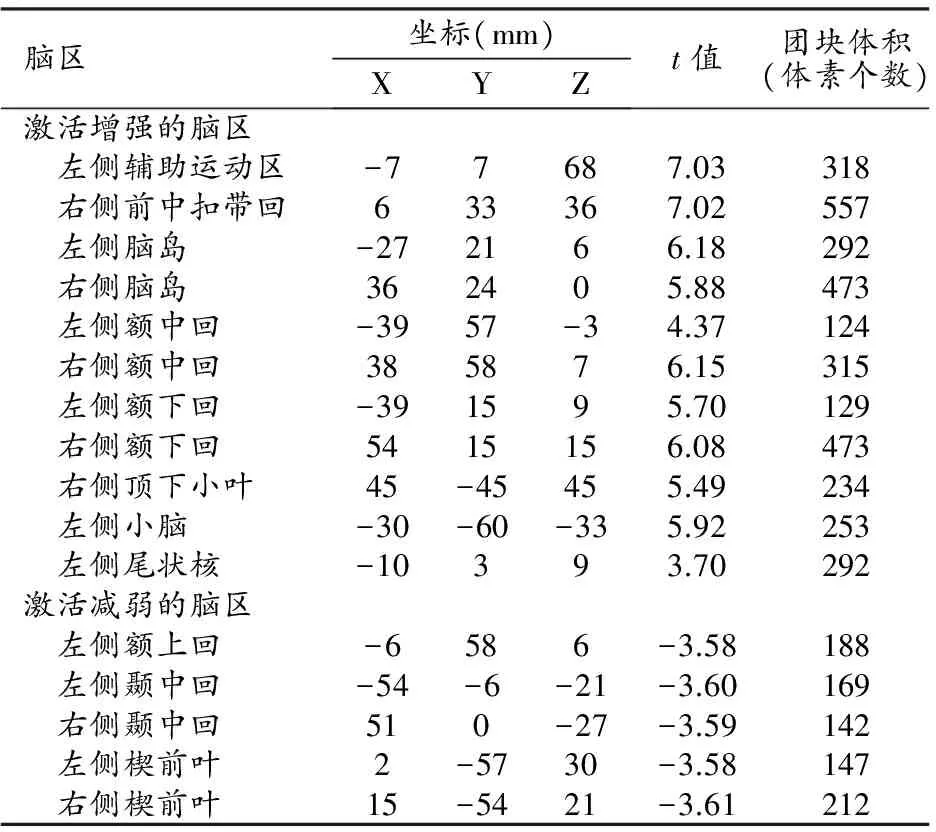
表1 触觉信息处理受注意力调控的脑区
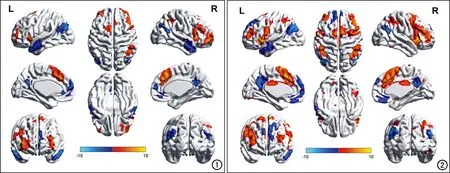
图1 注意触觉刺激(相比于注意视觉刺激)时,fMRI伪彩图显示 触觉刺激下激活增强(红色)及减弱(蓝色)的脑区。 图2 注意视觉刺激(相比于注意触觉刺激)时,fMRI伪彩图显示视觉刺激下激活增强(红色)及减弱(蓝色)的脑区。
当被试注意触觉刺激时(相比于注意视觉刺激),触觉刺激激活增强的脑区有左侧辅助运动区、右侧前中扣带回、左右侧脑岛、左右侧额中回、左右侧额下回、右侧顶下小叶、左侧小脑以及左侧尾状核;激活减弱的脑区有左侧额上回、左右侧颞中回以及左右侧楔前叶(图1)。
2.视觉信息处理受注意力调控的脑区
当被试注意视觉刺激时(相比于注意触觉刺激),视觉刺激下激活增强的脑区有左侧辅助运动区、右侧前中扣带回、左侧中央前回、左右侧脑岛、左右侧额中回、右侧额下回、左右侧顶下小叶、左右侧小脑以及左侧尾状核;激活减弱的脑区有左右侧额上回、左右侧颞中回、左右侧楔前叶以及左侧枕中回(表2、图2)。
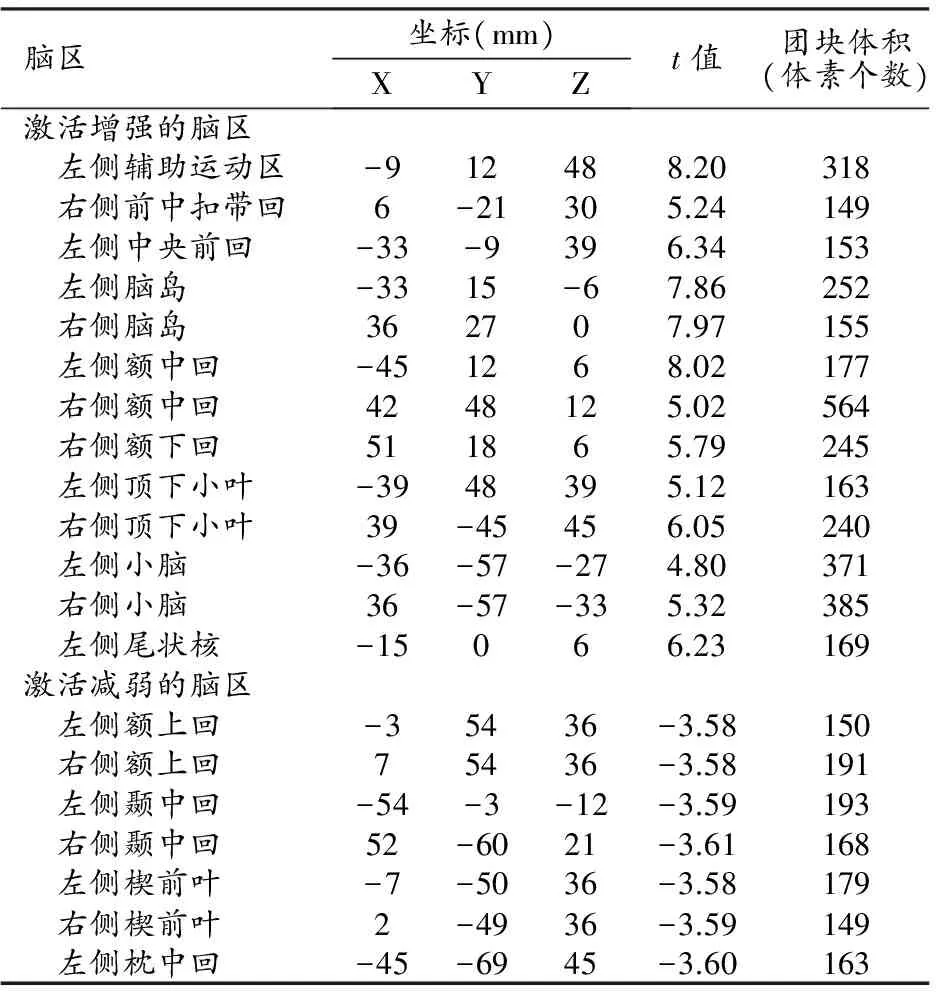
表2 视觉信息处理受注意力调控的脑区
3.触觉和视觉信息处理受注意力调控的公共脑区
当某感觉模态刺激被注意时,该感觉模态刺激下激活增强的公共脑区有左右侧额中回、右侧额下回、右侧顶下小叶、右侧前中扣带回、左右侧脑岛、左侧尾状核、左侧辅助运动区和左侧小脑;激活减弱的公共脑区有左侧额上回、左右侧颞中回和左右侧楔前叶(图3)。
4.注意力相关的听觉刺激激活结果
本组实验结果显示听觉刺激所诱发的神经活动在两种注意力条件下(注意触觉刺激时和注意视觉刺激时)没有显著统计学差异,提示了整个实验过程中对听觉刺激的注意力水平并未改变。
讨 论
在本研究中主要对触觉信息处理和视觉信息处理受注意力调控的脑区进行了分析和观察,结果显示:不论是在触觉信息处理还是在视觉信息处理的过程中,左右侧额中回、右侧额下回,右侧顶下小叶、右侧前中扣带回、左右侧脑岛、左侧尾状核、左侧辅助运动区以及左侧小脑的神经活动均受到注意力水平的调控。
注意力对大脑神经活动的调控机制一直是人们关注的热点问题[9-10]。顶叶及额叶在注意力对感觉信息的调控中发挥着至关重要的作用[11-12]。Mesulam提出了注意力定向模型,他认为顶叶与感觉信息的空间表达有关,外侧额叶与空间刺激的运动反应有关,而前扣带回与感觉刺激的动机突显性有关。后来,Posner和Petersen将注意力模型进一步分为前注意系统和后注意系统:前注意系统与刺激目标的检测与觉察有关,在该系统中前扣带回发挥着重要作用;后注意系统与感觉刺激在视觉空间中的定位有关,在该系统中后顶叶皮层和丘脑发挥着重要作用[13]。这些结果与本研究中所发现的部分脑区激活情况相吻合。
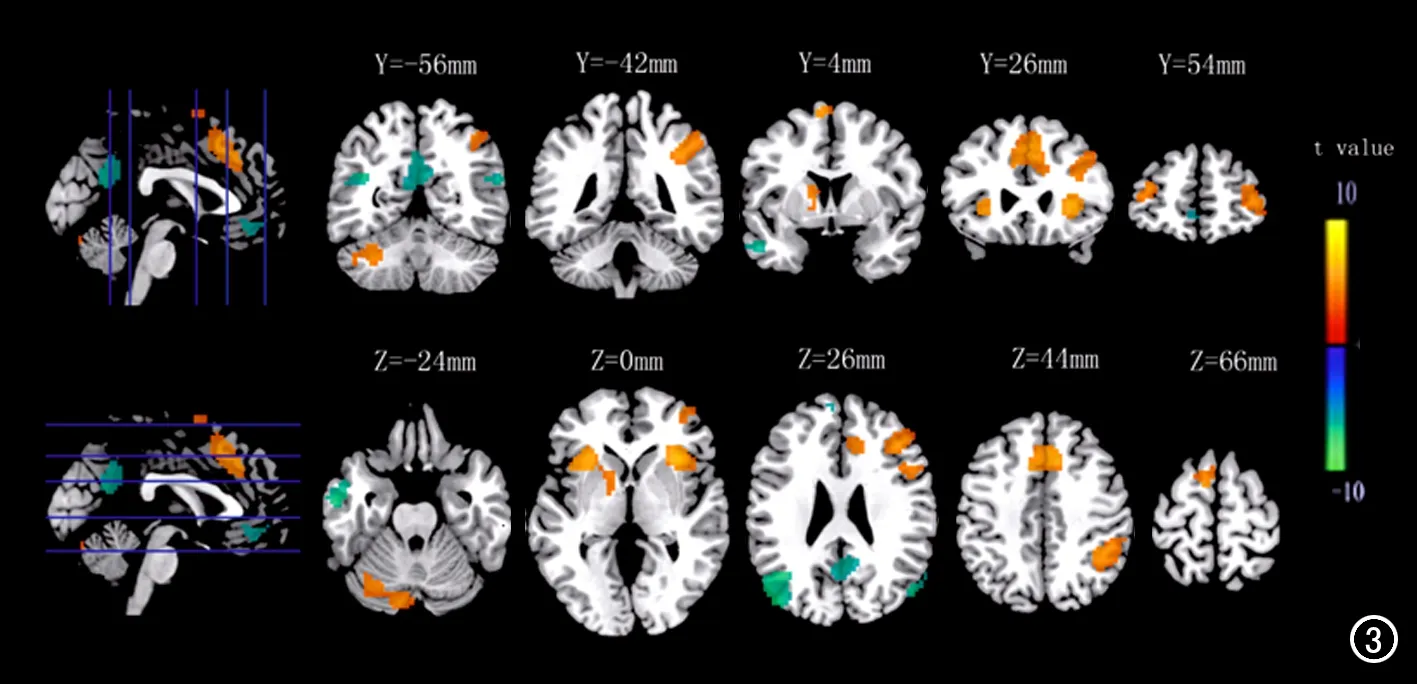
图3 fMRI伪彩图显示激活增强的脑区(呈黄色和红色)有左右侧额中回、右侧额下回、右侧顶下小叶、右侧前中扣带回、左右侧脑岛、左侧尾状核、左侧辅助运动区以及左侧小脑;激活减弱的脑区(呈蓝色和绿色)有左侧额上回和左右侧颞中回。
此外,一些动物实验发现,注意力可以增强神经元对感觉刺激的编码信息,从而可增加动物的感知敏感性[15]。对啮齿类动物的研究发现,注意力可以使对感觉信息进行编码的神经元之间的γ波趋于同步,进而潜在地实现增强信号的功效[16-17]。注意力对感觉信息处理的调控作用,通过前扣带回对目标感觉信息进行觉察和识别,并通过顶叶对感觉信息进行注意力定位[18]。还有学者在研究中发现,空间选择性注意力在感觉信息处理的早期和晚期可以通过高级大脑皮层的反馈来进一步增强初级躯体感觉皮层的神经活动[3],其中涉及到的高级大脑皮层包括额叶、顶叶及前扣带回等脑区。顶叶和前扣带回主要完成对感觉信息的注意力选择[13],注意力使被选择的感觉信息的编码及传导增强[19]。
本组研究结果显示,负责注意力对感觉信息所引起的神经活动进行调控的脑区还包括脑岛、小脑、尾状核及辅助运动区。既往有研究结果显示,触觉刺激所诱发的脑岛神经活动会随着注意力水平的提高而增强[6]。在处理强突显性刺激时,右侧前脑岛与突显网络中其它脑区的功能连接增强,说明右侧前脑岛与突显性信息的处理有关[20]。所以,我们推测脑岛在感觉信息处理的注意力调控中所起的作用可能与感觉信息的突显性改变有关。另有研究结果显示,小脑受损伤的患者较正常人在听觉和视觉之间转移注意力时存在障碍,提示小脑与注意力在不同感觉模态之间的转移有关[21]。本组研究结果还显示,尾状核和辅助运动区也参与到注意力对感觉信息处理的调控过程,但目前相关研究较少,仍需进一步的研究来证实其在注意力调控中所担负的具体功能。
本组研究结果初步发现了感觉信息处理过程中与注意力调控有关的脑功能区,为进一步深入理解注意力对神经活动的调控机制提供了功能影像学的实验证据,同时也可为注意力损伤相关疾病的病理机制研究提供帮助。
参考文献:
[1] 王称丽,贺雯,莫琼琼.7~15岁学生注意力发展特点及其与学业成绩的关系[J].上海教育科研,2012,12(期?):51-54.
[2] 梁晔,刘宏哲.基于视觉注意力机制的图像检索研究[J].北京联合大学学报,2010,24(1):30-35.
[3] Schubert R,Ritter PT,Preuschhof C,et al.Spatial attention related SEP amplitude modulations covary with BOLD signal in S1:a simultaneous EEG-fMRI study[J].Cereb Cortex,2008,18(11):2686-2700.
[4] Goltz D,Pleger B,Thiel SD,et al.Sustained spatial attention to vibrotactile stimulation in the flutter range:relevant brain regions and their interaction[J/OL].Plos One,2013,8(12):e84196.DOI:10.1371/journal.pone.0084196
[5] Somers DC,Sheremata SL.Attention maps in the brain[J].Wiley Interdiscip Rev Cogn Sci,2013,4(4):327-340.
[6] Johansen-Berg H,Christensen V,Woolrich M,et al.Attention to touch modulates activity in both primary and secondary somatosensory areas[J].Neuroreport,2000,11(6):1237-1241.
[7] Lobanov OV,Quevedo AS,Hadsel MS,et al.Frontoparietal mechanisms supporting attention to location and intensity of painful stimuli[J].Pain,2013,154(9):1758-1768.
[8] Buffington AL,Hanlon CA,Mckeown MJ.Acute and persistent pain modulation of attention-related anterior cingulate fMRI activations[J].Pain,2005,113(1):172-184.
[9] Gomez-Ramirez M,Hysaj K,Niebur E.Neural mechanisms of selective attention in the somatosensory system[J].J Neurophysiol,2016,116(3):1218-1231.
[10] Moore T,Zirnsak M.Neural mechanisms of selective visual attention[J].Ann Rev Psychol,2017,68(1):47-72.
[11] Thompson KG,Bichot NP.A visual salience map in the primate frontal eye field[J].Prog Brain Res,2005,147(147):249-262.
[12] Soltani A,Koch C.Visual saliency computations:mechanisms,constraints,and the effect of feedback[J].J Neurosci,2010,30(38):12831-12843.
[13] Mesulam MM.A cortical network for directed attention and unilateral neglect[J].Ann Neurol,1981,10(4):304-325.
[14] Posner MI,Petersen SE.The attention system of the human brain[J].Annu Rev Neurosci,1990,13(1):25-42.
[15] Luo TZ,Maunsell JR.Neuronal modulations in visual cortex are associated with only one of multiple components of attention[J].Neuron,2015,86(5):1182-1188.
[16] Cardin JA,Carlén M,Meletis K,et al.Driving fast-spiking cells induces gamma rhythm and controls sensory responses[J].Nature,2009,459(7247):663-667.
[17] Siegle JH,Pritchett DL,Moore CI.Gamma-range synchronization of fast-spiking interneurons can enhance detection of tactile stimuli[J].Nat Neurosci,2014,17(10):1371-1379.
[18] Noesselt T,Hillyard SA,Woldorff MG,et al.Delayed striate cortical activation during spatial attention[J].Neuron,2002,35(3):575-587.
[19] Cohen MR,Maunsell JH.Attention improves performance primarily by reducing interneuronal correlations[J].Nat Neurosci,2009,12(12):1594-1601.
[20] Touroutoglou A,Hollenbeck M,Dickerson BC,et al.Dissociable large-scale networks anchored in the right anterior insula subserve affective experience and attention[J].Neuroimage,2012,60(4):1947-1958.
[21] Courchesne E,Townsend J,Akshoomoff NA,et al.Impairment in shifting attention in autistic and cerebellar patients[J].Beha-vioral Neuroscience,1994,108 (5):848-865.
