双能CT不同能量组合、重建算法及ROI选择对家兔肝铁定量测量的影响
2018-05-04许霄黄求理朱雪君李涛曹迪龙莉玲
许霄, 黄求理, 朱雪君, 李涛, 曹迪, 龙莉玲
体内铁含量超过正常上限即为铁过载,体内过多的铁与铁蛋白结合,绝大多数沉积于肝脏,产生丙二醛、OH-自由基等有害物质,对细胞膜、蛋白质及DNA产生过氧化损伤,导致肝硬化和肝癌等病变[1]。因此,肝铁含量的监测是临床上评估、治疗肝铁过载相关疾病中最重要的环节。CT三物质分离法是评估肝脏铁含量较新颖的检查手段,其原理是在不同能量状态下,根据肝脏中铁的X线衰减系数的变化率与其它组织成分不同,从而达到在像素水平上将铁去除的效果,并可获得虚拟铁浓度(virtual iron concentration,VIC)图像,因此在无创性定量测量肝内铁含量方面具有较大潜力。但需要注意的是,VIC图像上测量的CT值的准确性和稳定性至关重要,其CT测量值的大小会受到很多因素影响,如扫描参数、测量方法等。本研究通过对大白兔肝铁沉积模型进行双能CT扫描,分析比较不同能量组合、重建算法及兴趣区选择方法时肝内铁含量定量测量的准确性,探讨其应用价值。
材料与方法
1.实验对象
健康雄性新西兰大白兔32只,体重1.5~2.9 kg,平均2.2 kg。所有动物置于常温环境下,自由饮水、取食,每周按15 mg/kg的剂量一次注射浓度为25 mg/mL的右旋糖酐铁剂。实验总时间为16周,每周处死2只大白兔进行病理观察和测量。
2.检查方法
所有兔子于最后一次给药后1周进行检查,扫描前先肌肉注射2 mL地西泮和2 mL硫酸阿托品进行诱导全麻。实验兔取仰卧位,头先进,双侧前肢上展,使用绷带束缚腹部。使用Siemens Somatom Definition Flash双源CT扫描仪。扫描范围自膈顶至双侧髂嵴连线水平。选择Dual Energy双能量扫描模式,能量组合分别设置为80/140 kVp和100/140 kVp,管电流采用Care dose 4D技术,探测器宽度64i×0.6 mm,机架旋转速度500 ms/r,螺距0.6,层厚1.5 mm,层距1.0 mm。能量组合为80/140 kVp时,分别采用滤波反投影法(filtered back projection,FBP)和强度为3的基于原始数据域的迭代重建(sinogram affirmed iterative reconstruction,SAFIRE)算法进行重建,卷积函数分别选择D30f和Q30f;在100/140 kVp组合条件下仅采用FBP算法进行重建。
3.数据分析
将扫描原始数据传输至工作站,采用西门子Liver VIC软件进行后处理,铁斜率值取1.9[2],并设置两种能量下脂肪及软组织的CT值,获得VIC图。
由两位测量者对80/140 kVp组合的FBP和SAFIRE重建图像及100/140 kVp组合的FBP图像进行分析和测量,三组图像中各选择三个相同层面的图像进行评估,所选层面上肝组织结构显示清晰、无变形、无伪影。对80/140 kVp组合下的FBP重建图像 采用两种ROI勾画方法进行测量:第一种为全肝ROI法,即沿距肝被膜下5 mm的肝脏边缘手工勾画ROI的范围,取三个层面CT值的平均值;第二种为小ROI法,即在每个层面图像上在肝组织内勾画较小范围的ROI,每个层面勾画1个,ROI面积均为1 cm2,取3个层面测量值的平均值。两种方法勾画ROI时均尽量避开肉眼可见的肝门区血管、胆管及化学位移伪影。另外2组图像仅采用小ROI法进行测量(图1a~b)。
4.肝脏铁含量检测
CT检查完毕后采用空气栓塞法处死实验动物,解剖方法取出肝脏,每个肝叶切成2块,去除大血管及胆管后,使用双蒸水反复冲洗8~10次,然后将标本置于60℃烤箱烘干,烘干时间大约为5天。烘干后将肝组织粉碎,送广西分析测试研究中心经硝酸硝化处理后,使用原子分光光度仪测量肝组织内的铁浓度(liver iron concentration,LIC)。
5.病理分析
对每只家兔肝脏标本取材进行病理学检查,应尽量避开肝包膜、肝门区血管及胆管,标本经生理盐水冲洗后置入10%甲醛溶液固定,按照病理程序进行酒精脱水、二甲苯透明、浸蜡、石蜡包埋后切片,普鲁士蓝染色后在光镜下进行观察。
6.统计学分析
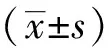
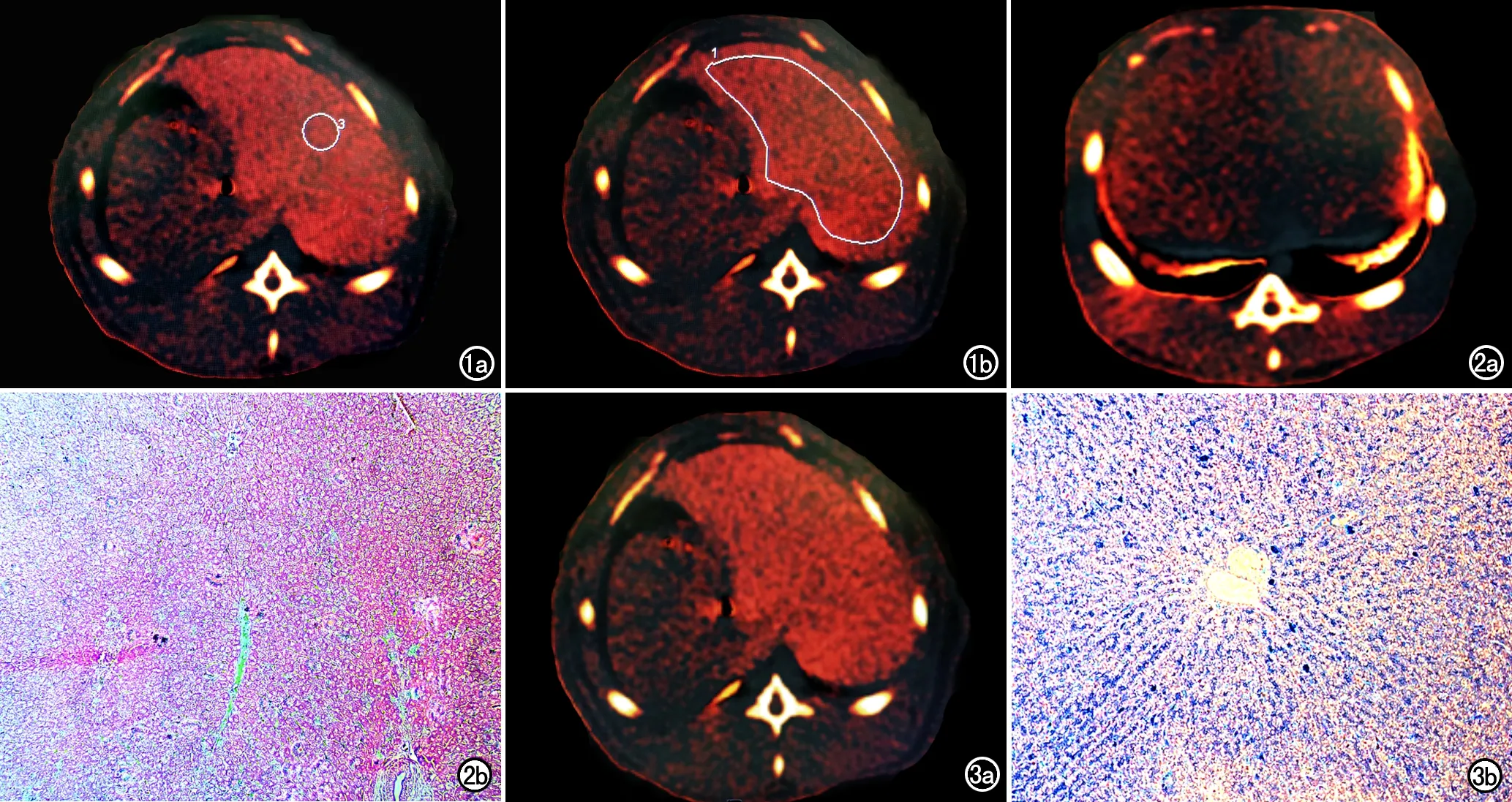
图1 家兔模型VIC图像。a) 全肝ROI测量法,在VIC图像上在肝被膜下5mm沿肝边缘勾画ROI,测量肝脏的CT值; b) 小ROI测量法,与图a相同层面,在肝实质内勾画约1cm2大小的ROI,测量肝脏的CT值。图2 注射右旋糖酐铁第3周末兔肝模型(LIC为5.0mg/g)。a) VIC伪彩图显示肝实质颜色较暗,提示铁浓度较低; b) 病理标本镜下示肝内散在分布少量的蓝染含铁血黄色颗粒且分布不均(×100,PB染色)。图3 注射右旋糖酐铁第16周末兔肝模型(LIC为22.9mg/g); c) VIC伪彩图显示肝实质颜色较亮,提示铁浓度较高; b) 病理标本镜下示肝内弥漫分布的蓝染含铁血黄色颗粒,分布欠均匀(×100,PB染色)。
结 果
1.数据的分布特征
两种能量组合、重建算法及ROI测量方法下得到的肝脏CT值均呈正态分布。在80/140 kVp条件下两种重建算法之间及两种ROI方法之间的数据满足方差齐性(P>0.05)。两种能量组合的FBP法重建图像上测量的肝脏CT值之间方差不齐(P<0.01)。在相同扫描条件、重建算法图像上或相同ROI选择方法时两位阅片者测量的肝脏CT值之间具有较好的一致性,ICC值均达到0.9以上。
2.不同条件下VIC图上肝脏CT值的比较
80/140和100/140 kVp条件下(FBP法VIC图像上)测量的肝脏CT值分别为(29.21±14.19)和(17.48±7.63) HU,两组间的差异具有统计学意义(Z=-4.843,P<0.01),80/140 kVp组合下测量的肝脏CT值大于100/140 kVp组合。全肝ROI法和小ROI法测量的肝脏CT值分别为(29.99±14.07)和(29.21±14.19) HU,两组间的差异具有统计学意义(t=-2.795,P<0.001)。80/140 kVp组合下FBP和SAFIRE算法VIC图像上测量的肝脏CT值分别为(29.21±14.19)和(29.18±14.11) HU,两组间的差异无统计学意义(t=8.565,P=0.792>0.05)。
3.VIC图上肝脏CT值与LIC的相关性
采用各种能量组合、重建算法及ROI法获得的VIC图像上测得的肝脏CT与实验室检测的肝脏标本的LIC之间均具有较好的相关性(图2a、3a)。其中,采用80/140 kVp能量组合:FBP重建算法及小ROI法测量的VIC图上肝脏CT值与实验室测量的肝脏标本的LIC之间的相关系数r值为0.895(P<0.01),SAFIRE算法下测得的CT值与LIC之间的相关系数r值为0.915(P<0.01),全肝ROI法下测得的CT值与LIC之间的相关系数r值为0.917(P<0.01)。100/140 kVp条件下(FBP重建算法及小ROI法)VIC图像上测得的肝脏CT值与实验室测量的肝脏标本LIC间的相关系数r值为0.835(P<0.01)。
4.病理表现
病理标本显微镜下主要表现:含铁血黄素在组织细胞内呈黄褐色颗粒及小块,对普鲁士蓝染色较为敏感,呈鲜蓝色染色的阳性反应。注射右旋糖苷铁第一周在肝脏内即可观察到少量含铁血黄色颗粒沉积,随着注射时间的增长,含铁血黄素在肝实质及小叶静脉区的分布逐渐增多,部分含铁颗粒融合成簇,分布不均匀(图2b、3b)。
讨 论
近年来双能CT各项技术逐步完善并开始应用于临床,在肝内铁含量的定量检测方面,双能CT差值法(ΔH法)和三物质分离算法是两种主要方法。ΔH法是通过计算在两个单能量水平下每个体素的CT值之差,通过与已知物质含量的CT值差值的标准曲线对比来评估该体素内铁浓度,但该体素内的CT差值反映的是包括肝组织、钙化、铁和脂肪等多个物质的信息,而不能单一反映铁含量的信息[3];而且血色素沉着症患者往往合并肝硬化、肝炎等肝脏疾病,也会导致这种方法对肝内铁含量的测量存在一定误差。三物质分离法则是根据铁在两种能量下的CT值,建立坐标系,利用几何方法和特定的铁斜率值来计算铁含量,通过计算公式转化并估算其浓度,得到直观体现组织化学成分的图像,即虚拟铁含量图[4]。这种虚拟铁含量图消除了肝脏内脂肪、钙化、糖原沉积等因素的影响,可特异性反映肝脏内铁离子的沉积程度(图2a、3a)[2]。
虚拟铁含量图上CT值测量会受到很多因素影响,如扫描参数、重建算法及ROI大小等,不同的成像设备也会导致CT测量值不同。西门子公司的二代双源CT机(Somatoms Flash CT)在进行双能量扫描时匹配有2种能量组合,即80/140 kVp和100/140 kVp[5]。目前100/140 kVp这一能量组合的应用范围较局限,多用于肺部扫描,如对肺内碘和氙分布的显示、对肺部病灶碘增强扫描的定量分析。80/140 kVp这一能量组合的临床应用较为广泛,尤其是在对痛风病灶的显示、降低金属伪影、结石的成分分析、钙化定量分析、头颈自动去骨等方面有一定优势。本研究分别采用上述两种能量组合对肝铁沉积动物模型进行扫描,并与采用原子分光光度仪测量的病理标本的肝组织铁浓度(LIC)进行比较,结果显示两种能量组合下测得的VIC图上肝脏CT值有显著差异,80/140 kVp组合下肝脏CT测量值高于100/140 kVp组合,且与病理检测结果的相关性更高。笔者分析原因,一方面是由于双能CT对不同物质的区分能力既取决于物质本身原子序数的差异,另一方面取决于双能量扫描时两种能谱本身的重叠程度。理论上讲两种能量的峰值(即两种管电压)间距越大,能谱的重叠就越少,物质区分的效果就越好;而能谱重叠越多,则物质在两种能量下的衰变相似度大,平均光子能量类似,因此对物质的区分能力较差。与100/140 kVp组合相比,80/140 kVp组合中两个能量的峰值间距更大,能谱区分度更大,物质区分能力更强[6],因此在虚拟铁含量图上的CT值较高。
在重建算法方面,滤波反投影法(FBP)一直都作为重建方法的基础和“金标准”[7],它具有分辨率高、成像速度快等优势,但该算法要求投影数据完备,且易受统计波动的影响,若投影数据量不足,则重建的图像质量就会明显降低。而SAFIRE技术作为西门子公司推出的第二代迭代重建算法,通过在原始数据空间及图像空间进行多次迭代,反复修正噪声,不仅降低了图像噪声、提高了图像质量,而且在一定程度上可降低扫描的辐射剂量[8-10],对于伪影的去除亦有较好的效果。本研究结果显示,SAFIRE和FBP法重建后获得的VIC图像上肝脏CT测量值间的差异无统计学意义,且与病理方法检测的LIC值之间均具有高度相关性,说明SAFIRE重建算法不会对VIC图上CT测量值产生影响,由此可以推断,物质分离图像相比解剖图像测量的CT值,受不同重建算法因素的影响很小,FBP和SAFIRE法重建得到的VIC图均能准确地反映肝组织内真实的铁含量,尤其以SAFIRE算法下获得的VIC图上肝脏CT测量值与LIC的相关性优于FBP法。
在测量方法方面,无论是在MRI还是CT图像上,过去大多采用小感兴趣区法来测量组织器官的信号强度或CT值,为了排除肝内血管、胆管及其它病灶的影响,感兴趣区域应选择在信号/密度显示较均匀的肝实质区域进行勾画。这种方法具有简便、快捷的优点,但也存在一些缺陷,测量者设置的ROI容易受到主观因素的影响,ROI的大小及位置不同所得到的CT值往往存在一定的差异。因此,有学者提出了基于整个肝脏的全肝ROI测量方法,即把单层图像上所有肝实质区域作为感兴趣区,这样可降低测量者主观因素的影响,但弊端在于图像上一些较小的血管、胆管不易分辨,难以去除,且手动勾画全肝实质区的方法复杂耗时,因此相关研究中应用也较少。有学者在MRI图像上分别采用这两种ROI方法测量肝脏的R2和R2*值来评估肝脏铁含量 ,结果显示全肝ROI法更为准确[11-12]。在CT三物质分离法定量测量肝脏铁含量方面,本组研究结果表明,全肝ROI法与小ROI法测得的VIC图上肝脏CT值之间具有明显差异,且全肝ROI法与病理方法检测的LIC间的相关性较优。笔者分析原因,可能是由于铁过载时肝脏内转铁蛋白受体分布的差异导致铁质在肝脏内的沉积不均匀所致,此时小ROI法测量的肝脏CT值受到测量位置的影响较明显。
本研究尚存在以下不足:①仅在动物模型上通过不同扫描方式及测量方法进行比较,而在肝铁沉积患者肝内铁定量测量分析方面尚需进一步研究;②由于兔子肝脏体积较小,扫描时的管电流已接近CT机的最低值,无法进一步调低管电流来评估SAFIRE重建算法在保证图像质量情况下降低辐射剂量的潜力;③仅以不同能量组合、重建算法及ROI测量方法为变量来比较CT测量值,而探测器宽度、螺距、层厚、螺距和扫描视野等因素对虚拟铁含量图上CT测量值的影响如何,有待进一步研究。
参考文献:
[1] Shander A,Cappellini MD,Goodnough LT.Iron overload and to-xicity:the hidden risk of multiple blood transfusions[J].Vox Sanguinis,2009,97(3):185-197.
[2] Fischer MA,Reiner CS,Raptis D,et al.Quantification of liver iron content with CT-added value of dual-energy[J].Eur Radiol,2011,21(8):1727-1732.
[3] Raptopoulos V,Karellas A,Bernstein J,et al.Value of dual-energy CT in differentiating focal fatty infiltration of the liver from low-density masses[J].AJR,1991,157(4):721-725.
[4] 王凯旋,崔诗爽,靳云鹏,等.CT测定肝脏铁含量的研究进展[J].国际医学放射学杂志,2014,37(5):434-437.
[5] 杨帆,林伟,陈卫霞.CT双能量扫描模式在腹部应用的研究进展[J].放射学实践,2015,29(4):388-391.
[6] Johnson TR.Dual-energy CT:general principles[J].AJR,2012,199(Suppl 5):3-8.
[7] 王革,俞恒永,勃鲁努.曼,等.X线和CT研究与发展之展望[J].中国医疗器械杂志,2008,32(3):157-169.
[8] 陆秀良,曾蒙苏.迭代重建算法在CT中的应用[J].中国医疗设备,2012,27(4):128-131.
[9] 王芳,高剑波,刘杰,等.正弦图确定迭代重建技术在降低胸部扫描剂量中的应用[J].中国医学影像技术,2012,28(11):2087-2089.
[10] Winklehner A,Karlo C,Puippe G,et al.Raw data-based iterative reconstruction in body CTA:evaluation of radiation dose saving potential[J].Eur Radiol,2011,21(12):2521-2526.
[11] Positano V,Salani B,Pepe A,et al.Improved T2*assessment in liver iron overload by magnetic resonance imaging[J].Magn Reson Imaging,2009,27(2):188-197.
[12] Mccarville MB,Hillenbrand CM,Loeffler RB,et al.Comparison of whole liver and small region-of-interest measurements of MRI liver R2* in children with iron overload[J].Pediatr Radiol,2010,40(8):1360-1367.
