携带血管紧张素转换酶2基因的人脐带间充质干细胞尾静脉注射移植可减轻博来霉素诱导的大鼠急性肺损伤
2018-05-04高风英金文强王星海刘振威
高风英, 金文强, 王星海, 刘振威
1. 上海市建工医院呼吸科,上海 200083 2. 上海市第一人民医院呼吸科,上海 200080
急性肺损伤(acute lung injury, ALI)是由心源性以外的各种直接或间接因素所引起的以急性弥漫性肺泡炎性病变为特征的肺部急性炎症反应,是临床常见的危重疾病,可进一步发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[1-2]。ALI发病机制复杂,发病率高,且尚无有效的治疗措施,其病死率高达40%以上。因此,寻找新的有效治疗方法是目前ALI临床诊治的难题。
血管紧张素转换酶2(angiotensin converting enzyme 2, ACE2)与ACE类似,是肾素-血管紧张素系统(rennin angiotensin system, RAS)的重要组成部分[3],在ALI/ARDS疾病过程中发挥重要的保护作用[4-5]。间充质干细胞(mesenchymal stem cells, MSCs)具有干细胞自我复制和多向分化潜能,逐渐被应用于肺损伤的临床诊治。MSCs体内移植能够抑制急性肺损伤模型动物的炎症反应,触发修复相关的生长因子,减轻肺组织炎性反应[6-7]。但目前MSCs主要来源于骨髓,获取途径有限,获取过程有创,大大制约其临床应用。人脐带间充质干细胞(human umbilical mesenchymal stem cells, HUMSCs)是MSCs的一种,可从废弃胎盘组织中分离提取,来源广泛,较骨髓来源MSCs具有更低的免疫原性,更易体外扩增,且无伦理学制约,逐渐成为组织工程和再生医学中最具发展前景的种子细胞[8-9]。
因此,本研究基于HUMSCs的特性和ACE2对肺损伤的保护作用,采用转染法构建携带ACE2基因的HUMSCs,并将其移植入急性肺损伤模型大鼠体内,观察其对博来霉素(bleomycin, BLM)诱导的急性肺损伤大鼠肺组织的影响,探讨携带ACE2基因的HUMSCs尾静脉注射移植对急性肺损伤的作用及可能机制,为后续研究奠定基础。
1 材料与方法
1.1 主要试剂及仪器 主要试剂:BLM(美国Sigma公司),DMEM/F12培养基、胎牛血清(美国Gibco公司);PE anti-mouse CD45、CD105,FITC anti-mouse CD29、CD34、CD44(美国eBioscience公司),BCA蛋白浓度测定试剂盒、ACE2抗体(美国Cell Signal公司),髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒(南京建成生物工程研究所),INF-γ、IL-4基因引物[生工生物工程(上海)股份有限公司],TNF-α ELISA检测试剂盒(美国R&D公司)。主要仪器:流式细胞仪(FACSCalibur,美国BD Biosciences公司),PCR仪、电泳仪和电源(美国Bio-Rad公司)。
1.2 HUMSCs的分离培养及鉴定 无菌条件下取正常足月剖宫产健康婴儿脐带,剪成约1 mm2的组织块,将其接种于细胞培养板,加入含双抗及10%胎牛血清的DMEM/F12培养基,置于37℃、5%CO2饱和湿度的培养箱内培养,待细胞生长至约80%融合时,用含胰蛋白酶的消化液消化,按104/cm2的密度传代至细胞培养瓶中进行培养。细胞表面标志鉴定:取对数生长期第4代细胞,分别加入PE anti-mouse CD86、CD45、CD105及FITC anti-mouse CD29、CD34、CD44标记HUMSCs。采用流式细胞仪检测HUMSCs表型。
1.3 ACE2基因转染HUMSCs 采用TRIzol试剂从人肺组织提取总RNA,反转录获得人ACE2基因的cDNA片段。构建慢病毒基因转移载体,然后与包装载体共转染293T细胞,扩增病毒。再转染绿色荧光蛋白(GFP)基因在HUMSCs内作为追踪HUMSCs的基因。收集病毒后转染HUMSCs,倒置荧光显微镜下观察GFP荧光阳性率来检测转染效率。转染效率=发出绿色荧光的细胞数/可见光下总细胞数×100%,并测定转染了ACE2基因HUMSCs的表型。
1.4 大鼠分组及急性肺损伤模型的建立 清洁级雄性SD大鼠120只,体质量(250±20) g,由中国科学院实验动物中心提供。大鼠随机均分为5组:正常对照组、BLM组、ACE2组、HUMSCs组、HUMSCs-ACE2组(n=24)。除正常对照组外,其余4组采用一次性气管内滴注BLM(5 mg/kg)制造肺损伤大鼠模型,正常对照组滴注等体积生理盐水(0.9%NaCl)。各组大鼠分别给予如下处理,BLM组:建立肺损伤大鼠模型后注入生理盐水2 mL;ACE2组:建立肺损伤大鼠模型后尾静脉注入由慢病毒携带ACE2基因2 mL;HUMSCs组:建立肺损伤大鼠模型后单纯注入HUMSCs 2 mL,细胞数1×106;HUMSCs-ACE2组:建立肺损伤大鼠模型后注入携带ACE2基因的HUMSCs 2 mL,细胞数1×106;正常对照组:正常大鼠输注等体积的生理盐水2 mL。于肺损伤前及肺损伤后第3天、第7天和第14 天取相应标本进行检测。生存分析:每组12只大鼠单独用于记录生存状况,记录每只大鼠的生存天数,观察14 d研究周期内大鼠的生存状况,计算生存率并绘制生存曲线。
1.5 观察指标及测定方法
1.5.1 肺泡灌洗液(broncho-alveolar lavage fluid, BALF)中性粒细胞、总蛋白含量测定 采用10%水合氯醛麻醉大鼠,取预冷生理盐水灌洗支气管肺泡,收集BALF,离心后取上清液根据BCA试剂盒说明书测定总蛋白含量,取沉淀部分经1 mL PBS重悬,常规瑞氏染色后,显微镜下人工计数中性粒细胞数量。
1.5.2 肺组织形态学观察及肺损伤严重程度评分 制备肺组织石蜡切片,脱蜡,苏木精染色,光镜下观察病变区及附近肺组织病理变化,重点对肺充血及肺出血情况、肺泡内渗出、肺泡及血管壁的中性粒细胞浸润、肺泡壁增厚程度及肺透明膜的形成等4种情况进行评估及对肺损伤严重程度评分。共分为5个等级:0分为没有损伤,1分为轻微损伤,2分为中度损伤,3分为重度损伤,4分为极重度损伤。最终将各个评分进行汇总,总分即代表肺损伤程度。
1.5.3 Western印迹法测定肺组织ACE2蛋白表达 取肺组织匀浆,离心,取上清,进行蛋白定量和免疫印迹检查。各实验组取等量蛋白20 μg进行电泳分析。采用12%SDS-PAGE电泳分离蛋白,将分离的蛋白条带通过湿法转至PVDF膜上,室温下封闭,然后与抗ACE2抗体孵育过夜,洗脱一抗,加二抗(1∶1 000)孵育,洗去二抗,经过化学发光法显色后显影、定影。

1.5.5 肺组织水含量测定 新鲜肺组织取下后称湿重,然后置烤箱烤至恒重,称干质量,计算两次肺组织质量之比,即肺组织的湿干比(W/D)以反映肺水肿程度。
1.5.6 RT-PCR测定肺组织中INF-γ、IL-4 mRNA变化 取肺组织匀浆,加入TRIzol试剂冰上提取总RNA,然后根据反转录试剂盒说明书合成cDNA。IL-4引物序列,正向:5′- CTG ACG GCA CAG AGC TAT TGA -3′,反向:5′- TAT GCG AAG CAC CTT GGA AGC -3′。INF-γ引物序列,正向:5′- GCA TCT TGG CTT TGC AGC T -3′,反向:5′- CCT TTT TCG CCT TGC TGT TG -3′。β-actin引物序列,正向:5′- AGC TGC GTT TTA CAC CCT TT -3′,反向:5′- AAG CCA TGC CAA TGT TGT CT -3′。采用2-ΔΔCt法来分析数据。其中,ΔCt=Ct(目的基因)—Ct(内参基因),ΔΔCt=ΔCt(样品)—ΔCt(对照)。
1.5.7 ELISA法测定肺组织中细胞因子TNF-α的含量 取肺组织用生理盐水冰上匀浆,离心后取上清液,按照ELISA检测试剂盒说明书操作检测TNF-α含量。
1.5.8 肺组织中外源性HUMSCs的检测 肺组织冷冻切片采用荧光显微镜观察外源性HUMSCs携带的GFP在特定波长光激发下所发出的绿色荧光,了解外源性HUMSCs存留肺内的转化效率。取肺组织样本进行免疫组化染色,检测肺组织中GFP的表达,同时在连续切片上检测肺泡上皮细胞特异性蛋白cytokeratin,定位外源性HUMSCs在体内修复肺组织的情况。
1.6 统计学处理 采用SPSS 13.0软件进行分析,多样本间两两比较采用One-way ANOVA中的Bonferroni检验,各项实验重复3次,检验水准(α)为0.05。
2 结 果
2.1 HUMSCs的形态学观察及ACE2基因的转染效果 无菌分离的HUMSCs在CO2培养箱中常规内培养1~2 d后,显微镜下见部分梭形贴壁细胞,7 d后形成形态相对一致、呈集落状态生长的长梭形细胞,14 d后形成80%融合的单层贴壁细胞层。倒置显微镜观察结果(图1)显示:HUMSCs转染病毒后24 h开始开始检测到绿色荧光,荧光强度随时间不断增强,于第5天达到高峰。当感染复数(multiplicity of infection, MOI)=10时,GFP荧光检测阳性细胞百分比>95%,且细胞感染后可见细胞未出现病变,细胞活力及生长状态良好;MOI大于10时,细胞死亡率明显增加,当MOI=80时,细胞大量死亡,故确定后续转染最佳MOI值为10。
流式细胞仪检测结果显示:转染前HUMSCs细胞表型CD29、CD44、CD105均呈阳性表达,而CD34、CD45、CD86呈阴性表达,提示所获得的细胞符合HUMSCs特性;转染ACE2基因后第5天其表型并未发生显著变化,提示转染本身及ACE2表达并未导致HUMSCs相关表型的变化。

图1 倒置荧光显微镜观察HUMSCs细胞ACE2基因转染效果
A:转染前;B 转染后第1天;C:转染后第3天;D:转染后第5天. Original magnification: ×200
2.2 大鼠生存状态分析 Kaplan-Meier生存曲线(图2)表明:实验开始后3~7 d内大鼠死亡率较高,其他时间段较低。进一步采用Log Rank(Mantel-cox)法比较各干预组与BLM组大鼠的生存率,结果显示:HUMSCs-ACE2组大鼠生存率优于BLM组,差异有统计学意义(P=0.037);ACE2组、HUMSCs组大鼠生存率与BLM组相比,差异无统计学意义(P=0.167、0.087)。结果提示HUMSCs-ACE2干预能夠减轻肺损伤导致的大鼠死亡(P<0.05)。
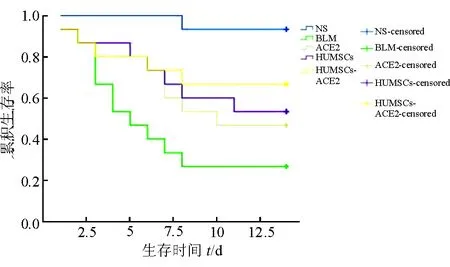
图2 各组大鼠Kaplan-Meier生存曲线
2.3 BALF中性粒细胞计数及总蛋白含量的变化 结果(图3A)表明:与NS对照组相比,经BLM刺激后的各实验组大鼠BALF中性粒细胞计数明显增加,差异有统计学意义(P<0.05)。HUMSCs组、ACE2组及HUMSCs-ACE2组大鼠BALF中性粒细胞计数在第3、7、14天较同期BLM组呈现下降趋势,其中以HUMSCs-ACE2组降低量最明显,差异有统计学意义(P<0.05)。
结果(图3B)表明:经BLM刺激后,各实验组大鼠BALF总蛋白量升高,其中以第3天的BALF总蛋白量表达最高;与同期BLM组相比,HUMSCs组、ACE2组及HUMSCs-ACE2组BALF总蛋白量降低,以HUMSCs-ACE2组降低量最明显,第3、7、14天较同期BLM对照组呈现时间依赖性下降趋势,差异有统计学意义(P<0.05)。
2.4 肺组织形态学观察及肺损伤严重程度病理评分 H-E染色结果(图4)表明:肺组织损伤在第3~7天最为严重,出现肺水肿,并有较多炎性细胞浸润,肺纤维化严重,与动物死亡数的时间分布相符;随后损伤有减轻趋势,肺泡炎症好转,少量淋巴细胞浸润,成纤维细胞少量增生。其中,第7天的H-E染色结果如下:NS对照组大鼠肺组织结构正常,肺泡结构完整光滑,无炎性细胞浸润(图4A);BLM组肺组织水肿,少量出血,光镜下可见大量中性细胞浸润,肺泡间隔增厚,肺泡壁破坏(图4B);HUMSCs-ACE2组炎性细胞浸润明显减少,肺损伤程度较BLM组显著减轻(图4E)。
肺损伤严重度病理评分结果(表1)显示:与BLM相比,ACE2、HUMSCs、HUMSCs-ACE2组大鼠肺组织损伤得到不同程度的改善,尤以HUMSCs-ACE2组表现最佳,在损伤后第3、7、14天差异有统计学意义(P<0.05)。
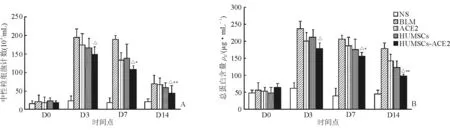
图3 各组大鼠BALF中性粒细胞计数(A)及总蛋白含量(B)的变化

图4 损伤后第7天大鼠肺组织H-E染色结果
A: NS对照组; B: BLM组; C: ACE2组; D: HUMSCs组; E: HUMSCs-ACE2组. Original magnification:×200

表1 病程中各组大鼠肺组织损伤严重度评分的比较
2.5 Western印迹法测定肺组织ACE2蛋白表达 结果(图5)表明:各时间点NS对照组大鼠肺组织ACE2蛋白表达差别无统计学意义;与NS对照组相比,经BLM刺激后,BLM组ACE2蛋白表达下降最显著,ACE2组、HUMSCs组及HUMSCs-ACE2组ACE2蛋白受BLM诱导肺损伤后呈下降趋势,但在第3天开始回升,HUMSCs-ACE2组总蛋白中ACE2表达增量最明显,在第14天达到高峰,接近BLM刺激前水平,与同期BLM组相比,差异有统计学意义(P<0.05)。
2.6 肺组织MPO活力及肺水肿程度的测定 结果(图6A)表明:经BLM刺激后,各实验组大鼠肺组织MPO活力显著升高,在第3天达到高峰,随后在第7天、第14天开始回落,与NS对照组相比差异有统计学意义(P<0.05)。HUMSCs组、ACE2组及HUMSCs-ACE2组与同期BLM组相比,MPO活性降低,以HUMSCs-ACE2组降低量明显,第3、7、14天较同期BLM组呈现时间依赖性下降趋势,差异有统计学意义(P<0.05)。其中,在第3天,HUMSCs-ACE2组MPO活性低于HUMSCs组,但差异无统计学意义。在第7、14天,HUMSCs-ACE2组MPO活性较ACE2组、HUMSCs组均明显降低,提示ACE2转染HUMSCs能有效降低肺组织中MPO活性。
结果(图6B)表明:肺湿干比在BLM造模后较NS对照组显著上升,HUMSCs-ACE2组在第3天达高峰后开始下降,ACE2组、HUMSCs组则在第7天达高峰(P<0.05)。HUMSCs组、ACE2组及HUMSCs-ACE2组与同期BLM组相比,肺湿干比均有所降低,以HUMSCs-ACE2组降低最明显,提示ACE2转染的HUMSCs能协同降低肺水肿程度。

图5 各组大鼠肺组织ACE2蛋白的表达变化
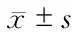

图6 各组大鼠肺组织MPO活性(A)及肺水肿程度(B)的变化
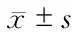
2.7 RT-PCR测定肺组织中INF-γ、IL-4 mRNA的表达变化 结果(图7A)表明:BLM组和HUMSCs组INF-γ mRNA表达量一直维持在较高水平,第7天达高峰,随后随时间推移开始下降,ACE2组及HUMSCs-ACE2组INF-γ mRNA表达在第3天达高峰,随后在第7、14天开始下降。HUMSCs组、ACE2组及HUMSCs-ACE2组与同期BLM组相比INF-γ mRNA水平降低,以HUMSCs-ACE2组降低量最明显,第3、7、14天较同期BLM组呈现时间依赖性下降趋势,差异有统计学意义(P<0.05)。
结果(图7B)表明:经BLM刺激后,各实验组大鼠肺组织IL-4 mRNA表达显著下降,在第3天达到最低量,随后在第7、14天开始上升,与NS对照组相比差异有统计学意义(P<0.05)。HUMSCs组、ACE2组及HUMSCs-ACE2组与同期BLM组相比,IL-4 mRNA表达升高,以HUMSCs-ACE2组升高量最明显,第3、7、14天较同期BLM对照组呈现时间依赖性上升趋势,差异有统计学意义(P<0.05)。
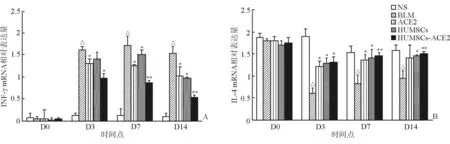
图7 各组大鼠肺组织INF-γ(A)、IL-4 mRNA(B)的表达变化
2.8 ELISA法测定肺组织中TNF-α的含量 结果(图8)表明:BLM组大鼠肺组织TNF-α含量一直维持在较高水平,在第3天达到高峰,在第7、14天随时间推移开始下降。HUMSCs组、ACE2组及HUMSCs-ACE2组与同期BLM组相比,TNF-α表达下降,以HUMSCs-ACE2组降低量最明显,第3、7、14天较同期BLM组呈现时间依赖性下降趋势,差异有统计学意义(P<0.05)。第3天HUMSCs-ACE2组TNF-α表达高于HUMSCs组,但在第7、14天,HUMSCs-ACE2组TNF-α表达较ACE2组、HUMSCs组均明显降低,并呈现时间依赖性,提示ACE2转染HUMSCs能有效降低肺组织TNF-α的表达。
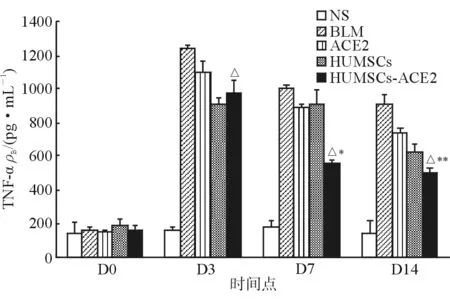
图8 各组大鼠肺组织TNF-α的表达变化
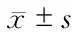
2.9 肺组织外源性HUMSCs的检测 结果(图9)显示:外源性HUMSCs携带ACE2/eGFP基因,经尾静脉输入体内后,在第14天可见肺组织受损处多处表达GFP阳性细胞。特异性蛋白cytokeratin检测结果发现,该类细胞为肺泡上皮细胞,提示携带ACE2基因的HUMSCs在肺部有转化修复的能力。

图9 肺组织外源性HUMSCs的检测
A: DAPI染色; B: 直接镜检; C: 肺泡上皮细胞GFP免疫组化染色; D: 免疫组化染色阴性对照. Original magnification: ×400
3 讨 论
本研究采用一次性气管内滴注BLM制造肺损伤动物模型,模拟ALI的病理生理过程,通过肺组织病理学及相关炎症指标的检测显示,肺组织中出现炎性渗出、水肿,肺血管膜受损和通透性增加,符合ALI的模型要求。HUMSCs是从废弃的胎盘中分离提取,易得且来源丰富、不涉及伦理学争议[10]。ACE2基因对AngⅡ有极高的催化效率,具有扩张血管、参与炎症反应调控的作用[11-13]。ACE2基因缺失能加剧BLM诱导的肺损伤,而重组ACE2蛋白对急性肺损伤小鼠有保护作用[14]
本研究采用流式细胞仪对ACE2转染前后HUMSCs进行表面标志检测,结果显示HUMSCs转染ACE2基因后其表型并未发生显著变化,提示转染本身及ACE2并未影响HUMSCs相关表型的变化。目前尚无携带ACE2基因的HUMSCs对急性肺损伤的作用研究。因此,本研究拟探讨携带ACE2基因的HUMSCs对急性肺损伤的作用,并为进一步研究其在肺损伤中的作用机制及对肺损伤的临床治疗提供理论依据。
本研究采用三质粒共转染法在293T细胞中制备109~1010级病毒颗粒Lenti-ACE2,并转染HUMSCs,ACE2基因进入HUMSCs内形成稳定表达,然后将HUMSCs-ACE2经尾静脉输入大鼠体内,同时设置GFP作为示踪蛋白,追踪HUMSCs在体内的变化。结果显示携带ACE2/GFP基因的HUMSCs在肺组织受损处多处出现表达GFP的肺泡上皮细胞,提示携带ACE2基因的HUMSCs在肺部有转化修复的能力。
病理学研究和肺组织损伤严重程度总体评分发现,肺组织损伤在第3天和第7天最为严重,与动物死亡数时间分布相符,随后损伤有减轻趋势。经ACE2、HUMSCs和携带ACE2基因的HUMSCs这3种不同方法干预后,肺组织病理学和肺组织损伤得到进一步不同程度的改善,尤其以HUMSCs-ACE2组表现为佳,提示携带ACE2的HUMSCs在改善实验大鼠整个病程的肺损伤上存在优势。
通过对肺组织MPO活性和BALF中性粒细胞数目的检测,结果显示第3天各组MPO活性和BALF中性粒细胞数目达到高峰,其中HUMSCs-ACE2组大鼠MPO活性和BALF中性粒细胞数目与HUMSCs、ACE2组相比,在第3天后开始迅速下降,表现出改善迹象,提示携带ACE2基因的HUMSCs对于治疗肺损伤较HUMSCs或ACE2单独治疗有优势。
细胞因子的改变是肺损伤病程中的一个重要体现。细胞因子按炎症反应可分为促炎因子和抗炎因子,其中促炎因子主要有INF-γ、TNF-α、IL-1、TL-6等,抗炎因子主要有IL-4、TL-10等。本研究选取促炎因子INF-γ、TNF-α及抗炎因子IL-4作为研究对象,通过ELISA和RT-PCR检测其表达水平。结果表明,经BLM刺激后,各组促炎因子INF-γ、TNF-α表达量增加,在第3天达到高峰,抗炎因子IL-4表达量下降,在第3天达到最低值,随后的第7、14天促炎因子INF-γ、TNF-α表达量随时间降低,抗炎因子IL-4 mRNA水平随时间上升,均以HUMSCs-ACE2组表达量改变最明显,提示HUMSCs-ACE2细胞移植治疗对抑制促炎因子INF-γ、TNF-α的表达,提高抗炎因子IL-4的表达较单纯ACE2、HUMSCs效果更佳。
综上所述,携带ACE2基因的HUMSCs尾静脉注射移植能有效降低ALI大鼠肺部炎症渗出和血管通透性,降低肺组织中促炎因子基因水平,并能提高抗炎因子IL-4及ACE2的表达,从而减轻ALI大鼠病理损伤程度,提示HUMSCs-ACE2具有修复肺损伤的功能,且治疗效果优于单纯的HUMSCs或ACE2治疗,其具体的作用机制仍有待进一步的研究证实。
[ 1 ] DODOO-SCHITTKO F, BRANDSTETTER S, BRANDL M, et al. German-wide prospective DACAPO cohort of survivors of the acute respiratory distress syndrome (ARDS): a cohort profile[J].BMJ Open,2018,8(4):e019342.
[ 2 ] GALVIN I M, STEEL A, PINTO R, et al. Partial liquid ventilation for preventing death and morbidity in adults with acute lung injury and acute respiratory distress syndrome[J]. Cochrane Database Syst Rev,2013,(7):CD003707.
[ 3 ] GEMBARDT F, STERNER-KOCK A, IMBODEN H, et al.Organ-specific distribution of ACE2 mRNA and correlating peptidase activity in rodents[J].Peptides,2005,26(7):1270- 1277.
[ 4 ] LI W, MOORE M J, VASILIEVA N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus[J]. Nature, 2003,426(6965):450-454.
[ 5 ] IMAI Y, KUBA K, RAO S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure[J].Nature, 2005,436(7047):112-116.
[ 6 ] KRAUSE D S, THEISE N D, COLLECTOR M I, et al. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell[J].Cell, 2001,105(3):369-377.
[ 7 ] ORTIZ L A,GAMBELLI F,MCBRIDE C,et al. Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects[J]. Proc Natl Acad Sci USA, 2003,100(14):8407-8411.
[ 8 ] ROJAS M, XU J, WOODS C R, et al. Bone marrow-derived mesenchymal stem cells in repair of the injured lung[J]. Am J Respir Cell Mol Biol, 2005,33(2):145-152.
[ 9 ] KOTTON D N, MA B Y, CARDOSO W V, et al. Bone marrow-derived cells as progenitors of lung alveolar epithelium[J]. Development, 2001,128(24):5181-5188.
[10] MUELLER S M, GLOWACKI J. Age-related decline in the osteogenic potential of human bone marrow cells cultured in three-dimensional collagen sponges[J].J Cell Biochem, 2001,82(4):583-590.
[11] ZHONG J C, YU X Y, LIN Q X, et al. Enhanced angiotensin converting enzyme 2 regulates the insulin/Akt signalling pathway by blockade of macrophage migration inhibitory factor expression[J]. Br J Pharmacol, 2008,153(1):66-74.
[12] ZHONG J C, YU X Y, HUANG Y, et al. Apelin modulates aortic vascular tone via endothelial nitric oxide synthase phosphorylation pathway in diabetic mice[J].Cardiovasc Res, 2007,74(3):388-395.
[13] OUDIT G Y, KASSIRI Z, PATEL M P, et al. Angiotensin II-mediated oxidative stress and inflammation mediate the age-dependent cardiomyopathy in ACE2 null mice[J]. Cardiovasc Res, 2007,75(1):29-39.
[14] REY-PARRA G J, VADIVEL A, COLTAN L, et al. Angiotensin converting enzyme 2 abrogates bleomycin-induced lung injury[J]. J Mol Med (Berl), 2012,90(6):637-647.
