血清降钙素原、C反应蛋白、可溶性髓细胞表达触发受体-1及白细胞介素-6对老年早发性脑卒中相关性肺炎的诊断价值
2018-05-04王燕慧陶应敏
谢 娟, 张 山, 李 梁, 王燕慧, 陶应敏
复旦大学附属上海市第五人民医院老年科,上海 200240
脑卒中是神经系统的一种常见病和多发病,它影响全身多系统器官功能。在老年卒中患者中肺炎最为常见[1-2]。Hiker等[1]将此命名为卒中相关性肺炎(stroke-associated pneumonia, SAP),72 h内发生的SAP被称为早发性卒中相关性肺炎(EOP)。EOP是卒中患者病情加重和死亡的主要原因之一,提高EOP诊治水平,对改善卒中患者预后具有重要意义。由于卒中患者昏迷、反应性差、床旁胸片不易发现病灶等因素,EOP患者临床早期诊断较困难[2]。因此迫切需要寻找一些既灵敏又特异的生物学指标早期确诊EOP。
近年来,血清降钙素原(PCT)、C-反应蛋白(CRP)、可溶性髓细胞表达触发受体-1(sTREM-1)、白细胞介素-6(IL-6)作为重要的炎症标志物,对呼吸机相关性肺炎(VAP)、脓毒症等的临床诊治具有重要意义[3-5],但对EOP诊断价值研究鲜有报道。因此,本研究在入院2 h、24 h、48 h对卒中患者连续检测血清PCT、CRP、sTREM-1及IL-6含量,分析血清炎症标志物的动态变化趋势,探讨上述炎症标志物对EOP早期诊断的价值。
1 资料与方法
1.1 研究对象 选取2015年1月至2016年12月上海市第五人民医院老年科收治住院的急性脑卒中患者为研究对象。急性脑卒中诊断参照1995年第四届全国脑血管会议制定的脑血管病诊断标准,均经头颅CT或MRI证实,均在卒中发病后72 h内入院。排除标准:(1)患者24 h内出院或死亡;(2)入院时脑死亡或心跳停搏;(3)入院时气管分泌物、痰涂片染色或培养呈阳性,或胸片表明已患有肺炎。符合入选标准的急性脑卒中患者共536例,其中男性312例,女性224例,年龄65~96岁,平均(75.41±9.36)岁。以脑卒中患者中未发生肺感染的患者作为对照组。本研究经复旦大学附属上海市第五人民医院伦理委员会审核批准,所有研究对象均签署知情同意书。
1.2 诊断标准 SAP诊断标准[1]:急性卒中患者出现下列2项以上临床症状或实验室检查结果。(1)发热(体温>38℃);(2)呼吸道脓性分泌物;(3)新出现低氧血症(PaO2<70 mmHg或比患者基础氧分压降低10 mmHg,1 mmHg=0.133 kPa);(4)细菌涂片或痰培养发现致病菌;(5)白细胞计数大于10.0×109/L;(6)影像学发现肺部有新的渗出病变(胸部CT或胸片)。EOP诊断标准:急性卒中72 h内发生的SAP。
1.3 资料收集及指标检测 记录研究对象的年龄、性别、住院天数和转归。入院24 h内测定血常规、体温,进行血气分析、胸片检查及支气管吸引物培养,入院2 h、24 h、48 h分别采集血标本检测PCT、sTREM-1、CRP和IL-6含量,并进行CPIS评分(根据Luna等[6]制定的简化CPIS表)。PCT采用半定量固相免疫法测定,CRP采用浊度免疫法检测,sTREM-1采用固相ELISA法定量检测,IL-6采用酶联免疫吸附法检测。

2 结 果
2.1 患者人口学特征及基线资料 536例急性卒中患者中153例诊断为EOP,EOP发生率为28.54%。结果(表1)表明:EOP组与非EOP组患者性别、年龄差异无统计学意义;但EOP组患者住院时间更长,28 d死亡患者比例更高(P< 0.05);住院24 h,EOP组患者血清PCT、CRP、sTREM-1、IL-6及CPIS评分均高于对照组,差异有统计学意义(P<0.05)。
2.2 不同时间点EOP患者炎症指标及CPIS评分的比较 结果(表2)表明:153例EOP患者中PCT、sTREM-1在24 h达到最高,48 h出现一定幅度的下降;IL-6在2 h达到高峰,随着时间的推移不断降低;CRP在入院24 h显著升高,48 h仍维持高点;CPIS评分在24 h、48 h逐渐升高。各指标在不同时间点的差异均有统计学意义(P<0.05)。

表1 各组患者人口学特征及基线资料的比较

表2 不同时间点EOP患者炎症指标及CPIS评分的比较
2.3 不同时间点各指标对EOP的诊断效能 结果(表3、图1)表明:入院2 h,IL-6的诊断效能最好,AUC达0.930;入院24 h,sTREM-1、PCT的诊断效能较好,AUC分别为0.957、0.936;入院48 h,PCT、sTREM-1的诊断效能较好,AUC分别为0.847、0.837。
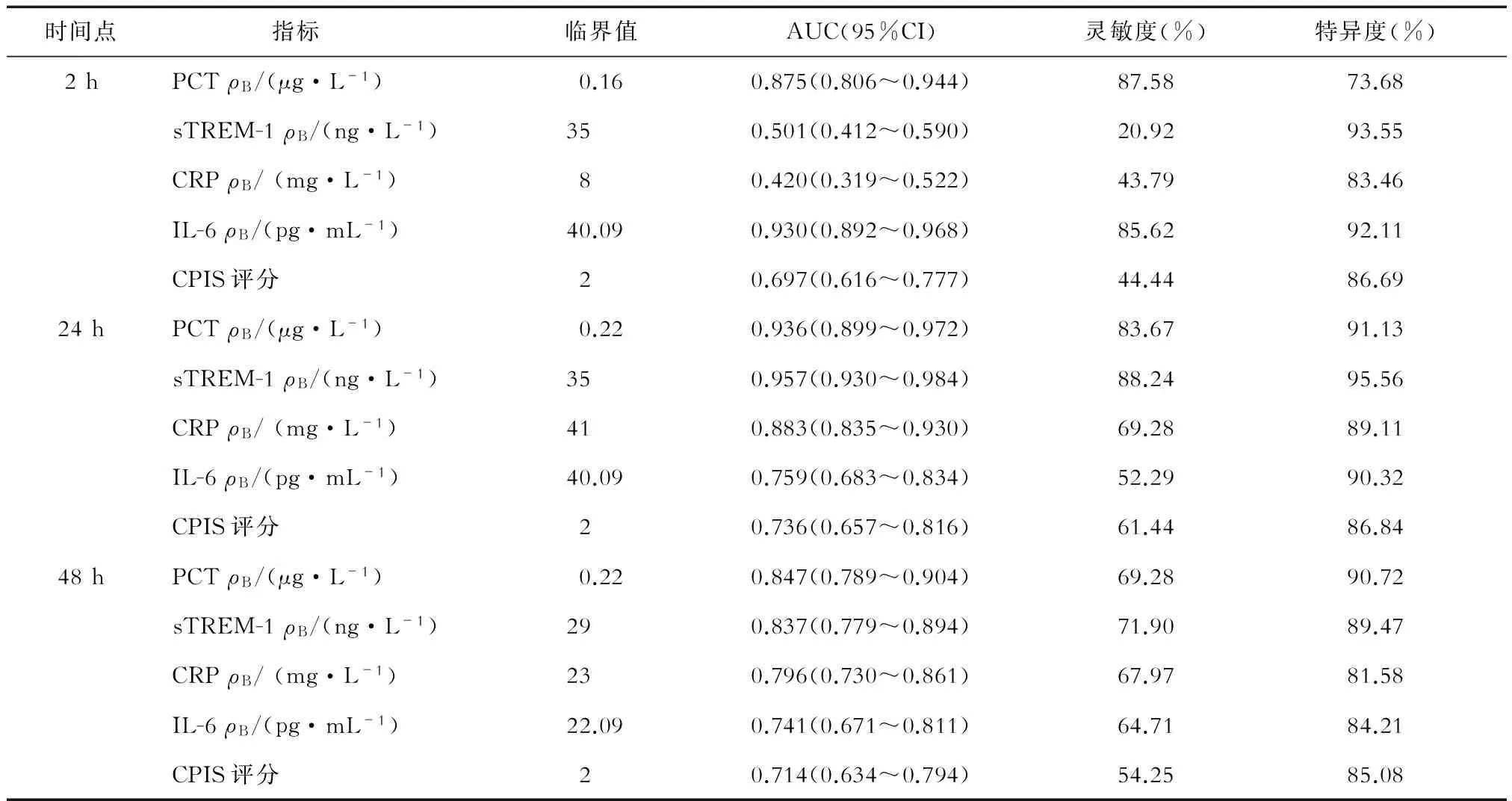
表3 不同时间点各指标对EOP的诊断效能

图1 各项指标不同时间点对EOP诊断的ROC曲线
2.4 各项指标与EOP相关性的回归分析 采用住院24 h的指标值进行单因素Logistic回归,结果(表4)显示:住院24 h的PCT、CRP、sTREM-1、IL-6及CPIS评分均与EOP的发生显著相关(P<0.05)。将上述指标放入多因素Logistic回归模型,结果(表5)显示:血清PCT、sTREM-1水平与EOP的发生显著相关(P<0.05)。

表4 各项指标与EOP诊断的单因素Logistic回归分析
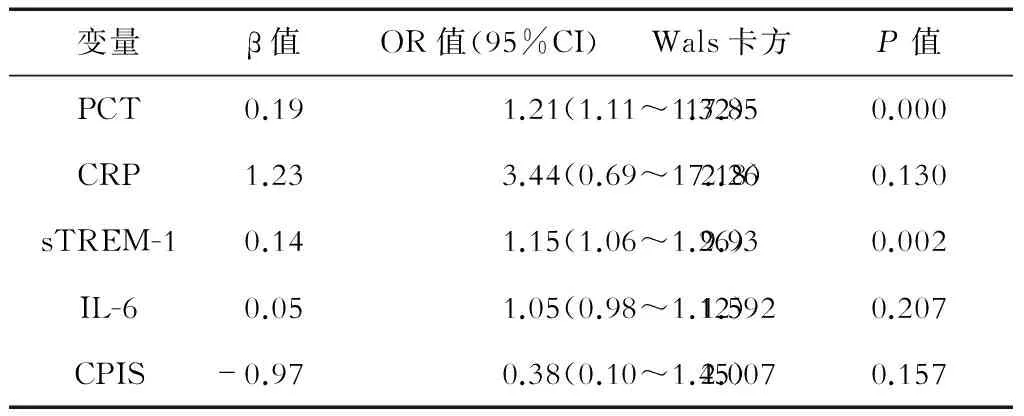
表5 各项指标与EOP诊断的多因素Logistic回归分析
3 讨 论
卒中发生后患者存在明显的吞咽功能障碍和隐性吸入,其误吸的风险明显增加,极易导致下呼吸道感染的发生[7]。已有的动物和临床试验研究证实,卒中诱导的免疫抑制导致迟发性变态反应减弱,细胞吞噬及杀灭病原体的能力下降[8]。临床实践中有不少卒中相关性肺炎患者白细胞不升高,CRP不升高,体温不升高。因此,目前采用的SAP临床诊断方法,其敏感性不乐观。卒中患者的病死率与SAP特别是与EOP密切相关,迫切希望寻找一些指标能早期诊断EOP。本研究比较EOP与对照组患者住院24 h的血清PCT、CRP、sTREM-1、IL-6及CPIS评分,发现EOP患者的炎症指标及CPIS评分明显升高,提示使用这些炎症指标可以早期判断EOP的发生。
IL-6是炎性介质网络的关键,可以独立预测卒中相关性感染,包括卒中相关性肺炎[9]。重症肺炎患者中IL-6迅速升高,但下降也很快[10]。炎症反应发生后,IL-6率先生成,然后诱导产生CRP和PCT[11]。本研究发现IL-6在患者住院2 h达最高点,随着时间的推移不断降低,符合IL-6的变化趋势。CRP是急性时相反应蛋白,当机体处于急性感染状态时,4~6 h迅速升高,1~2 d浓度达峰值,升高幅度与感染程度正相关[12]。CRP是反映社区获得性肺炎严重程度的独立标志物[13]。本研究结果显示CRP在入院24 h达到高峰,并且48 h仍维持在高点,提示EOP患者的炎症反应持续存在。
PCT是早期诊断SAP有效的生物学标志物[14-15]。PCT也有助于判断VAP发生的风险,对VAP的诊断具有较高的敏感性和特异性[16]。sTREM-1是一种炎性激发受体,机体受到炎症感染时诱导促炎介质释放并抑制抗炎因子产生,其介导的信号转导在炎症反应的发生和级联放大中起重要作用[17]。sTREM-1是诊断和排除VAP的有效标志物[18]。本研究分析EOP患者住院2 h、24 h、48 h炎症指标的动态变化趋势,发现血清PCT、sTREM-1在24 h达到高峰,48 h出现下降,与既往研究[19-20]结果相符。
CPIS为临床评估肺炎的综合评判指标,有一定的主观性,可靠性较差,而PCT、sTREM-1、IL-6等炎症指标在诊疗的最初阶段就能采集,已被用作有效的诊断生物标志物[21-22]。本研究分析住院不同时间点炎症指标对EOP的诊断效能,ROC曲线分析结果显示,住院2 h IL-6诊断EOP的效能要优于其他炎症指标,AUC达到0.930;住院24 h sTREM-1、PCT的诊断效能较好,AUC分别为0.957、0.936;住院48 h也是PCT、sTREM-1的诊断效能较好,但AUC值低于24 h。由于PCT、sTREM-1在24 h达高峰,这些指标在24 h的诊断效能要优于2 h、48 h,而IL-6在2 h已达到峰值,因此在2 h诊断效能最高。进一步采用多因素Logistic回归分析住院24 h的指标值与EOP的相关性,发现24 h的PCT、sTREM-1与EOP显著相关。上述结果提示,急性卒中患者住院2 h检测IL-6,24 h联合检测PCT、sTREM-1,可显著提高EOP早期诊断的准确率。
综上所述,48 h内PCT、sTREM-1、IL-6、CRP等炎症标志物的连续检测有利于早期诊断老年患者EOP,值得进一步深入研究。
[ 1 ] HILKER R, POETTER C, FINDEISEN N, et al. Nosocomial pneumonia after acute stroke: implications for neurological intensive care medicine[J]. Stroke, 2003,34(4):975-981.
[ 2 ] EMSLEY H C, HOPKINS S J. Acute ischaemic stroke and infection: recent and emerging concepts[J]. Lancet Neurol, 2008,7(4):341-353.
[ 3 ] HILLAS G, VASSILAKOPOULOS T, PLANTZA P, et al. C-reactive protein and procalcitonin as predictors of survival and septic shock in ventilator-associated pneumonia[J]. Eur Respir J, 2010,35(4):805-811.
[ 4 ] ARORA S, SINGH P, SINGH P M, et al. Procalcitonin levels in survivors and nonsurvivors of sepsis: systematic review and meta-analysis[J]. Shock, 2015,43(3):212-221.
[ 5 ] WU Y, WANG F, FAN X, et al. Accuracy of plasma sTREM-1 for sepsis diagnosis in systemic inflammatory patients: a systematic review and meta-analysis[J]. Crit Care, 2012,16(6):R229.
[ 6 ] LUNA C M, BLANZACO D, NIEDERMAN M S, et al. Resolution of ventilator-associated pneumonia: prospective evaluation of the clinical pulmonary infection score as an early clinical predictor of outcome[J]. Crit Care Med, 2003,31(3):676-682.
[ 7 ] HANNAWI Y, HANNAWI B, RAO C P, et al. Stroke-associated pneumonia: major advances and obstacles[J]. Cerebrovasc Dis, 2013;35(5):430-443.
[ 8 ] EMSLEY H C, HOPKINS S J. Post-stroke immunodepression and infection: an emerging concept[J]. Infect Disord Drug Targets, 2010,10(2):91-97.
[ 9 ] KWAN J, HORSFIELD G, BRYANT T, et al. IL-6 is a predictive biomarker for stroke associated infection and future mortality in the elderly after an ischemic stroke[J]. Exp Gerontol, 2013,48(9):960-965.
[10] 陈炎堂, 赵英萍, 杜云波, 等.血清降钙素原、C-反应蛋白及白细胞介素6在重症肺炎患者中的临床应用[J].中华临床医师杂志(电子版), 2012,6(15):4336-4340.
[11] REINHART K, MEISNER M, BRUNKHORST F M. Markers for sepsis diagnosis: what is useful?[J] Crit Care Clin, 2006,22(3):503-519, Ⅸ-Ⅹ.
[12] VINCENT J L,DONADELLO K,SCHMIT X.Biomarkers in the critically ill patient: C-reactive protein[J]. Crit Care Clin, 2011,27(2):241-251.
[13] CHALMERS J D,SINGANAYAGAM A,HILL A T.C-reactive protein is an independent predictor of severity in community-acquired pneumonia[J]. Am J Med, 2008,121(3):219-225.
[14] ULM L,HOFFMANN S,NABAVI D,et al.The randomized controlled Strawinski trial: procalcitonin-guided antibiotic therapy after stroke[J]. Front Neurol, 2017,8:153.
[15] HUG A, MÜRLE B, DALPKE A, et al. Usefulness of serum procalcitonin levels for the early diagnosis of stroke-associated respiratory tract infections[J]. Neurocrit Care, 2011,14(3):416-422.
[17] BOUCHON A, FACCHETTI F, WEIGAND M A, et al. TREM-1 amplifies inflammation and is a crucial mediator of septic shock[J]. Nature, 2001,410(6832):1103-1107.
[18] HORONENKO G, HOYT J C, ROBBINS R A, et al. Soluble triggering receptor expressed on myeloid cell-1 is increased in patients with ventilator-associated pneumonia: a preliminary report[J]. Chest, 2007,132(1):58-63.
[19] CLAEYS R,VINKEN S,SPAPEN H,et al.Plasma procalcitonin and C-reactive protein in acute septic shock: clinical and biological correlates[J]. Crit Care Med, 2002,30(4):757-762.
[20] CAO C,GU J,ZHANG J. Soluble triggering receptor expressed on myeloid cell-1 (sTREM-1): a potential biomarker for the diagnosis of infectious diseases[J]. Front Med, 2017,11(2):169-177.
[21] CHRIST-CRAIN M, SCHUETZ P, MÜLLER B. Biomarkers in the management of pneumonia[J]. Expert Rev Respir Med, 2008,2(5):565-572.
[22] KIM M W, LIM J Y, OH S H.Mortality prediction using serum biomarkers and various clinical risk scales in community-acquired pneumonia[J].Scand J Clin Lab Invest, 2017,77(7): 486-492.
