基于单中心的卵巢子宫内膜样囊肿起源的卵巢透明细胞癌临床特征及预后分析
2018-05-04唐浩莎
唐浩莎, 王 肖, 刘 艳, 卢 媛
复旦大学附属妇产科医院妇科,上海 200011
子宫内膜异位症(endometriosis,EM)是一种常见的雌激素依赖性疾病,多发生在育龄期女性,其特征是子宫内膜腺体和间质的异位生长[1-2]。EM虽为良性疾病,但其表现出的浸润性、侵袭性和转移性等特点与恶性肿瘤的生物学行为相似[1-2]。EM人群罹患卵巢癌的风险增加,且不同病理类型卵巢肿瘤与EM的相关性亦有差异,尤以卵巢透明细胞癌(ovarian clear cell carcinoma, OCCC)和子宫内膜样癌最为密切[1-2]。1925年,Sampson[3]发现了从卵巢EM演化而来的肿瘤灶,并提出了“子宫内膜异位症继发恶性肿瘤”的概念。近年来,临床和基础研究支持EM及其恶变潜能在一部分卵巢癌的发生发展中起关键作用,因而这部分卵巢癌被称为子宫内膜异位症相关性卵巢癌(endometriosis-associated ovarian carcinoma, EAOC)[4]。随着卵巢癌二元论模型的提出,部分观点认为EM即为OCCC的前驱病变[5]。多数临床研究[6-7]显示EAOC与普通卵巢癌相比,具有相对独特的临床特征,如发病年龄更早、肿瘤分期更早、临床预后更好等。然而,亦有研究[2,8]通过多因素分析发现两组间无进展生存期和总生存期并无显著差异,推测EAOC患者因EM病史而进行的密切随访使得其恶性肿瘤更易被早期发现和治疗,这是影响其预后的主要因素,而非EM本身。
为了进一步了解EAOC的疾病特点,本研究针对EAOC中最常见的组织学亚型OCCC进行探讨,通过回顾性分析复旦大学附属妇产科医院126例OCCC患者的临床资料,比较起源于卵巢子宫内膜样囊肿(endometriotic cyct, EC)的OCCC及非起源于EC的OCCC在基线资料、手术病理和生存预后等方面的差异,以加深对此类特殊卵巢癌的认识,提高诊治水平。
1 资料与方法
1.1 研究对象 回顾性分析2007年11月至2016年2月于复旦大学附属妇产科医院就诊并接受手术治疗、术后病理确诊为OCCC的患者。纳入标准:(1)在复旦大学附属妇产科医院接受初始手术治疗;(2)术后组织病理学诊断为OCCC(可合并其他病理类型)。排除标准:(1)术前曾行化疗或其他治疗;(2)其他部位恶性肿瘤转移至卵巢;(3)临床病理资料不完整者。本研究通过医院伦理委员会审核批准,所有患者均知情同意并签署知情同意书。
1.2 起源于EC的OCCC的诊断标准 根据Scott[9]在Sampson[3]提出的EM恶变诊断标准,起源于EC的OCCC需同时符合以下条件:(1)OCCC和EC发生于同侧卵巢且位置邻近;(2)排除其他同部位(如子宫内膜透明细胞癌或对侧卵巢原发性OCCC)转移的可能;(3)镜下见子宫内膜样间质和腺体,即存在确诊EM的病理学证据;(4)镜下见EC囊壁被覆的子宫内膜样腺上皮与OCCC有明确的移行关系。本研究共纳入126例OCCC患者,根据以上诊断标准,其中46例起源于EC(EC组),80例非起源于EC(non-EC组),non-EC组患者中5例合并EM但不符合起源于EC的OCCC诊断标准。
1.3 观察指标及随访分析 收集并统计126例OCCC患者的临床资料,包括年龄、孕产史、术前CA125水平、国际妇产科联盟(FIGO)分期、肿瘤大小及侧别、病理类型、残余瘤情况。术后辅助化疗相关内容包括是否接受化疗、化疗方案及疗程、是否化疗敏感。化疗敏感定义为从完成最后一次铂类化疗至疾病复发的间隔时间>6个月。通过门诊随访或电话随访获取患者生存数据,计算无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)。PFS定义为从确诊到复发的月数,OS定义为从确诊到死亡的月数,随访截止日期为2016年12月25日。

2 结 果
2.1 两组患者术前临床特征的比较 结果(表1)表明:与non-EC组相比,EC组患者确诊时的平均年龄更小(P=0.011)、原发肿瘤直径更小(P=0.045)、双侧卵巢受累率更低(P=0.033)。EC组患者产次<2次的比例显著高于non-EC组(P=0.012),EC组患者CA125≤200 U/mL的比例显著高于non-EC组(P<0.001)。EC组和non-EC组患者发病时处于绝经后状态的比例差异无统计学意义。
2.2 两组患者手术及化疗相关指标的比较 与其他EOC一样,早期OCCC患者行全面分期手术,晚期患者尽可能施行满意的瘤体减灭术(无肉眼残留病灶)。手术方式分开腹手术和腹腔镜手术。结果(表1)表明:EC组开腹、腹腔镜手术例数分别为33例(71.7%)、13例(28.3%),non-EC组分别为73例(91.3%)、7例(8.7%),手术方式差异有统计学意义(P=0.004)。90例行腹水或腹腔冲洗液细胞学检查者,EC组细胞学阳性率显著低于non-EC组(P=0.021)。109例行淋巴结清扫或活检者,EC组患者淋巴结转移率低于non-EC组(P=0.005)。

表1 两组OCCC患者临床病理特征的对比
FIGO: International Federation of Gynecology and Obstetrics, 国际妇产科联盟;a: 另含有子宫内膜样和浆液性癌成分;b: 3例另含有子宫内膜样癌成分,6例另有浆液性癌成分.*P<0.05
EC组患者具有更高的满意瘤体减灭率(P=0.039)。EC组患者诊断时处于早期(FIGOⅠ~Ⅱ期)的占95.7%(44/46),non-EC组中早期患者仅占58.8%(47/80),差异有统计学意义(P<0.001)。单纯性OCCC的比例及肿瘤组织TP53、ER和PR的表达水平两组间差异无统计学意义。
除non-EC组中2例患者因一般情况差或个人拒绝未接受辅助化疗外,其余患者(98.4%,124/126)均接受了术后辅助化疗。EC组化疗方案均为TP方案[(platinum(cisplatin or carboplatin) plus paclitaxel,铂类联合紫杉醇化疗],non-EC组除1例为PAC方案[(platinum (cisplatin or carboplatin) plus epirubicin and cyclophosphamide, 铂类联合表阿霉素和环磷酰胺化疗]外,其余均为TP方案。两组患者接受化疗的周期数差异无统计学意义。
2.3 两组患者生存及预后情况的比较 随访截止日期为2016年12月25日,EC组2例失访(随访率95.7%),non-EC组5例失访(随访率93.8%)。结果(表2)表明:有随访资料的119例患者,其平均随访时间为51.1个月(15~105个月),共25例(21.0%)死亡,34例(28.6%)复发,94例(79%)存活。EC组、non-EC组的死亡率分别为4.5%(2/44)、30.7%(23/75),差异有统计学意义(P=0.001)。EC组、non-EC组的复发率分别为4.5%(2/44)、42.7%(32/75),差异有统计学意义(P<0.001)。所有接受化疗且有随访资料的患者中,79.7%(94/118)的患者对化疗敏感。其中EC组、non-EC组的化疗敏感率分别为93.3%(42/44)、71.2%(52/73),差异有统计学意义(P=0.004)。
采用Kaplan-Meier法绘制生存曲线(图1):EC组5年总生存率为94.4%,中位生存时间为81.97个月;non-EC组5年总生存率为64.2%,中位生存时间为51.70个月。EC组患者5年OS明显高于non-EC组(P=0.003,表2),且EC组患者5年PFS显著高于non-EC组(P=0.002)。

表2 两组OCCC患者的生存情况对比
EC组共46例,失访2例; non-EC组共80例,失访5例,未化疗2例
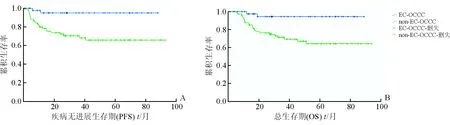
图1 Kaplan-Meier法绘制两组OCCC患者的生存曲线
2.4 OCCC患者预后影响因素分析
2.4.1 PFS影响因素 单因素分析结果(表3)显示:术前血CA125水平(≤200 U/mL或>200 U/mL)、腹水细胞学状态、是否满意瘤体减灭、肿瘤分期、是否存在淋巴结转移、是否起源于EC、是否对化疗敏感均是影响OCCC患者PFS的重要预后因素。将上述因素共同作为协变量进行Cox风险回归多因素分析结果(表4)显示:仅FIGO分期和化疗敏感性是影响PFS的独立预测因素。
2.4.2 OS影响因素 OS的单因素分析结果(表3)显示:术前血CA125水平(≤200 U/mL或>200 U/mL)、腹水细胞学状态、是否满意瘤体减灭、是否双侧卵巢受累、肿瘤分期、是否起源于EC、是否对化疗敏感均是影响OS的重要因素。对上述变量进一步行多因素分析,结果(表4)显示:仅化疗敏感性是影响OS的独立预测因素。
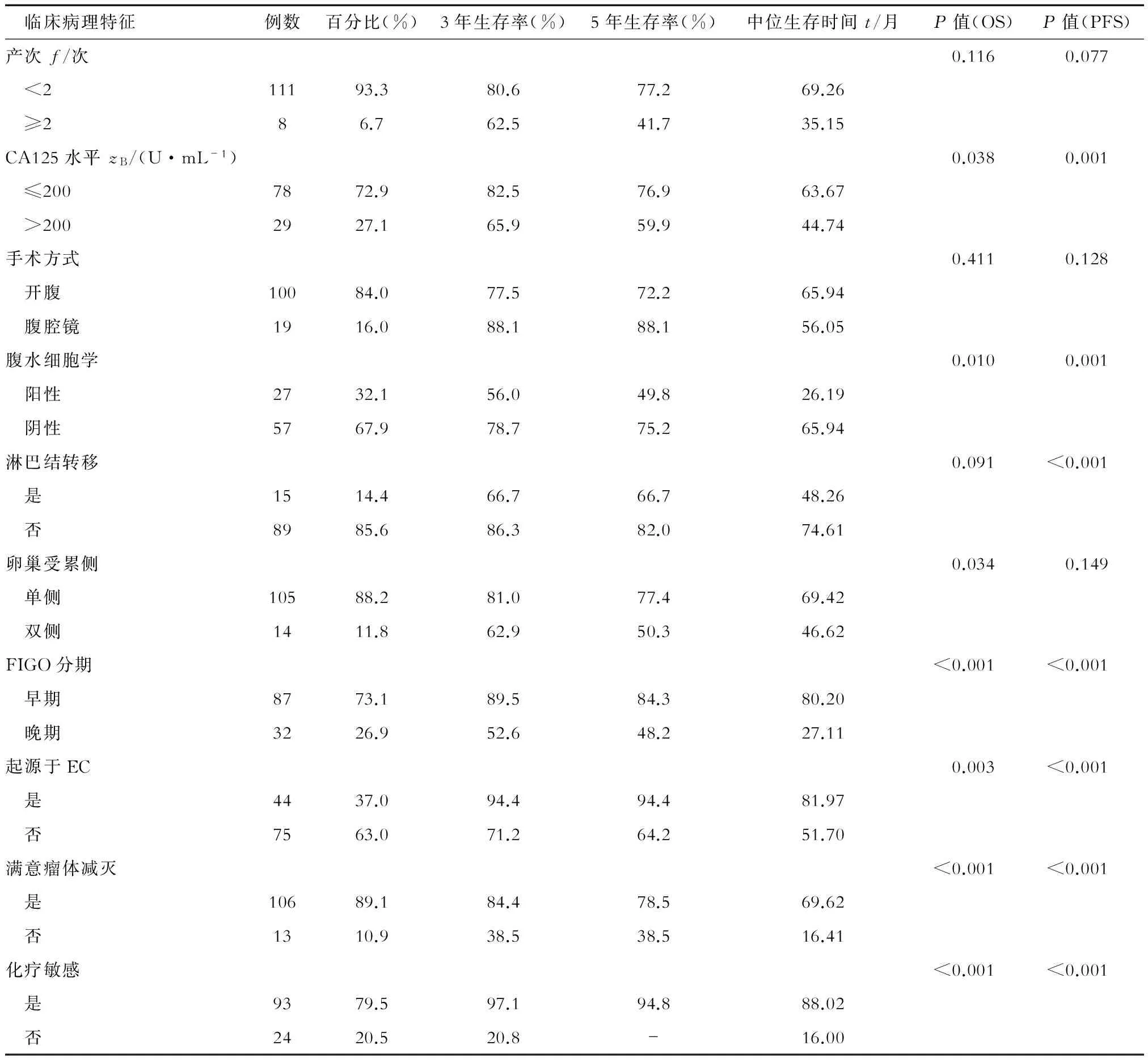
表3 OCCC患者OS、PFS影响因素单因素分析结果
FIGO: International Federation of Gynecology and Obstetrics, 国际妇产科联盟; “-”表示无对应数据; OS:总生存期; PFS:无进展生存期
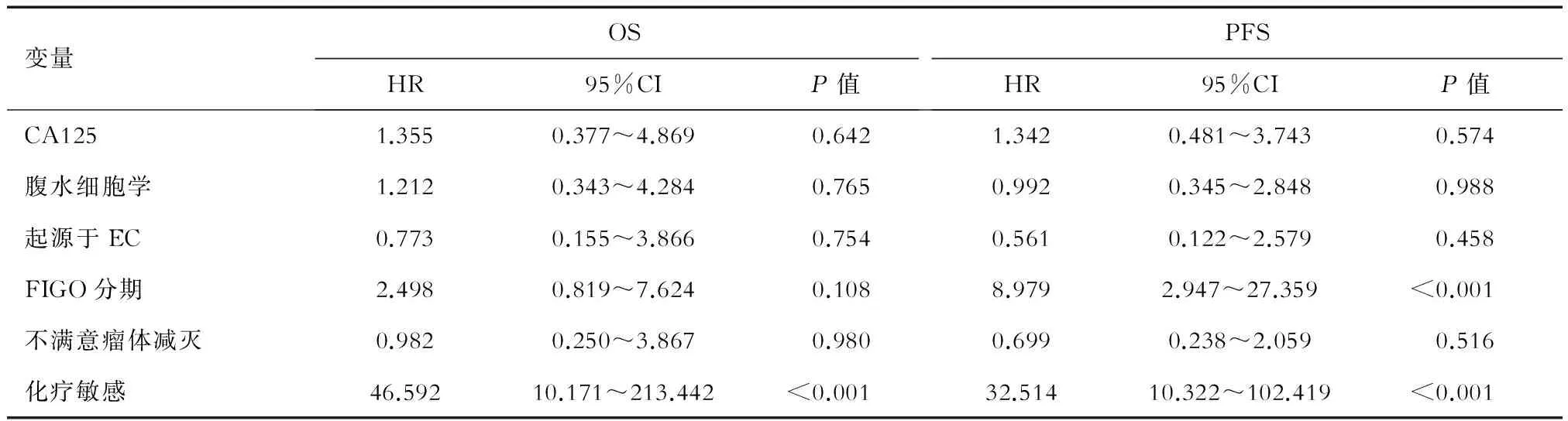
表4 OCCC患者OS、PFS影响因素多因素分析结果
FIGO: International Federation of Gynecology and Obstetrics, 国际妇产科联盟; OS:总生存期; PFS:无进展生存期
3 讨 论
EM可能在基因突变或微环境改变等影响下发生恶变,而由EM恶变形成的EOC被称为子宫内膜异位症相关性卵巢癌(EAOC),主要包括OCCC和卵巢子宫内膜样癌。以下因素被认为与EM增加卵巢癌的风险有关:不典型EM(可视为一种“癌前病变”),EM组织内的基因突变,血红素或游离铁诱导的氧化应激,慢性炎症,类固醇激素(包括雌激素和孕激素)[2,10]。但EAOC与非起源于EM的OCCC和卵巢子宫内膜样癌相比,到底能否代表一类独立存在的疾病,目前仍有争议。以往关于EAOC的研究中对于EAOC的定义并不一致,有的严格按照Scott标准,即镜下看到EM与OCCC有明确的移行关系[11],有的则将在同一切片中同时存在OCCC和EM即定义为EAOC[6,12]。这可能是导致研究结果不一致的原因之一。本研究以EAOC中最常见的病理亚型OCCC为对象,严格按照EM恶变的定义将OCCC分为EC起源和非EC起源,比较两组患者的临床预后,具有首创性。
本研究中EC恶变OCCC患者占所有OCCC患者的36.5%(46/126),与文献[13-14]报道一致。临床特征分析显示,EC组患者平均发病年龄较non-EC组更早。这一年龄上的差异可能是由于内膜异位病灶本身存在的基因缺陷或游离铁诱导的氧化应激、慢性炎症刺激等因素而促进或加速了EOC的发生[15]。而另一部分观点认为EAOC诊断年龄更早与该组患者因更明显的临床症状或已知的EM病史而倾向于更频繁的盆腔或B超检查,从而提前检出卵巢肿瘤有关[12]。本研究中EC组的产次少于non-EC组,可能与产次少为EM发病的高危因素有关。两组患者的绝经状态无显著差异。EC组较non-EC组双侧卵巢受累率更低,这一差异可能与EC组的肿瘤起源有关——EC常表现为单侧卵巢囊肿,起源于此的OCCC可长期局限于囊内生长,因此较少累及对侧卵巢。以往有研究[8]报道EC起源与非EC起源的OCCC其原发肿瘤的大小并无显著差异,而本队列中EC组较non-EC组原发肿瘤更小,估计与取样有关。CA125是卵巢恶性肿瘤的预测指标,术前血CA125≤200 U/mL是满意瘤体减灭术和化疗敏感的可靠预测因素[16]。因此,本研究以200 U/mL为界值比较EC组和non-EC组的术前CA125水平,结果显示EC组中CA125≤200 U/mL的比例高达94.9%,远高于non-EC组(60.8%)。由于CA125水平与EOC分期相关,推测这一结果与EC组包含更多早期病例有关。
与以往大量研究[8,12,17]一致,本队列中EC组患者诊断时较non-EC组更多地处于FIGOⅠ期和Ⅱ期,并且EC组接受腹腔镜手术的比例显著高于non-EC组。这是因为相当一部分EC组患者术前诊断为卵巢内膜样囊肿,故选择了腹腔镜手术,尽管术中冰冻病理证实为OCCC,但因多数病例处于早期,仍然在腹腔镜下完成了分期手术。早期EOC的腹腔镜分期手术目前尚处于研究阶段,但有越来越多妇科肿瘤专家支持腹腔镜全面分期手术,理由是手术视野被放大后更清晰,病灶被更好地呈现,手术医师操作空间相对更大,并且腹腔镜分期手术组的生存预后与开腹手术组无显著差异[18-19]。本队列中,EC组患者术后无肉眼残留病灶的比例达100%,远高于non-EC组(81.3%)。这与EC组更多病例处于早期有关,提示起源于EC的OCCC与非起源于EC的OCCC相比,可能进展更缓慢,从而为诊断治疗提供了宝贵的时机。EC组腹水细胞学阳性率和淋巴结转移率均显著低于non-EC组,进一步提示EC来源的OCCC在肿瘤生物学行为上可能更具“惰性”,从而延缓了肿瘤的侵袭和转移。两组患者肿瘤的TP53、ER和PR阳性率无显著差异,合并其他病理类型(子宫内膜样癌、浆液性癌)的比例也无显著差异。
本队列中绝大部分患者均接受了术后辅助化疗,且化疗方案均为TP方案,两组患者的化疗疗程无显著差异,这有利于消除生存分析中化疗与否及其方案、疗程数对生存的影响。两组患者总的化疗敏感率为79.7%,与文献[20]报道一致。本队列中EC组患者的化疗敏感率远高于non-EC组,然而由于EC组大多数患者为FIGOⅠ~Ⅱ期病例,而non-EC组近一半为晚期病例,因此这是否真实反映了两组患者肿瘤对化疗的敏感性差异还有待进一步分析。
本研究随访数据显示,EC组较non-EC组5年复发率及死亡率均更低。Kaplan-Meier曲线也显示EC组较non-EC组有更好的OS和PFS。单因素分析显示除EC起源外,CA125水平、腹水细胞学、FIGO分期、满意瘤体减灭及化疗敏感性也是影响OCCC患者PFS和OS的重要因素,而淋巴结转移和双侧卵巢受累分别对PFS、OS有显著影响。然而,将这些因素混合后进行多因素Cox比例风险模型分析后发现,仅FIGO分期和化疗敏感性是预测OCCC患者PFS的独立因素,而影响患者OS的独立因素仅有化疗敏感性。Ye等[8]和Kim等[2]也发现在校正了分期、肿瘤是否彻底切除、化疗敏感与否等混杂因素后,起源于EC不再是OCCC患者获得更好OS或PFS的有利因素。这说明EC起源的OCCC患者可能因为相关症状而更易得到早期诊断、从而更易获得肿瘤完全切净并产生了更好的化疗敏感性,最终获得了更好的生存;而EC起源本身似乎并不是改善OCCC预后的原因。
作为一个单中心的回顾性分析,本研究仍然存在选择和监督偏倚。同时,在晚期OCCC病例中,隐藏着EC组织学证据的病灶原发部位有时难以找到,这可能使一部分EC起源的OCCC晚期病例被错误归类从而影响研究结果。由于OCCC的总体发病率较低,本研究仅纳入了46例起源于EC的OCCC,因此研究结果具有局限性,尚需样本量更大的多中心研究数据来检验。
基于本研究结果,有理由推测起源于EC的OCCC是一类独立的具有更惰性生物学行为、更好预后因素的OCCC亚型。然而,这一假设是否成立尚待分子生物学研究来检验。期待未来子宫内膜异位症恶变到卵巢癌这一复杂的过程能够被揭示,并发现若干个临床可检测、干预的关键环节,这将非常有利于对子宫内膜异位症恶变高危人群进行早期诊断和干预,改善其预后。
[ 1 ] PEARCE C L,TEMPLEMAN C,ROSSING M A,et al. Association between endometriosis and risk of histological subtypes of ovarian cancer:a pooled analysis of case-control studies[J]. Lancet Oncol, 2012,13(4):385-394.
[ 2 ] KIM H S, KIM T H, CHUNG H H, et al.Risk and prognosis of ovarian cancer in women with endometriosis: a meta-analysis[J]. Br J Cancer, 2014,110(7):1878-1890.
[ 3 ] SAMPSON J A.Endometrial carcinoma of the ovary arising in endometrial tissue in that organ[J]. Arch Surg, 1925, 9(1):111-114.
[ 4 ] SURYAWANSHI S, HUANG X, ELISHAEV E, et al.Complement pathway is frequently altered in endometriosis and endometriosis-associated ovarian cancer[J].Clin Cancer Res, 2014,20(23):6163-6174.
[ 5 ] KURMAN R J, SHIH I E M. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory[J]. Am J Surg Pathol, 2010,34(3):433-443.
[ 6 ] OREZZOLI J P, RUSSELL A H, OLIVA E, et al. Prognostic implication of endometriosis in clear cell carcinoma of the ovary[J]. Gynecol Oncol, 2008,110(3):336-344.
[ 7 ] WANG S, QIU L, LANG J H, et al. Prognostic analysis of endometrioid epithelial ovarian cancer with or without endometriosis: a 12-year cohort study of Chinese patients[J]. Am J Obstet Gynecol, 2013,209(3):241.
[ 8 ] YE S, YANG J, YOU Y, et al. Comparative study of ovarian clear cell carcinoma with and without endometriosis in People’s Republic of China[J]. Fertil Steril, 2014,102(6):1656-1662.
[ 9 ] SCOTT R B. Malignant changes in endometriosis[J]. Obstet Gynecol, 1953,2(3):283-289.
[10] BAYRAMOGˇLU H, DÜZCAN E. Atypical epithelial changes and mutant p53 gene expression in ovarian endometriosis[J]. Pathol Oncol Res, 2001,7(1):33-38.
[11] SAINZ DE LA CUESTA R, EICHHORN J H, RICE L W, et al. Histologic transformation of benign endometriosis to early epithelial ovarian cancer[J].Gynecol Oncol, 1996,60(2):238-244.
[12] WANG S, QIU L, LANG J H, et al. Clinical analysis of ovarian epithelial carcinoma with coexisting pelvic endometriosis[J]. Am J Obstet Gynecol, 2013,208(5):413.
[13] MACHADO-LINDE F, SNCHEZ-FERRER M L, CASCALES P, et al. Prevalence of endometriosis in epithelial ovarian cancer. Analysis of the associated clinical features and study on molecular mechanisms involved in the possible causality[J]. Eur J Gynaecol Oncol, 2015,36(1):21-24.
[14] 任凤岩, 王丹波, 姜彦多,等.卵巢透明细胞癌及其合并子宫内膜异位症的临床及病理分析[J].中国全科医学, 2007,10(17):1416-1419.
[15] MUNKSGAARD P S, BLAAKAER J. The association between endometriosis and ovarian cancer: a review of histological, genetic and molecular alterations[J]. Gynecol Oncol, 2012,124(1):164-169.
[16] ZENG J, YIN J, SONG X, et al. Reduction of CA125 levels during neoadjuvant chemotherapy can predict cytoreduction to no visible residual disease in patients with advanced epithelial ovarian cancer, primary carcinoma of fallopian tube and peritoneal carcinoma[J]. J Cancer, 2016,7(15):2327-2332.
[17] SCARFONE G,BERGAMINI A,NOLI S,et al.Characteristics of clear cell ovarian cancer arising from endometriosis: a two center cohort study[J].Gynecol Oncol, 2014,133(3):480-484.
[18] GHEZZI F, MALZONI M, VIZZA E, et al.Laparoscopic staging of early ovarian cancer: results of a multi-institutional cohort study[J]. Ann Surg Oncol, 2012,19(5):1589-1594.
[19] MONTANARI G, DI DONATO N, DEL FORNO S, et al. Laparoscopic management of early stage ovarian cancer: is it feasible, safe, and adequate? A retrospective study[J].Eur J Gynaecol Oncol, 2013,34(5):415-418.
[20] SHU C A, ZHOU Q, JOTWANI A R,et al.Ovarian clear cell carcinoma, outcomes by stage: the MSK experience[J].Gynecol Oncol, 2015,139(2):236-241.
