基于单中心的中国人群自发性冠状动脉夹层临床特征与治疗策略
2018-05-04黄浙勇杨虹波宋亚楠石洪涛戴宇翔李晨光徐世坤马剑英王齐兵钱菊英葛均波
黄浙勇, 杨虹波, 宋亚楠, 石洪涛, 戴宇翔, 李晨光, 陆 浩, 徐世坤, 黄 东, 马剑英, 姚 康, 张 峰, 王齐兵, 钱菊英, 葛均波
复旦大学附属中山医院心内科,上海 200032
自发性冠状动脉夹层(spontaneous coronary artery dissection,SCAD)是一种特殊类型的冠状动脉性心脏病,病理基础是内膜撕裂或外膜滋养血管出血导致中膜内血肿,可表现为急性冠脉综合征甚至猝死[1-2]。SCAD总体发病率较低,因此临床对其危险因素、临床特点认识有限,对其治疗策略的选择存在较大争议。近年来,随着冠状动脉造影(coronary angiography,CAG)、CT成像、血管内超声(intravascular ultrasound, IVUS)和光学相干断层扫描等影像新技术的发展及普及,SCAD检出率明显增加。本研究回顾性分析了我院近年收治的SCAD患者资料,结合文献探讨SCAD的临床特点及治疗策略。
1 资料与方法
1.1 一般资料 选择2015年3月至2016年12月于复旦大学附属中山医院单中心行CAG的16 526例患者进行回顾性分析,选择经CAG或IVUS证实为SCAD的患者。对所有诊断为SCAD的患者逐一调出原始病历和影像资料进行核实,结果由2名高年资主治医师或副主任医师审核决定。排除主动脉夹层伴冠状动脉撕裂,排除器械或外伤所致夹层。最后共筛选出17例SCAD患者。
1.2 诊断标准 参照Saw等[1-2]2014年提出的SCAD造影标准,将其分为3种类型,具体如下:Ⅰ型,典型的多个透光腔,单纯凭借造影即可确诊。Ⅱ型,≥20 mm的弥漫性狭窄,其中ⅡA型远端有正常血管,ⅡB型一直延伸至血管末梢。平滑性、突然变细是Ⅱ型的特点,藉此可与粥样硬化性病变相鉴别。冠脉内注射硝酸甘油不缓解,藉此排除血管痉挛。如不能确诊,经IVUS证实。Ⅲ型,<20 mm的局灶性或管状狭窄,类似粥样硬化性病变,需经IVUS证实。IVUS诊断SCAD的标准是清晰显示撕裂的内膜片和以此为分割的真腔和假腔[3]。动脉粥样硬化性病变的标准是造影存在血管狭窄或球囊扩张时低压力下存在凹痕或IVUS发现内膜斑块。
1.3 观察指标及治疗方案 收集患者基本信息、动脉粥样硬化危险因素(包括高血压、糖尿病、吸烟等)、临床诊断类型(如稳定型心绞痛、不稳定型心绞痛、ST段抬高型心肌梗死、非ST段抬高型心肌梗死、心源性死亡等),记录造影夹层位置及形态、冠状动脉的心肌梗死溶栓治疗(thrombolysis in myocardial infarction,TIMI)血流分级与治疗方案。所有患者均进行电话和门诊随访,部分患者完成影像学随访,统计主要不良心脏事件(major adverse cardiac events,MACE),如复发心绞痛、新发急性心肌梗死、严重心律失常、心力衰竭和心源性猝死等。
治疗方案由术者根据具体病情、与患者及其家属沟通后决定。保守治疗基本药物包括阿司匹林、氯吡格雷(或替格瑞洛)和β受体阻断剂,根据病情加用替罗非班、低分子肝素、他汀类、血管紧张素转化酶抑制剂(或血管紧张素受体阻滞剂)、硝酸酯类、钙通道阻滞剂等药物。经皮冠状动脉介入治疗(percucoronary intervention,PCI)以恢复冠脉血流为基础,如有可能,尽量选择长支架完全覆盖夹层累及区域。

2 结 果
2.1 基本人口学特征及一般资料 16 526例CAG患者中筛选出SCAD患者17例,其发病率为1.03‰。患者年龄26~67岁,平均(49.06±10.73)岁;男性4例(23.5%)、女性13例(76.5%)。9例(52.9%)患者存在动脉粥样硬化危险因素,如吸烟、高血压、糖尿病、高脂血症等,其中2例患者同时存在2个危险因素。其他合并症包括:甲状腺功能减退症1例、抑郁症1例、乳腺癌靶向化疗1例、3个月前引产史1例。所有患者均未发现自身免疫性疾病、结缔组织发育异常疾病、围产期、服用避孕药等病史。
本组患者均以急性冠脉综合征起病,其中ST段抬高型心肌梗死(ST-segment elevated myocardial infarction, STEMI)10例、非ST段抬高型心肌梗死(non-ST segment elevated myocardial infarction, NSTEMI)3例,不稳定型心绞痛(unstable angina , UA)4例。患者详细临床资料见表1。
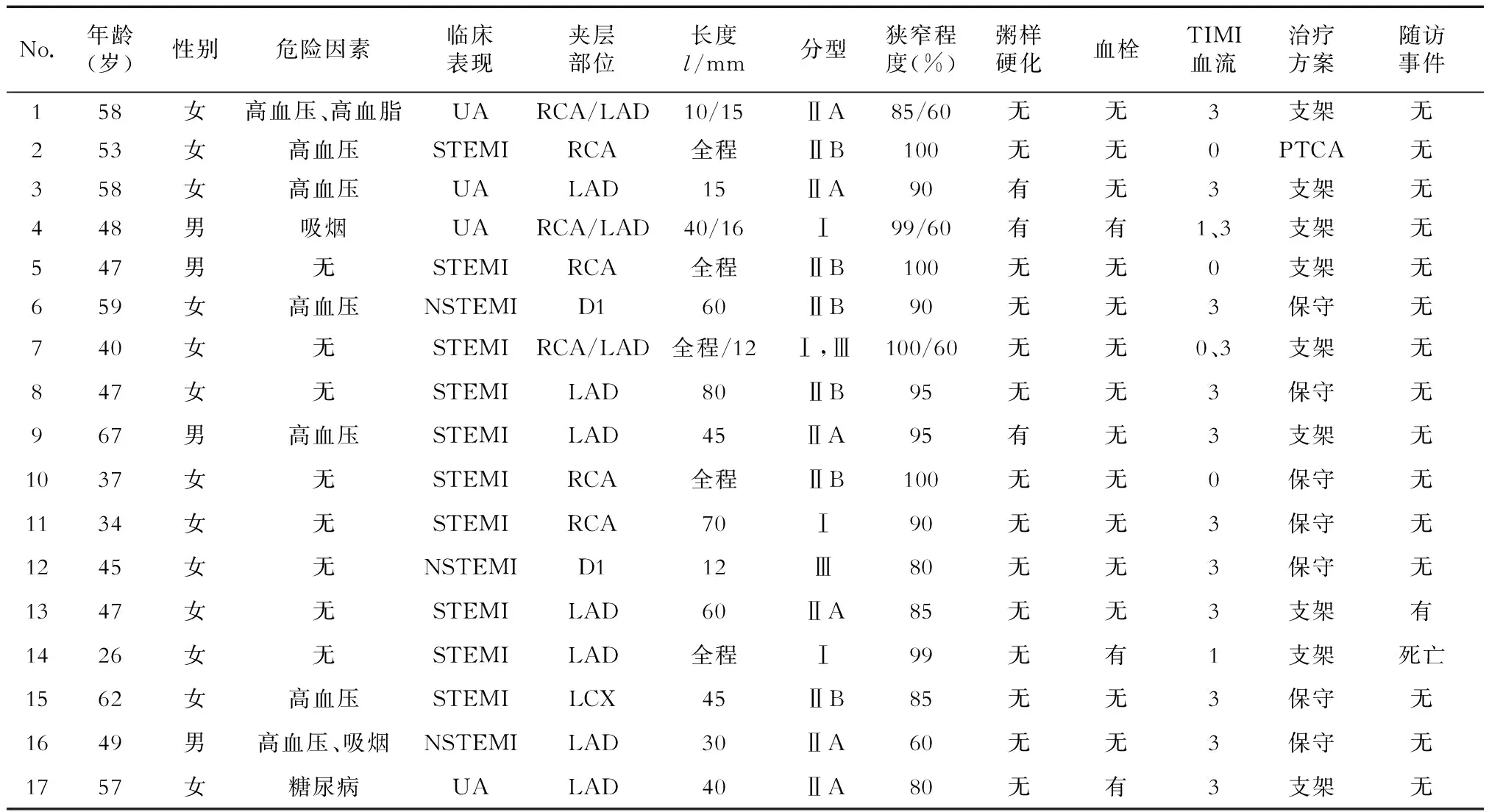
表1 自发性冠状动脉夹层患者的临床资料
RCA:right coronary artery(右冠状动脉);LAD:left anterior descending(左前降支);LCX:left circumflex artery(左回旋支);D1:第一对角支;PTCA:percutaneous transluminal coronary angioplasty(经皮冠状动脉成形术);UA:ustable angina(不稳定型心绞痛);STEMI:ST段抬高型心肌梗死;NSTEMI:非ST段抬高型心肌梗死
2.2 影像学特征 17例患者共发现20处夹层,3例患者有2支血管出现SCAD,其余均为1处夹层。从20处夹层累及部位分析,夹层主要发生于前降支(10例,50%)和右冠状动脉(7例,35%),少数累及对角支(2例,10%)和回旋支(1例,5%)。20处夹层冠脉造影分型为Ⅰ型5处、ⅡA型7处、ⅡB型6处、Ⅲ型2处。夹层远段的TIMI血流分级为0级4处、1级2处、3级14处。10例ST段抬高型心肌梗死患者中,靶血管血流TIMI 0级4例,其余均为TIMI 3级。20处SCAD部位中,3处有明确的血栓征象,该3例患者均有前向血流。所有患者中仅3例有明确的动脉粥样硬化斑块IVUS或造影证据。
2.3 治疗及随访结果 7例患者保守治疗,临床随访期间无心绞痛发作。其中1例(病例10)为右冠状动脉全程弥漫性夹层形成,预计导丝难以进入真腔,介入治疗有技术难度,采取保守治疗,5个月后随访冠状动脉CTA,右冠状动脉血流通畅,残留少许内膜片。其余6例保守治疗患者夹层导致的狭窄程度在60%~90%,靶血管TIMI血流3级,血流动力学均非常稳定。6例患者中影像学随访2例,均恢复血流,1例无残余狭窄(病例11),1例残余20%左右狭窄(病例8,图1)。
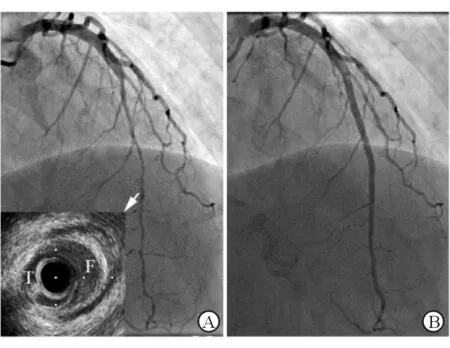
图1 SCAD患者保守治疗前后影像
A: IVUS图像(箭头),前降支ⅡB型自发性夹层形成; B:经保守治疗3个月后复查造影,血肿完全吸收,无残余狭窄
10例患者行介入治疗(表2),其中1例(病例2)为单独球囊扩张治疗,即右冠异常开口于左冠窦,右冠自近端开始均匀变细至后三叉处,左室后支完全闭塞,后降支近端狭窄99%,于右冠近段、后降支开口及左室后支病变处分别予球囊扩张后,血流恢复,未行支架植入。随访期间无明显心绞痛发作,术后3个月随访造影见右冠主支血管未见狭窄,左室后支近段狭窄40%,IVUS示左室后支近段壁内血肿残留。其余9例患者行支架置入术,共植入支架22枚,每例平均(2.44±1.13)枚。支架植入过程中,5例患者出现血肿,向远端、近端或分支扩展(图2)。其中2例患者出现MACE事件(病例13、病例14)。9例行支架植入治疗的患者中,6例患者既无临床随访MACE事件,也无复查造影残余狭窄。1例患者虽然无心绞痛等MACE事件,但由于有残余壁内血肿,其支架贴壁不良(病例9)。1例(病例13)患者前降支开口至近段长程壁内血肿,支架植入后血肿累及回旋支,导致急性后壁心肌梗死,经药物治疗后顺利出院,随访期间均未再出现心绞痛、心肌梗死或心力衰竭,9个月后回旋支血流恢复为TIMI 3级。1例(病例14)患者优势型前降支开口起自发夹层形成,TIMI血流1级,大面积前壁心肌梗死,于前降支近中段植入长支架,前降支近中段残留夹层,末梢端新发血肿导致远端TIMI血流0级,因血管过于远端,未进一步处理。术后第4天患者死于泵衰竭。
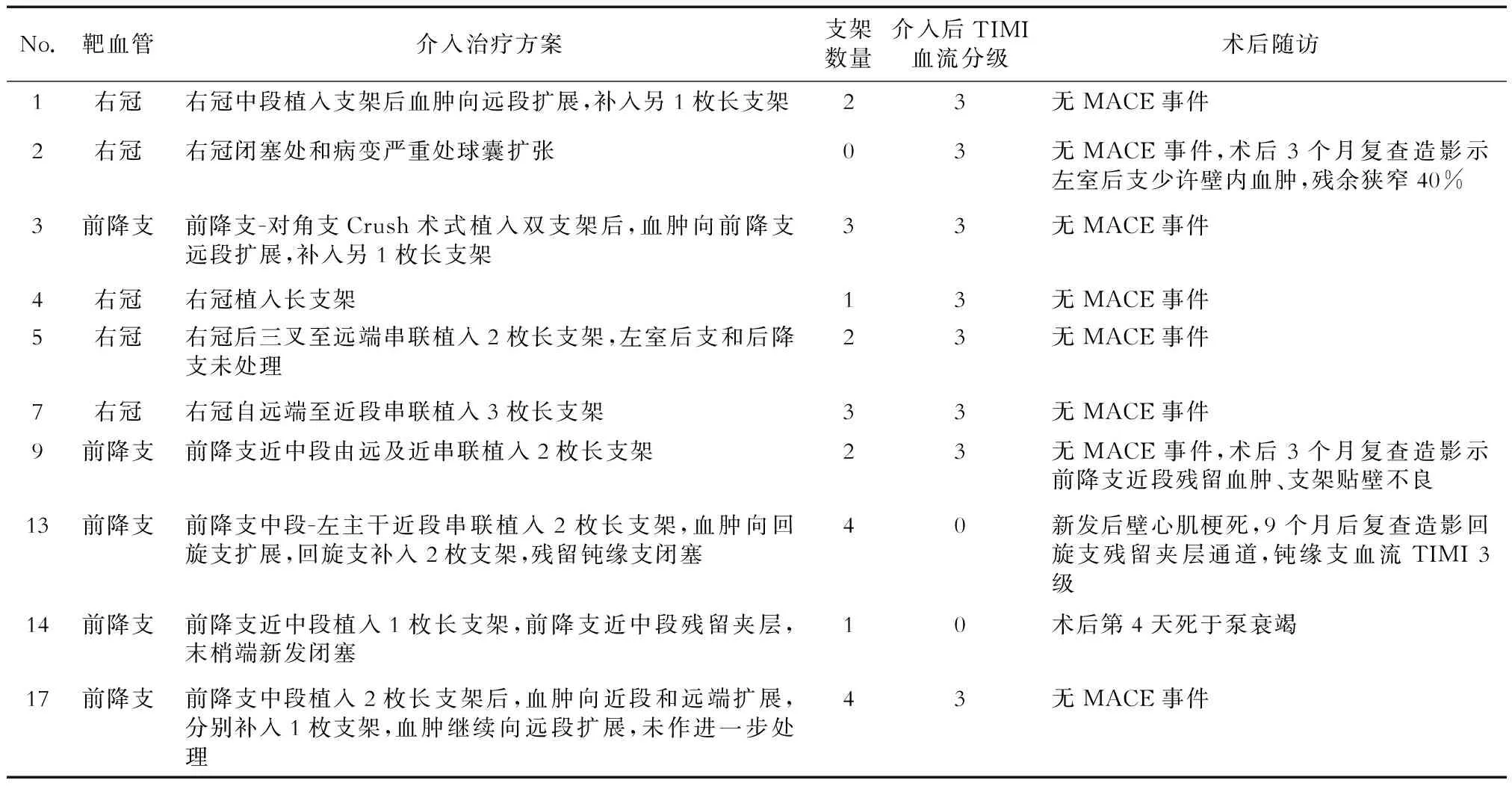
表2 接受介入治疗SCAD患者的临床资料
3 讨 论
SCAD好发于年轻女性,但危险因素和发病机制并不明确。早年认为妊娠和雌孕激素诱发SCAD;随后发现小部分SCAD患者与血管炎、风湿性疾病、中膜退行性变等相关;近年来认为肌纤维发育不良可能是SCAD的主要原因[4-5]。与众多研究一样,本组SCAD患者以中青年女性为主,除高血压病等传统冠心病危险因素相对少见外,动脉粥样硬化斑块亦少见。另外,本组患者未发现自身免疫性疾病病史、结缔组织发育异常疾病、围产期以及服用避孕药史。遗憾的是,本研究未进行周围血管的造影检查,因此,不能明确中国SCAD患者与肌纤维发育不良的相关性。
传统的冠状动脉夹层诊断及其美国国立心肺血液病研究所(National Heart, Lung , and Blood Institute,NHLBI)分型的研究对象主要是介入并发症患者,与SCAD有明显不同。近年来,Saw等[1-2]提出了SCAD新的影像学标准,分为3种类型,Ⅰ型为经典夹层类型,有多个透光腔征象;Ⅱ型和Ⅲ型为壁内血肿,表现为非特异性的、程度和长度不一的血管狭窄,特点是管壁光滑。本组患者20处夹层中,Ⅰ型夹层仅5处,其余均为单纯壁内血肿而无明确的真假腔之间的连通,仅凭造影往往难以确诊,极易与冠脉痉挛、粥样硬化等相混淆,导致漏诊和误诊。因此,介入医师应熟悉壁内血肿的造影表现,必要时行腔内影像学检查(OCT/IVUS)加以证实或排除。
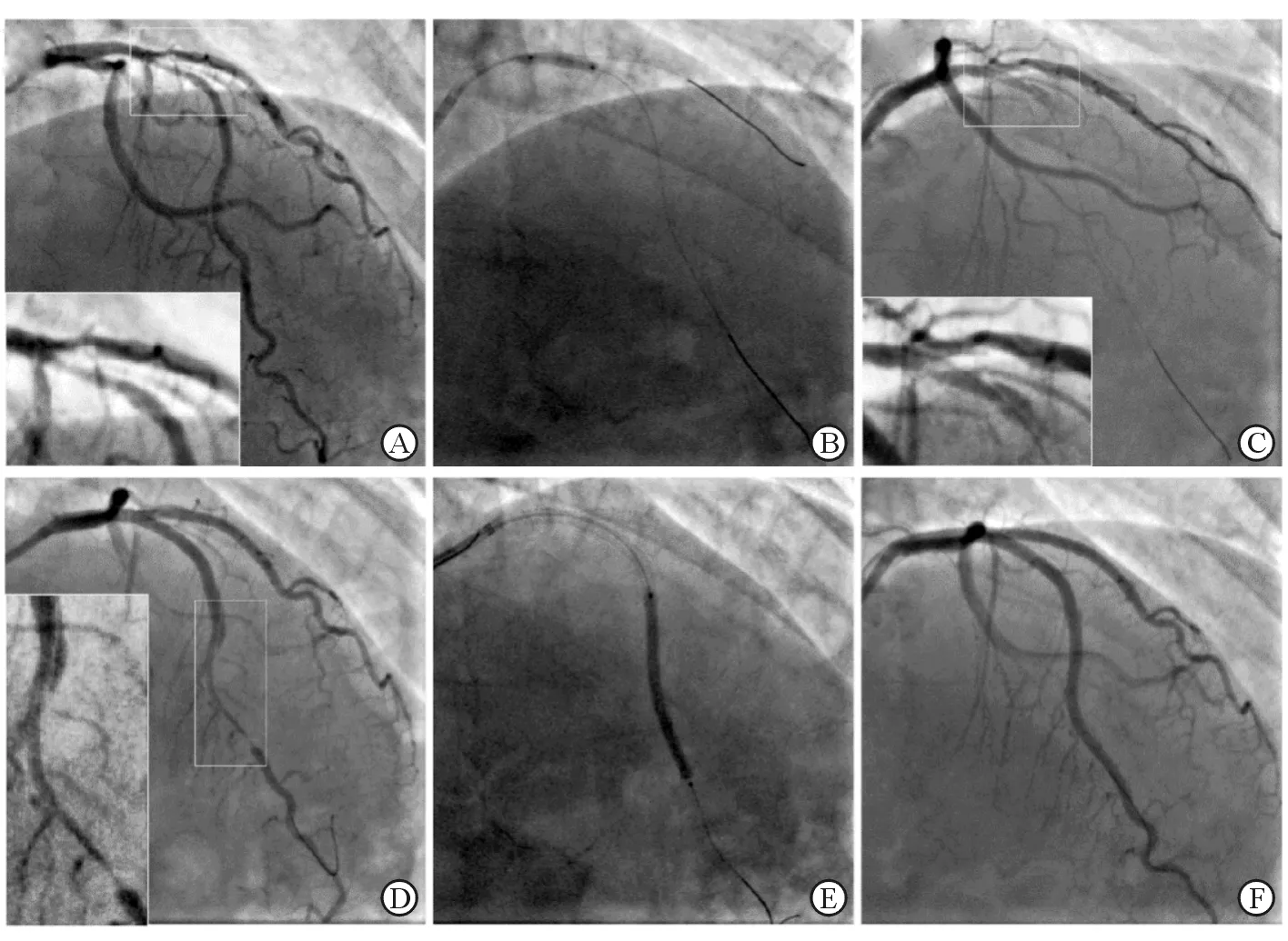
图2 SCAD患者接受介入支架植入治疗
A: 前降支-对角支分叉病变;B,C: IVUS证实为Ⅲ型壁内血肿,球囊扩张后转变为Ⅰ型夹层;D:采用Crush技术双支架植入后,血肿向前降支远段扩展;E:补救性串联植入长支架;F:最终结果良好
SCAD的处理目前尚无具体指南推荐。2008年我们曾报道SCAD患者保守治疗成功的案例[6]。本组7例患者采取保守治疗,影像学和临床随访均取得满意效果。1例患者接受PTCA治疗(球囊扩张夹层血管以恢复血流,未植入支架),也取得较好效果。但是,本组9例支架植入患者中5例患者出现血肿向远端、近端或分支扩展,其中2例出现临床MACE事件。因此,临床在处理此类疾病时,要根据患者的具体情况、权衡利弊,找出适合的治疗方法。
本研究结果提示,SCAD虽然属于广义的冠心病,但其治疗策略不同于粥样硬化斑块所致病变。首先,大部分SCAD患者无需血运重建。只要患者血流达TIMI 3级,药物保守治疗可能是比较合适的治疗选择。药物治疗以β受体阻滞剂(而不是他汀类)和阿司匹林为基础。另外,鉴于3.5%~10%的SCAD患者住院期间会出现病情进展[1],需要紧急血运重建治疗。因此,SCAD患者需要住院监护3~5 d。其次,支架置入不能成为SCAD的常规处理策略,部分原因如下:(1) SCAD常表现为临界病变,前向血流基本正常。本组10例ST段抬高型心肌梗死患者中,仅4例靶血管血流TIMI 0级,其余均为TIMI 3级,说明自发夹层具有自动缓解的特性。壁内血肿形成后局部张力增大,具有向两端扩展的自然趋势,带来的益处是血管阻塞程度缓解。这也有助于解释SCAD临床表现和预后较好的原因。(2)SCAD没有斑块,随着壁内血肿的吸收,管腔狭窄可显著缓解。研究[2,7-8]表明,大部分(73%~100%)壁内血肿能在1个月自行吸收,无需PCI。(3)SCAD支架植入出现并发症风险较高。研究[7-9]发现,SCAD的PCI手术成功率仅50%~75%。本组支架植入并发症高达55.6%,与文献报道基本一致。最后,介入策略最好仅局限于高危SCAD患者,如症状不稳定、血流动力学不稳定、心电学不稳定或左主干夹层患者[1]。SCAD患者冠状动脉夹层为自发性,因此任何外力(指引导管冲击、球囊扩张、支架释放等)均极易诱发新的夹层,尤其是球囊扩张或支架植入可能导致壁内血肿顺行或逆行扩大。
其他并发症包括:导丝进入远端血管真腔困难(Ⅰ型夹层时);远端小血管夹层难以支架治疗;夹层范围较大因而需要长支架或多个支架,支架内再狭窄风险增加;壁内血肿吸收后导致支架贴壁不良,支架内血栓风险增加等[10]。因此,PCI操作要特别注意以下几点:(1)指引导管等操作要小心,避免新发夹层;(2)导丝操作小心,避免进入夹层,最好采用OCT或IVUS指导;(3)支架植入要避免血肿扩张,采用长支架,两端超出血肿5~10 mm;如夹层过长,可采用“先远端-再近端-后中间”的支架植入策略[1];(4)如有条件,优选生物可降解支架,吸收后可有效避免血肿吸收后支架贴壁不良,减少支架内血栓风险[11];(5)理论上切割球囊有助于切破壁内血肿,减少支架植入时血肿扩展风险[12]。但过大切割球囊也存在冠脉破裂穿孔风险。
综上所述,缺乏冠心病危险因素的中青年女性出现急性冠脉综合征表现,要怀疑SCAD可能。介入医师应该熟悉SCAD的冠状动脉造影表现,并采用必要的腔内影像学加以证实或排除。SCAD一般采用药物保守治疗,高危SCAD患者PCI治疗时要慎防血肿扩展。
[ 1 ] SAW J,MANCINI G B J,HUMPHRIES K H.Contemporary review on spontaneous coronary artery dissection[J].J Am Coll Cardiol, 2016, 68(3): 297-312.
[ 2 ] SAW J. Coronary angiogram classification of spontaneous coronary artery dissection[J].Catheter Cardiovasc Interv, 2014, 84(7): 1115-1122.
[ 3 ] 张 峰, 葛均波, 钱菊英, 等.血管内超声在自发性冠状动脉夹层诊断和治疗中的初步应用[J]. 中华超声影像学杂志, 2005, 14(8): 565-568.
[ 4 ] OLIN J W, FROEHLICH J, GU X, et al. The United States Registry For Fibromuscular Dysplasia: results in the first 447 patients[J].Circulation, 2012, 125(25): 3182-3190.
[ 5 ] MICHELIS K C, OLIN J W, KADIAN-DODOV D, et al. Coronary artery manifestations of fibromuscular dysplasia[J].J Am Coll Cardiol, 2014, 64(10): 1033-1046.
[ 6 ] GE J B, HUANG Z Y, LIU X B, et al. Spontaneous coronary dissection associated with myocardial bridge causing acute myocardial infarction[J].Chin Med J (Engl), 2008, 121(23): 2450-2453.
[ 7 ] TWEET M S, ELEID M F, BEST P J, et al. Spontaneous coronary artery dissection: revascularization versus conservative therapy[J].Circ Cardiovasc Interv, 2014, 7(6): 777-786.
[ 8 ] LETTIERI C, ZAVALLONI D, ROSSINI R, et al. Management and long-term prognosis of spontaneous coronary artery dissection[J].Am J Cardiol, 2015, 116(1): 66-73.
[ 9 ] SAW J, AYMONG E, SEDLAK T, et al. Spontaneous coronary artery dissection: association with predisposing arteriopathies and precipitating stressors and cardiovascular outcomes[J].Circ Cardiovasc Interv, 2014, 7(5): 645-655.
[10] LEMPEREUR M, FUNG A, SAW J. Stent mal-apposition with resorption of intramural hematoma with spontaneous coronary artery dissection[J].Cardiovasc Diagn Ther, 2015, 5(4): 323-329.
[11] WATT J, EGRED M, KHURANA A, et al. 1-Year follow-up optical frequency domain imaging of multiple bioresorbable vascular scaffolds for the treatment of spontaneous coronary artery dissection[J].JACC Cardiovasc Interv, 2016, 9(4): 389-391.
[12] YUMOTO K, SASAKI H, AOKI H, et al. Successful treatment of spontaneous coronary artery dissection with cutting balloon angioplasty as evaluated with optical coherence tomography[J].JACC Cardiovasc Interv, 2014, 7(7): 817-819.
