ICU重型颅脑损伤患者行血管内控制性降温治疗的疗效分析
2018-05-04刘静易波李保林
刘静 易波 李保林
重型颅脑损伤(severe traumatic brain injury,sTBI)是由各种原因导致的昏迷超过6 h,GCS评分≤8分的颅脑损伤,是重症医学科常见创伤疾病之一,具有致残率高、死亡率高等特点[1]。sTBI所致的继发性脑损害是导致临床预后不良的主要原因,及时抢救、严密监护、早期诊断、手术治疗、防止继发性脑损伤是治疗sTBI患者的关键[2-3]。本研究旨在探讨ICU sTBI患者采用血管内控制性降温治疗的临床效果。
资料与方法
一、一般资料
选取2015年4月至2017年4月收治于郑州大学附属郑州中心医院ICU的100例sTBI术后患者作为研究对象,所有患者均符合sTBI诊断标准[4]。按照随机数字表法将入选患者分为对照组和观察组,每组50例。对照组:男性29例,女性21例;年龄19 ~62 岁,平均(36.3±4.2)岁;入院时患者 GCS 评分为(5.7±1.1)分。 观察组:男性 27例,女性 23例;年龄 20 ~61 岁,平均(37.3±4.1)岁;入院时患者 GCS 评分为(5.9±1.2)分。 排除并发严重心、肺、肝、肾疾病和严重糖尿病患者。2组患者年龄及性别组成、合并症、损伤原因以及入院时GCS评分等基本资料比较,差异无统计学意义(P>0.05)。患者家属均签署了知情同意书同意配合本研究。
二、治疗方法
2组患者入ICU后分别同时给予以下治疗。对照组采用标准治疗,包括:相关药物治疗、早期肠内营养、早期气管切开、早期镇静、镇痛、呼吸机辅助通气[氧浓度100%,呼气末正压(positive end-expiratory pressure,PEEP)8 ~10 cmH2O(1 cmH2O=0.098 kPa),1 h/次,每天8次,时程72 h]等;观察组在标准治疗的基础上于术后3 h内给予股静脉穿刺置入温控导管与预运行的血管内热交换系统相连接并运行,设定目标温度为34℃,维持至术后第3天,随后按0.25℃/h复温,至36℃时撤血管内热交换系统,自然复温。监测颅内压(intracranial pressure,ICP)以及动态 CT/MRI。
三、检测指标及检测方法
观察2组患者治疗前后的意识水平、ICP、动脉血氧分压、血氧饱和度等指标。使用GCS评分对患者进行意识状态评估,13 ~15分为轻度昏迷,9 ~12分为中度昏迷,3 ~8分为重度昏迷。采用经颅多普勒血流分析仪监测ICP的变化。所有患者分别于治疗前及治疗3 d后抽取患者桡动脉血2 mL,行外周动脉血血气分析,检测氧代谢指标。
四、统计学分析
采用spss17.0软件进行统计学分析。对照组和观察组的意识水平评分、ICP、动脉血氧分压、血氧饱和度等采用均数±标准差(±s)表示,组间比较采用独立样本t检验,治疗前和治疗后的组内比较采用配对样本t检验;性别、合并症、损伤原因等采用率或构成比(%)表示,组间比较采用 χ2检验,以P<0.05为差异具有统计学意义。
结 果
一、2组患者治疗前后意识状态变化对比
2组患者在入院时的GCS评分无明显差异(P>0.05),治疗后,2组患者GCS评分均有升高 (P<0.05),观察组的GCS评分明显高于对照组,差异具有统计学意义(P<0.05)。详细内容见表1。
表1 2组治疗前后GCS评分变化对比(±s)

表1 2组治疗前后GCS评分变化对比(±s)
t值 P值治疗前 治疗后对照组 50 5.7±1.1 6.3±1.2 7.953 0.008观察组 50 5.9±1.2 7.8±1.1 10.862 0.000 t值 0.302 9.129 P值 0.776 0.000组别 例数 GCS评分
二、2组患者治疗前后ICP变化对比
治疗前,2组患者的ICP水平比较,差异无统计学意义(P>0.05);治疗后,2组患者 ICP水平较治疗前均显著下降,差异具统计学意义(P<0.05);且治疗后,观察组患者ICP水平显著低于对照组,差异具有统计学意义(P<0.05)。详细信息见表2。
表2 2组患者治疗前后颅内压水平比较(±s)
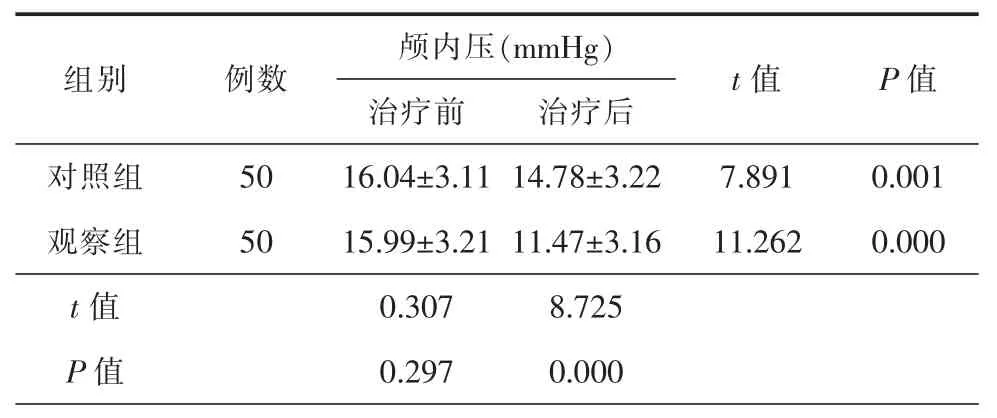
表2 2组患者治疗前后颅内压水平比较(±s)
?
三、2组患者治疗前后动脉血氧分压、血氧饱和度指标的分析
治疗前,2组动脉血氧分压及血氧饱和度水平比较,差异无统计学意义(P>0.05)。治疗后,2组动脉血氧分压及血氧饱和度均显著上升,且与对照组相比,观察组动脉血氧分压及血氧饱和度上升幅度更高,差异具有统计学意义(P<0.05)。详细信息见表3。
讨 论
sTBI患者除发病或者受伤瞬间受到的原发性损伤外,伤后持续数小时至数天的继发性脑损害对于患者病情及预后具有不可忽视的重要作用[5]。sTBI后继发性脑损害包括脑细胞挫伤、脑水肿、坏死、颅内积血等,可造成脑动脉闭塞、脑血流减少,导致ICP增高、脑组织缺血缺氧、炎性递质释放、血管内皮损害及微循环障碍等,如果不能及时阻断这一过程的进展,将会加重神经元损害并促进神经胶质细胞增生,最终导致严重的继发性脑损害[6-7]。由此可见,防治继发性脑损害与治疗原发性脑损伤同样重要。近年来研究发现亚低温对sTBI具有显著的脑保护作用,明显降低sTBI患者的病死率[8]。血管内控制性降温相对于普通体表物理降温具有降温迅速、降温效果确切、维持温度稳定等优势。目前对于降温治疗的最佳时机(伤后24 h内)和最佳温度(35 ~36℃)的意见比较一致,但有关亚低温治疗时程有争议。国外有学者提倡所有患者一律24 ~48 h短时程治疗;也有学者主张进行长时程治疗,但长时间的血管内控制性降温可增加导管相关感染率同时也可导致患者出现凝血功能障碍,增加大出血的风险[9-11]。为了使外伤后的脑组织达到亚低温目的同时减少并发症,通常联合镇静、镇痛,并将治疗时程设定为2 ~4 d[12]。
表3 2组患者治疗前后动脉血氧分压、血氧饱和度指标比较(±s)
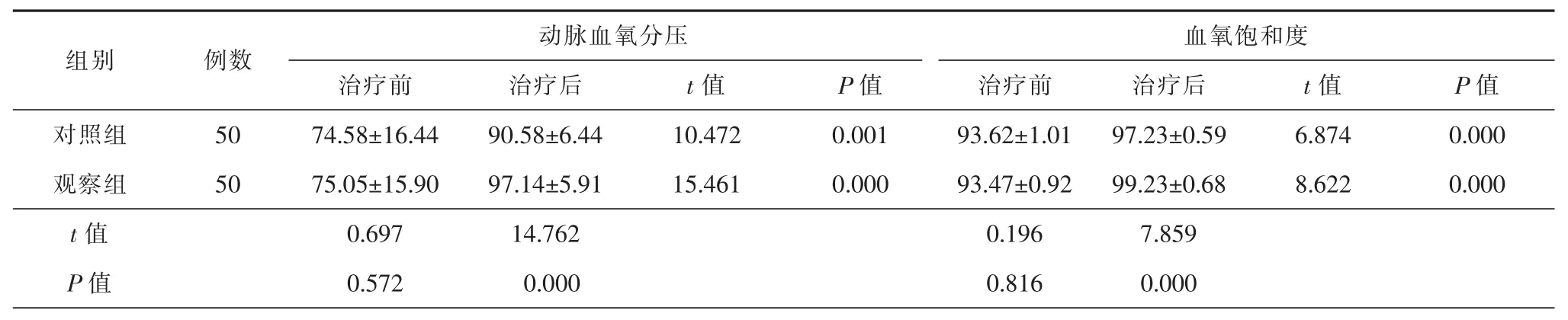
表3 2组患者治疗前后动脉血氧分压、血氧饱和度指标比较(±s)
血氧饱和度治疗前 治疗后 治疗前 治疗后对照组 50 74.58±16.44 90.58±6.44 10.472 0.001 93.62±1.01 97.23±0.59 6.874 0.000观察组 50 75.05±15.90 97.14±5.91 15.461 0.000 93.47±0.92 99.23±0.68 8.622 0.000 t值 0.697 14.762 0.196 7.859 P值 0.572 0.000 0.816 0.000动脉血氧分压组别 例数t值 P值 t值 P值
血管内控制性降温可以降低脑氧代谢、脑耗氧量和葡萄糖消耗量,减少脑组织乳酸堆积。sTBI患者应用亚低温来治疗时,体温每下降1℃,能量消耗减少5.9%,且体温下降与能量消耗减少接近线性关系。颅脑损伤后脑脊液和脑微透析液中乳酸水平升高,亚低温治疗能够减缓乳酸升高水平,甚至不升高,降低血脑屏障的通透性,减轻脑水肿。亚低温治疗可显著降低sTBI患者血清中肿瘤坏死因子-α、白细胞介素-6、血清皮质醇和血糖水平[13-14]。sTBI时机体发生剧烈的应激反应,短期即会出现应急激素水平明显升高,尽快实施亚低温治疗可减轻应激反应,降低皮质醇水平,而与血糖相关的激素水平的异常增高会导致血糖升高,采用亚低温治疗时由于应激反应降低,血糖水平也会同步降低[15]。亚低温治疗能够降低患者ICP,减轻脑水肿,改善脑灌注,从而有效保护中枢神经功能,改善颅脑损伤患者的预后[16]。亚低温治疗可显著降低sTBI患者的病死率和致残率,相对于仅行对症支持治疗维持腋温36.5 ~37.5℃的sTBI患者,给予亚低温治疗保证肛温32 ~34℃,维持3 ~4 d可明显降低患者病死率和致残率[17-18]。亚低温治疗技术近年来在基础研究领域发展非常迅速,在sTBI患者中的应用也非常普遍,但临床治疗选择方式并无统一标准,各有优缺点,比如利用冷液体输注法能够进行亚低温治疗但同时也可能升高患者ICP[19]。最新有研究显示利用亚低温联合硫辛酸给予sTBI患者实施治疗效果非常好,可以预见的是在将来的sTBI患者治疗过程中应用机械通气、脉搏轮廓温度稀释连续心排量测定技术、连续肾脏替代疗法等联合治疗技术将成为趋势[20]。加强亚低温治疗技术的学习和使用过程中并发症的观察,及时分析和处理,不断调整治疗方案是提高救治成功率、改善患者预后的关键。
血管内控制性降温对sTBI具有可靠的保护作用,本研究结果表明,2组患者治疗后脑氧代谢水平及ICP水平均较治疗前有所改善,且治疗后观察组患者ICP水平较对照组改善更为明显,这都为患者的后续康复治疗提供了良好的基础。
综上所述,血管内控制性降温治疗是一系列建立在循证医学基础上的专家推荐方案与指南的结合,显著改善了sTBI患者的脑氧代谢、降低了ICP,也提高了抢救成功率,改善其预后,值得在临床应用上推广。
[1] 薛洪利,张国华,于春泳,等.香丹注射液治疗急性重型颅脑损伤的内皮素含量与临床疗效观察[J].国际神经病学神经外科学杂志,2009,36(6):492-494.
[2] Adelson PD,Wisniewski SR,Beca J,et al.Comparison of hypothermia and normothermia after severe traumatic brain injury in children(Cool Kids):a phase 3,randomised controlled trial[J].Lancet Neurol,2013,12(6):546-553.
[3] Zhang Y,Yang Y,Tang H,et al.Hyperbaric oxygen therapy ameliorates local brain metabolism,brain edema and inflammatory response in a blast-induced traumatic brain injury model in rabbits[J].Neurochem Res,2014,39(5):950-960.
[4] 高亮.重型创伤性颅脑损伤:加强神经外科和重症监护治疗原则的结合[J].中华创伤杂志,2012,28(8):676-679.
[5] Sukoff MH.Effects of hyperbaric oxygenation[J].J Neurosurg,2001,95(3):544-546.
[6] Rosenfeld JV,Maas AI,Bragge P,et al.Early management of severe traumatic brain injury[J].Lancet,2012,380(9847):1088-1098.
[7] 王忠诚,赵元立.加强颅脑外伤临床基础研究提倡规范化治疗[J].中华神经外科杂志,2001,17(3):133-134.
[8] 杨磊,冯东侠.颅脑外伤脑氧监测的研究现状和进展[J].实用临床医药杂志,2010,14(7):140-142.
[9] SchellRM,Cole DJ.Cerebralmonitoring:jugularvenous oximetry[J].Anesth Analg,2000,90(3):559-566.
[10] Toet MC,Lemmers PM.Brain monitoring in neonates[J].Early Hum Dev,2009,85(2):77-84.
[11] Chatfield DA,Brahmbhatt DH,Sharp T,et al.Juguloarterial endothelin-1 gradients after severe traumatic brain injury[J].Neurocrit Care,2011,14(1):55-60.
[12] 李娜,程晋成,王水平,等.脑脊液和血清内皮素-1,白介素-1β,白介素-6检测对急性颅脑损伤严重程度的评估意义[J].现代检验医学杂志,2013,28(5):77-80.
[13] 石磊,黄书岚.急性颅脑损伤患者血清ET1、SE-CAD及镁离子的动态变化与意义[J].中国临床神经外科杂志,2013,18(9):535-536.
[14] Clifton GL,Jiang JY,Lyeth BG,et al.Marked protection by moderate hypother-mia after experimental TBI[J].J Cereb Blood Flow Metab,1991,11(1):114-121.
[15] Clifton GL,Miller ER,Choi SC,et al.Lack of effect of induction of hypothermia after acute brain injury[J].N Eng J Med,2001,344(8):556-563.
[16] Clifton GL,Miller ER,Choi SC,et al.Hypothermia on admission in patients with severe brain injury[J].J Neurotrauma,2002,19(3):293-301.
[17] Kraitsy K,Uecal M,Grossauer S,et al.Repetitive long-term hyperbaricoxygentreatment(HBOT)administeredafterexperimental traumatic brain injury in rats induces significant remyelination and a recovery of sensorimotor function[J].PLoS One,2014,9(5):e97750.
[18] Peleg RK,Fishlev G,Bechor Y,et al.Effects of hyperbaric oxygen on blood glueose levels in patients with diabetes np llitus,stroke or traumatic brain injury and healthy volunteers:a prospective crossov,controlled trial[J].Diving Hyperb Med,2013,43(4):218-221.
[19] Timmons SD,Ullman JS,Eisenberg HM.Craniectomy in diffuse traumatic brain injury[J].N Engl J Med,2011,365(4):373;author reply 376.
[20] Macmillan CS,Andrews PJ,Easton VJ.Increased jugular buld saturation is Associated with poor outcome in traumatic brain injury[J].J Neurol Neurosurg Psychiatry,2001,70(1):101-104.
