微创手术治疗胃间质瘤的效果及临床预后分析*
2018-05-03蒋传伟夏灿灿江志伟
蒋传伟,王 刚,赵 健,刘 江,夏灿灿,江志伟
(南京大学医学院附属金陵医院,江苏 南京,210002)
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是一组由未分化或多能的梭形或上皮样细胞组成,起源于胃肠道间质干细胞的肿瘤[1]。截至目前,手术切除联合术后化疗是治疗间质瘤最有效的方法。与胃癌不同的是,GIST以血行转移与腹腔种植转移为主,淋巴结转移率极低[2],因此手术治疗胃间质瘤时无需清扫淋巴结,这一特征更利于微创手术治疗胃间质瘤。随着微创技术的发展,腹腔镜、机器人手术用于胃间质瘤的治疗逐渐增加,多项研究表明了微创技术治疗胃间质瘤的可行性[3-7],但亦有专家质疑微创治疗难以保证胃间质瘤包膜的完整性,复发率增加[8],并且关于综合微创治疗胃间质瘤的适应证、安全性及远期预后的研究尚不多见,现回顾总结2008年1月至2016年5月南京军区南京总医院收治的67例胃间质瘤的诊疗经过及预后。
1 资料与方法
1.1 临床资料 回顾分析2008年1月至2016年5月南京军区南京总医院胃肠外科收治的67例胃间质瘤患者的病例资料。纳入标准:(1)年龄>18岁;(2)术前经腹盆腔增强CT、胃镜及超声内镜检查证实为无远处转移的单发胃壁肿瘤,临床高度怀疑间质瘤;(3)未接受新辅助治疗。排除标准:(1)合并第二原发肿瘤(如胃癌、直肠癌等);(2)手术时合并切除其他脏器;(3)术前行格列卫新辅助治疗;(4)术后病理证实为非间质瘤。共纳入67例胃间质瘤患者,完整切除肿瘤。本组患者中24例选择开腹手术(开腹组),43例选择微创胃间质瘤切除术(微创组),微创方式包括腹腔镜与机器人两种。患者均经病理证实为胃间质瘤,并根据2008年美国国立卫生院(NIH)推荐的危险度分级标准[9]进行分类。观察项目包括患者临床资料(年龄、性别、症状等)、肿瘤特征(肿瘤直径、位置、出血、坏死、病理结果)、手术相关因素(手术时间、术中出血量、术后首次通气时间、总住院时间、并发症)、远期预后效果(死亡率、复发率)。术后并发症定义为术后30 d内发生出血、切口液化、梗阻、吻合口瘘等症状。
1.2 围手术期管理 围手术期遵循加速康复外科[10]理念,两组均使用快速康复外科理念统一处理,67例患者均无糖尿病及肿瘤引起的梗阻情况,因此术前不严格要求限制饮食,不放置鼻胃管,要求患者术前晚进流质饮食,术前10 h口服10%葡萄糖水1 000 ml,术前2 h服用10%葡萄糖水500 ml。术中限制性补液并维持患者体温。术后限制性补液,预防性应用抗生素,予以静脉联合口服止痛药物,止痛药物以非甾体类抗炎药代替传统的阿片类药物,少量多次饮水,鼓励患者下床活动。
1.3 手术方法 开腹组患者取传统体位,采用传统术式施术。腹腔镜组:患者取分腿位,脐下为观察孔,分别于脐上方5 cm与两侧锁骨中线交点处穿刺Trocar,左侧腋前线近肋弓下穿刺12 mm Trocar。建立CO2气腹,压力维持在10~15 mmHg。术者立于患者左侧,第一助手立于术者对侧,第二助手立于患者两腿间,观察孔置入腹腔镜。机器人手术患者取头高脚低、左高右低、大字仰卧位。脐下做1 cm切口,穿刺12 mm Trocar,作为达芬奇机器人镜头观察孔。建立CO2气腹,压力维持在12~14 mmHg。分别于双侧腋前线肋缘下2 cm、双侧锁骨中线平脐穿刺8 mm、8 mm、8 mm、12 mm Trocar,其中12 mm Trocar为辅助孔,位于左锁骨中线平脐水平,置入相应的机器人手术器械。腹腔镜与机器人手术均遵循非接触、少挤压的原则,精细操作,避免直接牵拉肿瘤,以免造成破裂。充分游离胃壁周围网膜后,腹腔镜手术用直线切割闭合器离断标本,使用腹腔镜取物袋取出肿瘤。机器人手术选择距肿瘤边缘2 cm环形切除,镜下胃壁全层缝合,浆肌层包埋。肿瘤位于食管贲门交界或近幽门时,则采用机器人的方式,局部切除缝合后行术中胃镜检查,如导致狭窄,则采用远端胃及近端胃切除术,远端胃切除采用毕Ⅱ式吻合,近端胃切除采取食管残胃吻合术。吻合均在机器人下完成消化道重建。行远近端胃切除吻合的患者留置腹腔引流管,其余均未放置腹腔引流管。
1.4 术后化疗 对于术后病理诊断为中、高度危险度的胃间质瘤患者,建议术后口服伊马替尼治疗,以防止复发。
1.5 随访 术后通过门诊及电话进行随访,术后每半年行平扫加增强CT检查;病理结果为高危的患者,每3个月复查一次,并根据临床表现及CT结果酌情行胃镜检查。末次随访时间为2017年5月20日。
1.6 统计学处理 采用SPSS 23.0进行统计学分析,正态分布的计量资料采用独立样本t检验,偏态分布资料采用非参数检验;计数资料采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 入组患者的基本资料 2008年1月至2016年5月共入组67例胃间质瘤患者。其中微创组43例,开腹组24例,两组患者的临床病理特征见表1。两组患者年龄、肿瘤直径差异无统计学意义(P>0.05)。两组患者最常见的临床表现均为上腹不适,分别占51.16%(22/43)与54.17%(13/24);肿瘤多位于胃底,分别占60.47%(26/43)与58.33%(14/24)。微创组患者伴肿瘤出血8例(18.60%),开腹组患者肿瘤伴出血7例(29.17%),差异无统计学意义(P=0.32)。两组病理类型差异无统计学意义(P=0.46)。
2.2 治疗结果 两组均完成保持肿瘤完整性的R0切除,均未出现肿瘤破损。微创组无一例中转开腹。两组患者围手术期情况见表2。微创组43例患者中,26例行腹腔镜胃间质瘤楔形切除;15例行机器人手术,沿肿瘤边缘2 cm环形切除;2例因肿瘤较大且分别位于幽门及胃食管结合部,分别于机器人下行远端胃、近端胃切除术,以保证吻合口无狭窄。3例行术中联合胃镜检查,以保证消化道畅通无狭窄。开腹组中1例因肿瘤靠近贲门部伴明显营养不良,行近端胃切除加胃造口,术后早期行肠内营养。微创组术后发生1例并发症,为胃排空障碍;开腹组术后无并发症发生;两组术后并发症发生率差异无统计学意义(P=0.452)。两组手术时间、术中出血量、术后首次通气时间及术后住院时间差异均有统计学意义(P<0.05)。
2.3 生存分析结果 术后随访12~112个月,中位数44个月。两组中共有7例高度恶性潜能,术后6例口服伊马替尼化学药物治疗。微创组与开腹组3年未复发率分别为97.7%与100%,差异无统计学意义。微创组1例复发,术后病理为高度危险性,患者未遵医嘱行术后口服化疗药伊马替尼治疗,术后3年内复发,再次于我院行全机器人胃间质瘤切除术,现口服伊马替尼治疗,生存良好;余者均未见复发转移。两组生存率差异无统计学意义,表明微创治疗胃间质瘤并不影响患者的术后生存。
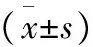
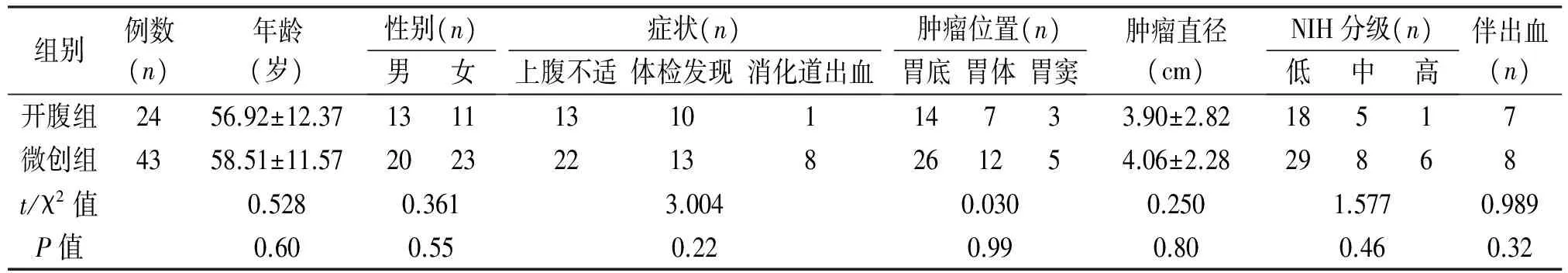
组别例数(n)年龄(岁)性别(n)男女症状(n)上腹不适体检发现消化道出血肿瘤位置(n)胃底胃体胃窦肿瘤直径(cm)NIH分级(n)低中高伴出血(n)开腹组2456.92±12.3713111310114733.90±2.8218517微创组4358.51±11.57202322138261254.06±2.2829868t/χ2值0.5280.3613.0040.0300.2501.5770.989P值0.600.550.220.990.800.460.32
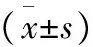
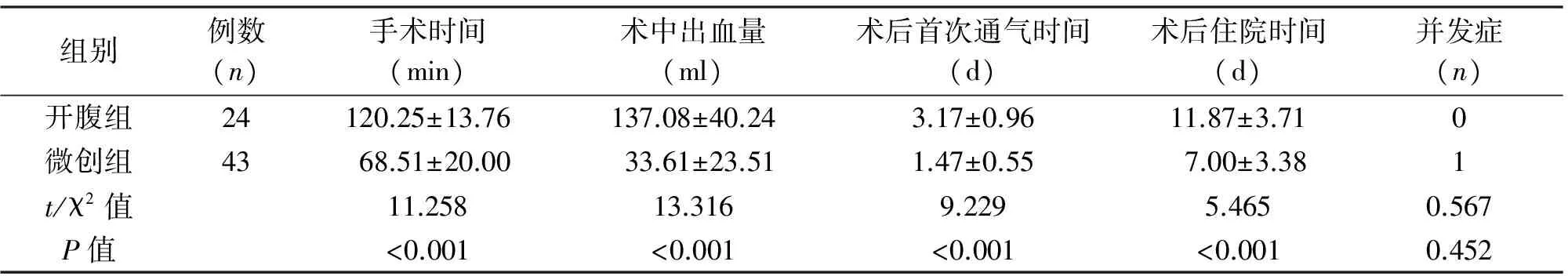
组别例数(n)手术时间(min)术中出血量(ml)术后首次通气时间(d)术后住院时间(d)并发症(n)开腹组24120.25±13.76137.08±40.243.17±0.9611.87±3.710微创组4368.51±20.0033.61±23.511.47±0.557.00±3.381t/χ2值11.25813.3169.2295.4650.567P值<0.001<0.001<0.001<0.0010.452
3 讨 论
3.1 微创手术可安全有效的切除胃间质瘤 Kim等[5]报道了一组多中心回顾性研究,比较了156例腹腔镜手术与250例开腹手术治疗胃间质瘤的效果,结果证明腹腔镜手术治疗胃间质瘤是安全的。Buchs等[3]报道了机器人下胃间质瘤楔形切除术,表明了机器人胃间质瘤切除术的安全性与可行性。Desiderio等[7]将机器人组与腹腔镜组、开腹组进行对比,发现机器人组术后肿瘤学安全性与其他两组效果相同。本研究中将腹腔镜手术与机器人共同纳入微创组,与开腹组相比,两组患者性别、年龄、临床表现等临床特征、肿瘤大小等肿瘤特征差异均无统计学意义,尤其肿瘤直径,它是决定肿瘤危险度、术后肿瘤复发率的重要指标之一[11],这大大提高了研究结果的说服力。
微创手术治疗胃间质瘤可明显减少术中出血量,缩短术后住院时间。本研究中微创组与开腹组术中出血量分别为(33.61±23.51) ml与(137.08±40.24) ml,与李鹏等[4]的报道基本相符;但本研究中微创组术后平均住院(7.00±3.38) d,李鹏等[4]报道平均(12.14±4.32) d,有一定差异,但与国外报道[6]相符。术后首次通气时间方面,Sasaki等[12]报道腹腔镜术后患者首次通气时间为2~3 d,本研究中微创组[(1.47±0.55) d]略早于Sasaki的报道,这可能与本研究围手术期遵循加速康复外科理念[9]有关,加快了肠道复苏。本研究中两组术中出血量、术后首次通气时间及术后住院时间差异均有统计学意义,微创组均优于开腹组,并发症发生率两组相比差异无统计学意义,表明相较开腹手术,微创手术治疗胃间质瘤明显具有优势。通过本研究认为,胃间质瘤患者无重大伴随症状(如严重营养不良)、重大手术史可能导致的严重腹腔粘连、合并第二原发肿瘤或转移时,微创治疗是安全、可靠的。
3.2 微创手术不影响肿瘤患者的远期生存 GIST的复发转移多发生于术后2~3年内[13],本研究入组患者术后随访12~112个月,中位数44个月。国外Novitsky等[14]随访了1996~2005年收治的50例腹腔镜胃间质瘤患者,结果显示3年生存率达96%,此研究还强调了间质瘤的大小、核分裂数及是否伴有溃疡出血、坏死是提示患者预后的重要因素。
3.3 微创手术的适应证 肿瘤大小、位置是决定微创手术的关键因素。由于GIST很少发生淋巴结转移,一般无需清扫淋巴结[2],这为微创GIST切除术提供了良好基础。对于胃前壁较小的胃间质瘤,行腹腔镜楔形切除不仅手术时间短,而且具有出血小、康复快的优点。目前腹腔镜手术治疗胃间质瘤的适应证尚存有一定争议,2007年NCCN更新的指南推荐直径5 cm及以下的肿瘤可接受腹腔镜切除。但成功施行腹腔镜下巨大GIST手术的报道并不罕见,Nguyen等[15]报道了直径超过10 cm的巨大GIST腹腔镜切除术,但随着胃间质瘤直径的增加,行腹腔镜楔形切除时不仅增加了肿瘤破裂的危险,而且增加了无肿瘤区域胃壁的切除,使胃腔进一步缩小。不仅如此,对于胃后壁、小弯侧及幽门、胃食管交界处的肿瘤,行腹腔镜手术可能引起消化道狭窄。但达芬奇机器人手术不仅可沿肿瘤边缘2 cm行R0环形切除,还可完成全镜下消化道重建。我中心的前期研究[16]表明,机器人镜下吻合是安全、有效的,并未增加吻合口瘘、吻合口狭窄的几率。Buchs等[3]的研究表明,机器人手术系统可完成食管胃结合部、胃十二指肠结合部较大胃间质瘤的不规则胃切除术。因此直径较小(≤5 cm)、位于胃前壁或大弯侧的肿瘤,宜行腹腔镜楔形切除术。肿瘤体积较大或边缘距贲门、幽门较近时,仅行局部剜除后缝合可能造成缝合处张力太大或引起贲门、幽门狭窄,因此需选择机器人行沿肿瘤边缘2 cm环形切除或不规则局部胃切除,甚至近端胃/远端胃切除。不论腹腔镜手术抑或机器人手术,术中均可联合胃镜检查保证无残余肿瘤及消化道通畅无梗阻,肿瘤太大及存在胃内多发间质瘤时,可视情况选择全胃切除术。
综上所述,微创手术治疗胃间质瘤是安全、有效的,具有出血少、康复快的优势,尤其位于幽门口、贲门口时,机器人方式具有更特别的优势。需要说明的是,患者随访时间不同(1~9年),术后生存率及复发率的统计有一定偏倚,因此需继续随访消除偏倚。本研究为回顾性研究,确切效果仍需大样本的前瞻性随机对照研究证实。
参考文献:
[1] 吴涛,刘玉村.胃肠间质瘤的临床特征与外科治疗原则[J].中华普通外科杂志,2007,22(11):880.
[2] DeMatteo RP,Lewis JJ,Leung D,et al.Two hundred gastrointestinal stromal tumors:recurrence patterns and prognostic factors for survival[J].Ann Surg,2000,231(1):51-58.
[3] Buchs NC,Bucher P,Pugin F,et al.Robot-assisted oncologic resection for large gastric gastrointestinal stromal tumor:a preliminary case series[J].J Laparoendosc Adv Surg Tech A,2010,20(5):411-415.
[4] 李鹏,黄振,赵宏,等.腹腔镜与开腹胃楔形切除术治疗胃间质瘤的对照研究[J].中华肿瘤杂志,2016,38(5):372-376.
[5] Kim IH,Kim IH,Kwak SG,et al.Gastrointestinal stromal tumors (GISTs) of the stomach:a multicenter,retrospective study of curatively resected gastric GISTs[J].Ann Surg Treat Res,2014,87(6):298-303.
[6] Tabrizian P,Sweeney RE,Uhr JH,et al.Laparoscopic resection of gastric and small bowel gastrointestinal stromal tumors:10-year experience at a single center[J].J Am Coll Surg,2014,218(3):367-373.
[7] Desiderio J,Trastulli S,Cirocchi R,et al.Robotic gastric resection of large gastrointestinal stromal tumors[J].Int J Surg,2013,11(2):191-196.
[8] Nishimura J,Nakajima K,Omori T,et al.Surgical strategy for gastric gastrointestinal stromal tumors:laparoscopic vs. open resection[J].Surg Endosc,2007,21(6):875-878.
[9] Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Hum Pathol,2008,39(10):1411-1419.
[10] 江志伟,黎介寿.快速康复外科——优化的临床路径[J].中华胃肠外科杂志,2012,15(1):12-13.
[11] Dematteo RP,Gold JS,Saran L,et al.Tumor mitotic rate,size,and location independently predict recurrence after resection of primary gastrointestinal stromal tumor (GIST)[J].Cancer,2008,112(3):608-615.
[12] Sasaki A,Koeda K,Obuchi T,et al.Tailored laparoscopic resection for suspected gastric gastrointestinal stromal tumors[J].Surgery,2010,147(4):516-520.
[13] Casali PG,Jost L,Reichardt P,et al.Gastrointestinal stromal tumours:ESMO clinical recommendations for diagnosis,treatment and follow-up[J].Ann Oncol,2009,20 Suppl 4:64-67.
[14] Novitsky YW,Kercher KW,Sing RF,et al.Long-term outcomes of laparoscopic resection of gastric gastrointestinal stromal tumors[J].Ann Surg,2006,243(6):738-745.
[15] Nguyen SQ,Divino CM,Wang JL,et al.Laparoscopic management of gastrointestinal stromal tumors[J].Surg Endosc,2006,20(5):713-716.
[16] 江志伟,黎介寿,李宁.腹腔镜与机器人手术上消化道重建合理吻合方式[J].中国实用外科杂志,2012,32(8):637-639.
