术前胃镜下纳米碳标记在腹腔镜胃癌根治术中的应用价值*
2018-05-03麦麦提艾合麦提刘少壮韩海峰于文滨
麦麦提·艾合麦提,刘少壮,陈 成,韩海峰,刘 腾,焦 杰,于文滨
(山东大学齐鲁医院,山东 济南,250012)
胃癌是我国最常见的消化道肿瘤之一。胃癌根治术是进展期胃癌唯一能达到治愈效果的治疗手段,包括肿瘤完整切除与淋巴结清扫[1-2]。淋巴结转移是胃癌最重要的预后指标之一[3]。胃癌根治手术中进行彻底的淋巴结清扫至关重要,然而胃癌淋巴引流途径是多向的,并且相当复杂,因此胃癌根治术中进行有效的淋巴结清扫难度较大。纳米碳微粒具有淋巴趋向性,近期作为淋巴示踪剂应用于结直肠癌手术的淋巴结清扫。术前经胃镜黏膜下注射纳米碳混悬液后,纳米碳微粒沿肿瘤周围的淋巴管引流,聚集在相应的淋巴结并使之染色。有研究报道[4-6],纳米碳标记在胃肠道恶性肿瘤及甲状腺癌手术中显示出良好的淋巴结示踪效果。本研究旨在探讨术前胃镜下纳米碳标记在腹腔镜胃癌根治术中淋巴结的示踪效果及其在完全腹腔镜胃癌根治术中的肿瘤定位作用。
1 资料与方法
1.1 临床资料 本研究分析了2016年12月至2017年11月山东大学齐鲁医院胃肠外科收治的经胃镜及病理确诊的75例胃癌患者的临床资料,均由同一组医师行腹腔镜胃癌D2根治术。排除标准:(1)晚期肿瘤局部广泛浸润或远处转移无根治性手术条件;(2)胃食管结合部癌Siewert Ⅰ型,胃癌Borrmann 4型;(3)开腹手术、手术合并其他脏器切除或腹腔镜手术中转开腹;(4)术前接受放化疗或免疫治疗;(5)因肿瘤复发或残胃癌再次手术。31例患者术前24 h于胃镜下行纳米碳混悬液注射(纳米碳组),余44例患者作为对照组。纳米碳标记前充分告知患者及家属并签署知情同意书,两组患者基本资料差异无统计学意义,见表1。
1.2 方法 纳米碳组术前1 d于胃镜下行纳米碳混悬液注射。选用纳米碳混悬注射液1 ml加1 ml生理盐水后震荡混匀,胃镜下在肿瘤与正常胃黏膜交界处选择正常黏膜侧0.5 cm处斜行刺入注射针,黏膜下注射纳米碳混悬液,每处注射0.5 ml,共注射两点,即肿瘤口侧与肛侧,可见黏膜隆起及黏膜下黑染。两组患者均行腹腔镜胃癌D2根治术。全胃切除术时食道切缘送快速病理检查。胃部分切除术不易确定切缘及多处病灶的患者,切缘送快速病理检查。
1.3 标本处理 两组标本均由专人负责淋巴结分拣,标明所取淋巴结所在解剖位置(图1),按站别分组后送常规病理检查。淋巴结分拣时严格按“the Japanese Classification of Gastric Carcinoma:3rd English edition”[7]对胃周围淋巴结进行分组。测量纳米碳组标本浆膜层染色区边缘至肿瘤边缘的距离(垂直于手术切线)并记录,测量每一枚淋巴结最大直径并记录,见图2。
1.4 统计学处理 采用SPSS 17软件进行数据分析,连续变量采用t检验或Wilcoxon检验,分类变量采用χ2或Fisher精确检验。
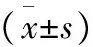

组别例数(n)年龄(岁)性别[n(%)]男女Borrmann分型[n(%)]ⅠⅡⅢ肿瘤部位[n(%)]胃窦胃体贲门纳米碳组3158.19±9.3621(67.74)10(32.26)14(45.16)4(12.90)13(41.94)12(38.71)11(35.48)8(25.81)对照组4460.09±9.7738(86.36)6(13.64)12(27.27)15(34.09)17(38.64)12(27.27)16(36.36)16(36.36)P值0.4020.0530.0840.501
续表1
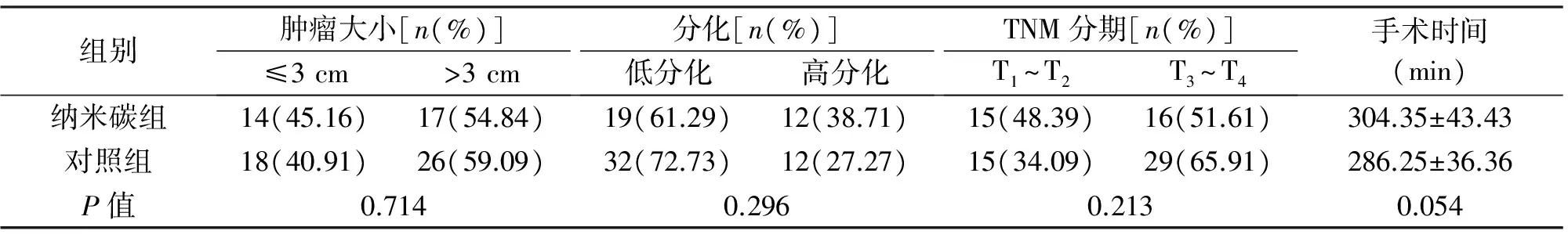
组别肿瘤大小[n(%)]≤3cm>3cm分化[n(%)]低分化高分化TNM分期[n(%)]T1~T2T3~T4手术时间(min)纳米碳组14(45.16)17(54.84)19(61.29)12(38.71)15(48.39)16(51.61)304.35±43.43对照组18(40.91)26(59.09)32(72.73)12(27.27)15(34.09)29(65.91)286.25±36.36P值0.7140.2960.2130.054
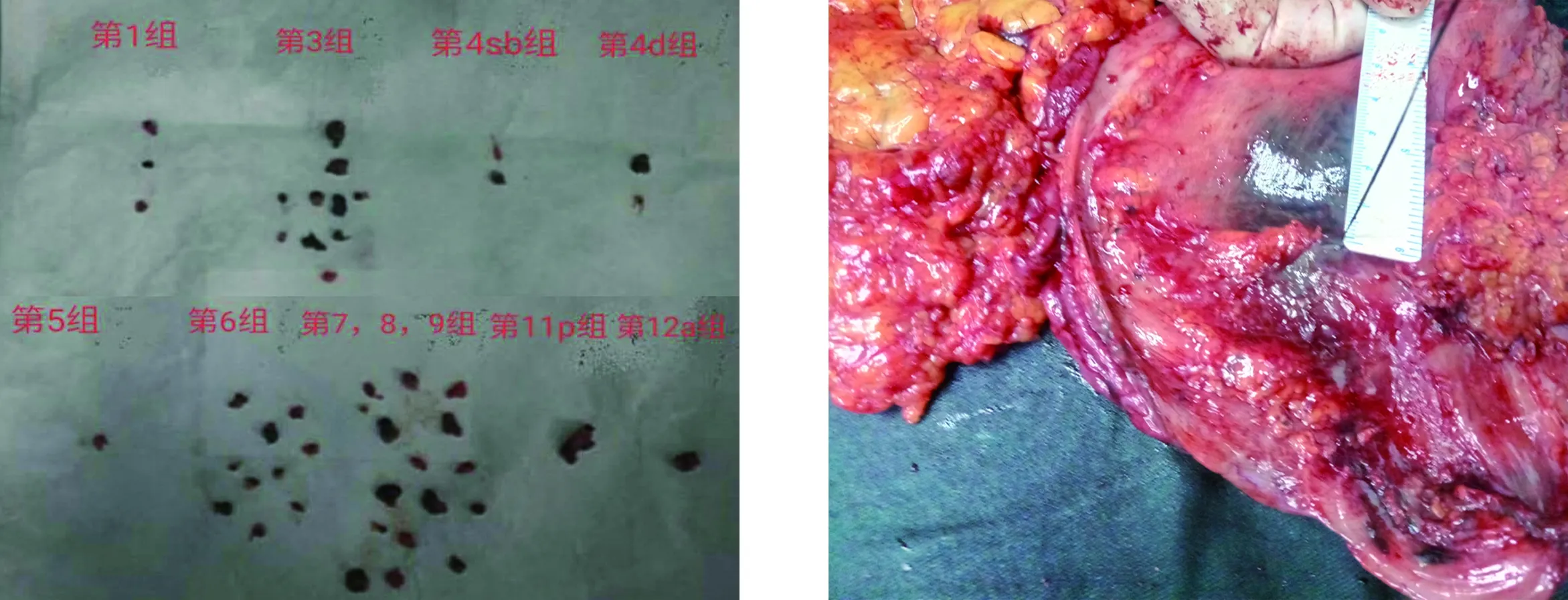
图1 手术切除标本淋巴结分拣情况图2 测量浆膜层染色区边缘至肿瘤边缘在垂直于手术切线方向的距离
2 结 果
2.1 手术情况 两组患者均行腹腔镜胃癌D2根治术,包括腹腔镜辅助胃癌根治术(n=61)及完全腹腔镜胃癌根治术(n=14),手术均顺利完成,无术中大出血、并发症发生,术中快速病理检查及术后常规病理检查均提示切缘阴性。
2.2 淋巴结检获情况 纳米碳组共检出淋巴结1 157枚,对照组检出1 327枚。纳米碳组平均清扫淋巴结数量[(37.32±10.27)枚]明显高于对照组[(30.16±11.29)枚],差异有统计学意义(P<0.05),纳米碳组患者检出阳性淋巴结数量平均(5.61±5.21)枚,对照组平均(6.27±7.57)枚,两组相比差异无统计学意义(P>0.05)。纳米碳组中患者检出的第一站、第二站阳性淋巴结数量分别为(4.39±3.87)枚与(1.16±1.53)枚,对照组分别为(4.70±5.40)枚与(1.43±2.60)枚,两组相比差异均无统计学意义(P>0.05)。纳米碳组检出直径≤5 cm淋巴结数量[(22.77±8.24)枚]大于对照组[(17.02±5.90)枚],差异有统计学意义(P<0.05);两组检出直径>5 mm的淋巴结数量差异无统计学意义(P>0.05)。两组淋巴结检出情况及淋巴结转移情况见表2。
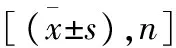
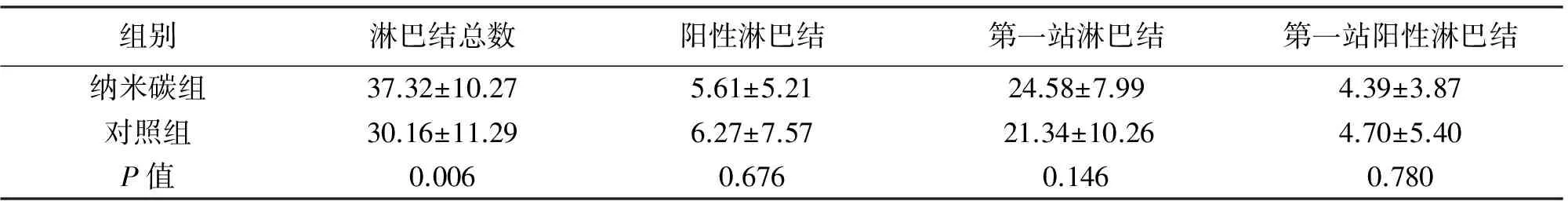
组别淋巴结总数阳性淋巴结第一站淋巴结第一站阳性淋巴结纳米碳组37.32±10.275.61±5.2124.58±7.994.39±3.87对照组30.16±11.296.27±7.5721.34±10.264.70±5.40P值0.0060.6760.1460.780
续表2
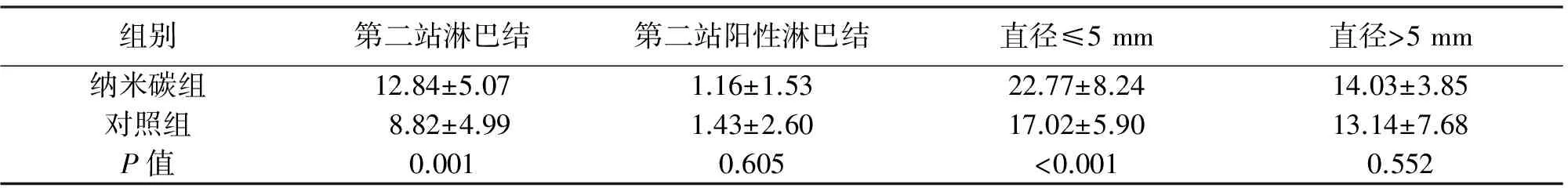
组别第二站淋巴结第二站阳性淋巴结直径≤5mm直径>5mm纳米碳组12.84±5.071.16±1.5322.77±8.2414.03±3.85对照组8.82±4.991.43±2.6017.02±5.9013.14±7.68P值0.0010.605<0.0010.552
2.3 纳米碳标记的肿瘤定位作用 通常局限型胃癌胃切缘距肿瘤应大于3 cm,浸润型胃癌胃切缘距肿瘤边缘应大于5 cm,胃食管结合部癌食管切缘距肿瘤边缘应大于3 cm,切缘可疑时应行术中快速病理检查。肿瘤侵犯幽门管时,十二指肠切缘距肿瘤边缘应大于3 cm[8]。本研究中,纳米碳组手术切除的标本浆膜层可见黑染区,由纳米碳注射点向周围扩散,大体呈圆形染色区域。根据测量结果,标本浆膜层染色区边缘至肿瘤边缘在垂直于手术切线方向的距离平均(4.08±0.37) cm,因此术者在腹腔镜监视下确定切缘距离时可参考此距离,即切线超过黑染边界1 cm是安全的,快速及常规病理均提示切缘阴性。
3 讨 论
本研究旨在探讨术前胃镜下纳米碳标记在胃癌根治术淋巴结清扫中的淋巴示踪效果及完全腹腔镜胃癌根治术中的肿瘤定位作用,结果显示,纳米碳组检出淋巴结数量大于对照组(P<0.05),检出的直径<5 mm的淋巴结数量亦大于对照组(P<0.05),表明纳米碳微粒使淋巴结黑染后,术者肉眼可发现更小的淋巴结,并完成更彻底的淋巴结清扫。但两组患者检出的阳性淋巴结数量差异无统计学意义,表明纳米碳微粒未能选择性示踪阳性淋巴结。此结果与Li等[9]的前瞻性随机对照研究结果基本一致。
行D2根治术时,根治性远端胃大部切除术应常规清扫第1、3、4sb、4d、5、6、7、8a、9、11p、12a组淋巴结,根治性近端胃大部切除术应常规清扫第1、2、3、4sa、4sb、7、8a、9、11p组淋巴结,根治性全胃切除术应常规清扫第1、2、3、4sa、4sb、4d、5、6、7、8a、9、10、11p、11d、12a组淋巴结[10]。纳米碳组患者检出淋巴结数量明显大于对照组,其原因之一可能是纳米碳标记后肉眼可发现直径更小的淋巴结。此外,我们认为纳米碳标记有助于清扫容易遗漏的淋巴结,以及操作风险、难度大的手术区域的淋巴结。如针对第10组、第11p组、第8a与8p组之间的淋巴结、第12a与12p组之间的淋巴结、第14v组的淋巴结。清扫第4sb组淋巴结时,因受大网膜大量脂肪组织的干扰,较难彻底清扫。在上述部位清扫淋巴结时,如果血管裸化过度,则有大出血的风险;裸化程度不足,则会引起淋巴结遗漏。根据我们的经验,纳米碳标记后,这些部位的淋巴结多被染成黑色,较容易与周围血管、脂肪区分,清扫更彻底、更安全。
标准的胃癌根治术要求完整切除肿瘤并确保切缘阴性。与传统开腹手术不同的是,腹腔镜手术中通过触觉对肿瘤进行定位受到一定限制,尤其肿瘤未浸润浆膜层时。因此,腹腔镜监视下对早期病灶进行精确定位成为重要的难题[5]。在完全腹腔镜胃癌根治术中,如果肿瘤未侵透浆膜层或位于胃上段,对肿瘤进行定位并获得安全切缘更为困难。这是因为完全腹腔镜胃癌根治术中,肿瘤切除及消化道重建等操作均在腹腔镜下完成[11]。因此在完全腹腔镜胃癌根治术中,通过触觉或切开胃进行肿瘤定位并决定切缘距离是不可能的,这已成为完全腹腔镜胃癌根治术普遍应用的制约因素之一。此前有研究报道了一些肿瘤定位方法,包括腹腔镜术中超声、术中便携式X线摄影术、术中荧光透视法及术中内镜[12-13]。虽然这些方法确实获得了令人满意的效果,但目前并未被广泛应用于临床。腹腔镜术中超声、术中便携式X线摄影需要术前内镜下置入金属夹,通过术中超声或X线探测金属夹定位肿瘤,具有很强的操作者依赖性,主观因素的干扰很难避免,而且大部分手术室并不具备这些设备[13]。术中便携式X线摄影术只能提供二维视图,当胃处于非膨胀状态时肿瘤定位非常困难,而且患者、术者会暴露于一定程度的辐射[5]。术中荧光透视法需用C臂在手术室进行透视,患者及医师面临的辐射危害可能会更大。术中内镜是临床较常用的肿瘤定位方法,其缺点是耗时,而且不方便,因手术室需具备内镜设备,并由有经验的消化内科医师操作[13]。
本研究对肿瘤边缘至染色区边缘在垂直于手术切线方向的距离进行了分析。结果显示,如果术前1 d进行纳米碳标记,且1 ml纳米碳混悬液注射于肿瘤边缘距正常黏膜侧0.5 cm处,则肿瘤边缘至染色区边缘在垂直于手术切线方向的距离平均为(4.08±0.37) cm。我们认为在完全腹腔镜胃癌根治术中进行肿瘤定位并确定切缘距离时,术者可借助于此染色区确定切缘距离。如远端胃大部切除术中确定近端切缘时,可于浆膜层染色区边缘以远1 cm处切除,基本可保证切除范围足够,获得安全切缘。临床实践中,术者根据切缘距离选择行全胃切除术或胃大部切除术,对患者术后并发症发生率及生活质量具有深远影响[14]。完全腹腔镜胃癌根治术中,当肿瘤未侵透浆膜层或位于胃上段时,部分外科医师为获得安全切缘,可能更倾向于行全胃切除术。我们认为,纳米碳标记不仅能提高淋巴结清扫效率,还可协助术者确定安全切缘,使外科医师更合理地选择手术方式。
研究表明[15-17],完全腹腔镜胃癌根治术是安全、可行的,某些方面优于腹腔镜辅助胃癌根治术,如切口更小、术中出血量少、术后疼痛轻、康复快、进行消化道重建时操作不受患者体型及肿瘤位置的影响。腹腔镜辅助胃癌根治术中进行消化道重建时,因腹部切口较小,在狭窄的空间内操作较困难,尤其肥胖、残胃较小时更为明显。如果为了获得更好的视野、保证吻合质量而延长切口,将失去腹腔镜手术的优势[15]。完全腹腔镜胃癌根治术克服了消化道重建方面的困难,因操作均在腹腔镜下完成,而不通过腹部小切口,操作不受限于患者体型、残胃大小及肿瘤位置。手术费用较高及术中早期病灶定位困难是目前完全腹腔镜胃癌根治术的缺点。有学者报道,完全腹腔镜胃癌根治术中可采用手工缝合法行食管空肠吻合,具有原位吻合安全确切、对食管残端游离长度要求较低、经济性高等特点[18]。随着术者腹腔镜操作熟练程度的不断提高,手工吻合可节省吻合器的费用,再加上因住院时间缩短而减少的费用,完全腹腔镜胃癌根治术总医疗费用有望控制在更为合理的范围内。而术中肿瘤定位方面,我们认为术前胃镜下纳米碳标记具有很好的应用前景。
综上,术前胃镜下纳米碳标记在腹腔镜胃癌根治术中具有良好的淋巴结示踪作用,临床应用安全,有助于术中更精细、更彻底的清扫淋巴结,对术后标本精确的临床病理分期、进一步治疗方案的选择及预后判断均具有一定的指导意义。此外,纳米碳标记应用于完全腹腔镜胃癌根治术中具有肿瘤定位作用,使术者更有把握地确定安全切缘,选择更合理的手术方式,从而使患者获益。
参考文献:
[1] Marubini E,Bozzetti F,Miceli R,et al.Lymphadenectomy in gastric cancer:prognostic role and therapeutic implications[J].Eur J Surg Oncol,2002,28(4):406-412.
[2] Mariette C,Castel B,Balon JM,et al.Extent of oesophageal resection for adenocarcinoma of the oesophagogastric junction[J].Eur J Surg Oncol,2003,29(7):588-593.
[3] Chan WH,Wong WK,Khin LW,et al.Significance of a positive oesophageal margin in stomach cancer[J].Aust N Z J Surg,2000,70(10):700-703.
[4] Kim HI,Hyung WJ,Lee CR,et al.Intraoperative portable abdominal radiograph for tumor localization:a simple and accurate method for laparoscopic gastrectomy[J].Surg Endosc,2011,25(3):958-963.
[5] Park DJ,Lee HJ,Kim SG,et al.Intraoperative gastroscopy for gastric surgery[J].Surg Endosc,2005,19(10):1358-1361.
[6] Kinoshita T,Shibasaki H,Oshiro T,et al.Comparison of laparoscopy-assisted and total laparoscopic Billroth-I gastrectomy for gastric cancer:a report of short-term outcomes[J].Surg Endosc,2011,25(5):1395-1401.
[7] Japanese Gastric Cancer Association.Japanese classification of gastric carcinoma:3rd English edition[J].Gastric Cancer,2011,14(2):101-112.
[8] Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2014 (ver.4)[S].Gastric Cancer,2017,20(1):1-19.
[9] Li Z,Ao S,Bu Z,et al.Clinical study of harvesting lymph nodes with carbon nanoparticles in advanced gastric cancer:a prospective randomized trial[J].World J Surg Oncol,2016,14:88.
[10] 中华医学会外科学分会腹腔镜与内镜外科学组.腹腔镜胃癌手术操作指南(2016版)[S].中华消化外科杂志,2016,15(9):851-857.
[11] Nakagawa M,Ehara K,Ueno M,et al.Accurate,safe,and rapid method of intraoperative tumor identification for totally laparoscopic distal gastrectomy:injection of mixed fluid of sodium hyaluronate and patent blue[J]. Surg Endosc,2014,28(4):1371-1375.
[12] Xuan Y,Hur H,Byun CS,et al.Efficacy of intraoperative gastroscopy for tumor localization in totally laparoscopic distal gastrectomy for cancer in the middle third of the stomach[J].Surg Endosc,2013,27(11):4364-4370.
[13] Kim HI,Hyung WJ,Lee CR,et al.Intraoperative portable abdominal radiograph for tumor localization:a simple and accurate method for laparoscopic gastrectomy[J].Surg Endosc,2011,25(3):958-963.
[14] Squires MH 3rd,Kooby DA,Poultsides GA,et al.Is it time to abandon the 5-cm margin rule during resection of distal gastric adenocarcinoma?A multi-institution study of the U.S.Gastric Cancer Collaborative[J].Ann Surg Oncol,2015,22(4):1243-1251.
[15] Zhang YX,Wu YJ,Lu GW,et al.Systematic review and meta-analysis of totally laparoscopic versus laparoscopic assisted distal gastrectomy for gastric cancer[J].World J Surg Oncol,2015,13:116.
[16] Shinohara T,Kawano S,Tanaka Y,et al.Comparison of the cost and outcomes following totally laparoscopic and laparoscopy-assisted distal gastrectomies for gastric cancer:a single-institution comparison[J].Surg Endosc,2016,30(8):3573-3581.
[17] Chen K,Pan Y,Cai JQ,et al.Totally laparoscopic versus laparoscopic-assisted total gastrectomy for upper and middle gastric cancer:a single-unit experience of 253 cases with meta-analysis[J].World J Surg Oncol,2016,14:96.
[18] 徐晓武,张人超,牟一平,等.手工缝合法食管空肠吻合在全腹腔镜全胃切除术中应用[J].中国实用外科杂志,2016,36(9):935-938.
