腹腔镜袖状胃切除术的疗效分析*
2018-05-03曹新岭张晓倩张金辉
吴 鹏,曹新岭,张晓倩,姚 刚,张金辉
(新疆医科大学第一附属医院,新疆 乌鲁木齐,830018)
肥胖症在我国已越发流行,文献报道[1],中国成年居民超重率高达27.1%,并逐年上升,每年因肥胖造成的死亡人数已超过饥荒、营养不良等。肥胖可引发内分泌、心血管、呼吸道等系统并发症,如2型糖尿病(type 2 diabetes mellitus,T2DM)、高血压、阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)、疝等。长期有效的控制体重,可改善生活质量、推动全民健康。但对于肥胖症患者而言,自控力较差,不适合传统减重方法。减重手术治疗肥胖症因具有良好疗效逐渐引起广泛关注。并且,国际糖尿病联盟推荐符合手术标准的肥胖症及糖尿病患者以减重手术为首选治疗措施[2]。但减重手术在我国处于起步阶段,暂无大样本疗效及术后并发症分析。自2014年我院开始开展腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG),本文现回顾分析2014年4月至2017年1月我科为28例肥胖症患者行LSG的临床资料及随访资料,将结果报道如下。
1 资料与方法
1.1 临床资料 2014年4月至2017年1月行LSG的28例肥胖症患者,其中汉族18例,维吾尔族10例;女18例;男10例;21~63岁,平均(39.3±13.5)岁,术前体重平均(112.4±22.3) kg,体重指数(body mass index,BMI)平均(39.1±5.5) kg/m2。其中单纯性肥胖8例(28.6%),病态肥胖症20例(71.4%);10例(35.7%)合并T2DM,6例(21.4%)合并高血压病,12例(42.9%)合并OSAS,2例(7.1%)合并胃食管反流病(gastroesophageal refux disease,GERD),4例(14.3%)合并女性内分泌失调。
1.2 纳入标准与排除标准 纳入标准:(1)根据指南[3],选取BMI≥32.5 kg/m2的重度肥胖患者,或BMI≥27.5 kg/m2且合并:①T2DM患者,药物控制血糖欠佳;②由肥胖引发代谢异常的患者;(2)16~65岁,经我院伦理委员会审批同意,并通过多学科会诊,患者及家属均签署知情同意书。排除标准:(1)滥用药物或有难以控制的精神系统疾病;(2)对手术预期不符合实际或不愿承担手术潜在并发症风险;(3)内分泌系统疾病如甲状腺功能低下或库欣综合征及继发性肥胖;(4)全身状况差,难以耐受全身麻醉。
1.3 手术方法 全麻成功后,患者呈“大”字形头高脚低位。一般采用4孔法,Trocar位置见图1,可视患者腹围、身高等因素调整。此外,对于过度肥胖、操作困难的患者,可于右上腹另加5 mm Trocar协助术区显露。超声刀由胃结肠韧带中部无血管区沿胃壁向幽门方向游离,至幽门4~6 cm处(图2、图3),游离胃后壁(图4),向胃底部游离(图5),此处注意保护胃短血管及脾脏。完成后,由麻醉师经口置入34F支撑胃管(图6),调整至胃窦部,推向幽门。置入直线切割闭合器(图7),沿胃大弯贴近支撑胃管切割胃组织,切缘距胃小弯2~4 cm(图8),切割至胃底,完成胃袖状切除术,用可吸收线缝合胃切缘(图9),以减少吻合口胃瘘、出血等风险。年轻患者术后当天可拔除胃管,以利胃肠道功能恢复;年龄较大的患者,放置1~2 d,以降低胃内压力,减少胃瘘的发生风险。
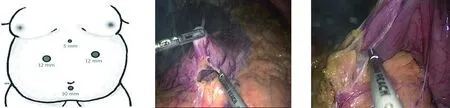
图1 Trocar位置 图2 游离胃大网膜至幽门4~6 cm处图3 游离胃大网膜至幽门4~6 cm处

图4 游离胃后壁图5 向胃底游离 图6 置入支撑胃管

图7 沿支撑胃管切除胃组织图8 沿支撑胃管切除胃组织 图9 可吸收线缝合胃切缘
1.4 随访内容 术后饮食管理要求循序渐进、少食多餐等原则。并定期门诊随访,记录体重、BMI等一般情况,计算多余体质量下降百分比(percentage of excess weight loss,EWL%),检测维生素B12、血脂、空腹血糖、HbA1c等,T2DM患者每3个月于内分泌门诊随访,评估用药方案。
1.5 疗效判定 根据Reinhold[4]等制定的标准,术后1年为起始点。效果良好:EWL%≥50%;效果极佳:EWL%≥75%。T2DM临床完全缓解标准[5]:术后停用降糖药物后,空腹血糖、HbA1c达正常水平;T2DM临床部分缓解标准:术后降糖药物减半后,空腹血糖、HbA1c达正常水平。
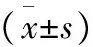
2 结 果
2.1 一般情况 本组28例LSG均顺利完成,出血量平均(60.3±35.7) ml,手术时间平均(164.1±38.6) min,无中转开腹。术后住院2~5 d。随访时间≥2年6例、≥1年20例、≥6个月28例。无营养不良。
2.2 术后体重、BMI及EWL%情况 术后3个月内体重下降速度最快,6个月后体重下降速度处于平台期。术后BMI最低为22.1 kg/m2,无营养不良。2例患者减重效果欠佳(EWL%<50%),其EWL%分别为47.2%与42.9%。见表1。
2.3 术后T2DM好转情况 10例患者合并T2DM,术前均使用降糖药物,其中4例联合应用胰岛素治疗。术后6个月,8例仅靠生活及饮食可控制空腹血糖,2例仍需在内分泌科医师指导下口服一种降糖药物。术后空腹血糖、HbA1c均见明显好转,见表2。
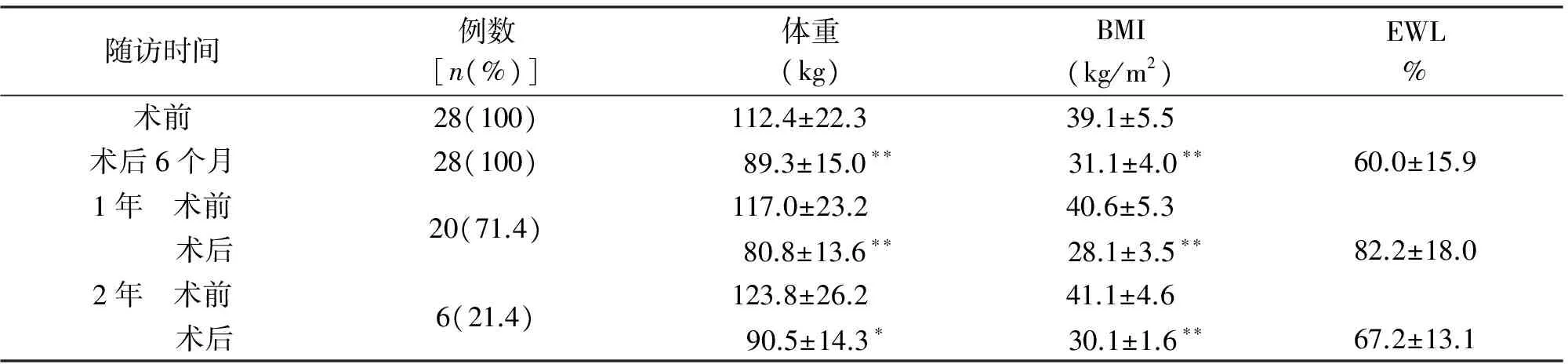
2.4 术后血脂的变化 与术前相比,术后3个月甘油三酯显著降低,高密度脂蛋白(high density lipoprotein,HDL)显著升高;术后6个月,胆固醇、低密度脂蛋白(low density lipoprotein,LDL)显著降低,差异有统计学意义。见表3。
2.5 术后血红蛋白、B12、叶酸的变化 B12的吸收需要胃壁细胞分泌的内因子作用,血红蛋白的合成需要B12的参与,减重手术切除了大部分胃壁,影响B12的吸收,进而影响血红蛋白的合成。与术前相比,术后3个月患者血红蛋白即有明显下降;术后6个月,B12显著降低;术后2年较术后1年时有所上升。见表4。
2.6 术后其他合并症好转情况 12例患者合并OSAS,术后3个月内均见明显好转,无夜间憋醒,夜间鼾症减轻。6例合并高血压,目前均已停服降压药,血压控制可;女性内分泌失调6例,术后15~30 d内均来月经,此后月经正常规律,周期30~40 d。术前合并GERD 2例,术后6个月、1年行内镜检查发现无明显好转,反酸症状反复,发作时服用抑酸药治疗可缓解症状。其他肥胖相关并发症如脂肪肝等均得到缓解。
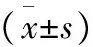
随访时间例数[n(%)]体重(kg)BMI(kg/m2)EWL%术前28(100)112.4±22.3 39.1±5.5术后6个月28(100)89.3±15.0∗∗ 31.1±4.0∗∗60.0±15.91年 术前 术后20(71.4)117.0±23.2 40.6±5.380.8±13.6∗∗ 28.1±3.5∗∗82.2±18.02年 术前 术后6(21.4)123.8±26.2 41.1±4.690.5±14.3∗ 30.1±1.6∗∗67.2±13.1
*P<0.05,**P<0.01
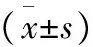
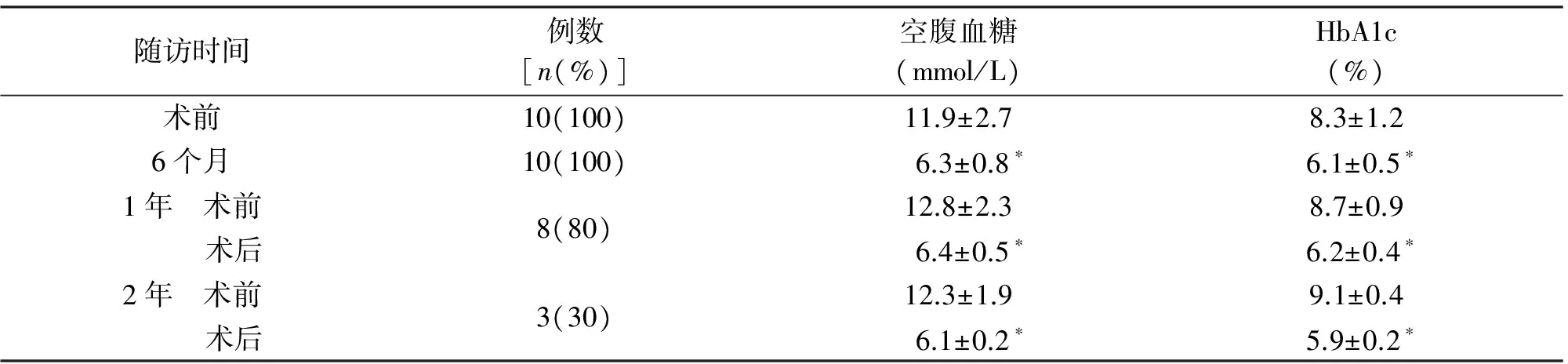
随访时间例数[n(%)]空腹血糖(mmol/L)HbA1c(%)术前10(100)11.9±2.78.3±1.26个月10(100) 6.3±0.8∗6.1±0.5∗1年 术前 术后8(80)12.8±2.38.7±0.9 6.4±0.5∗6.2±0.4∗2年 术前 术后3(30)12.3±1.99.1±0.4 6.1±0.2∗5.9±0.2∗
*P<0.01
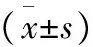
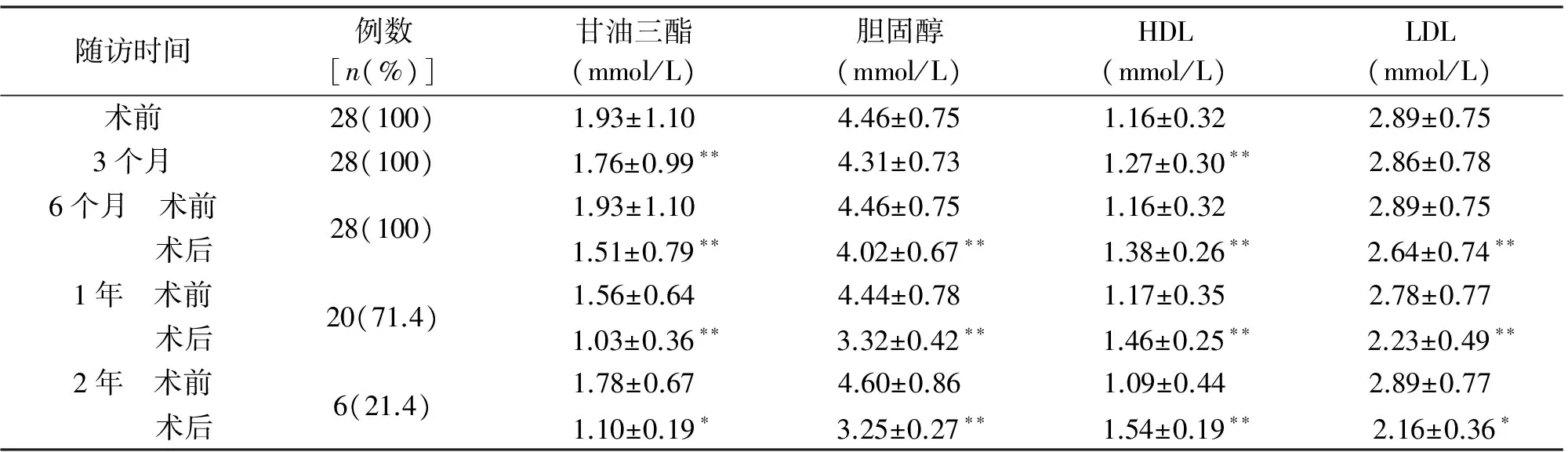
随访时间例数[n(%)]甘油三酯(mmol/L)胆固醇(mmol/L)HDL(mmol/L)LDL(mmol/L)术前28(100)1.93±1.104.46±0.751.16±0.322.89±0.753个月28(100) 1.76±0.99∗∗4.31±0.73 1.27±0.30∗∗2.86±0.786个月 术前 术后28(100)1.93±1.104.46±0.751.16±0.322.89±0.75 1.51±0.79∗∗ 4.02±0.67∗∗ 1.38±0.26∗∗ 2.64±0.74∗∗1年 术前 术后20(71.4)1.56±0.644.44±0.781.17±0.352.78±0.77 1.03±0.36∗∗ 3.32±0.42∗∗ 1.46±0.25∗∗ 2.23±0.49∗∗2年 术前 术后6(21.4)1.78±0.674.60±0.861.09±0.442.89±0.771.10±0.19∗ 3.25±0.27∗∗ 1.54±0.19∗∗ 2.16±0.36∗
*P<0.05,**P<0.01
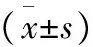
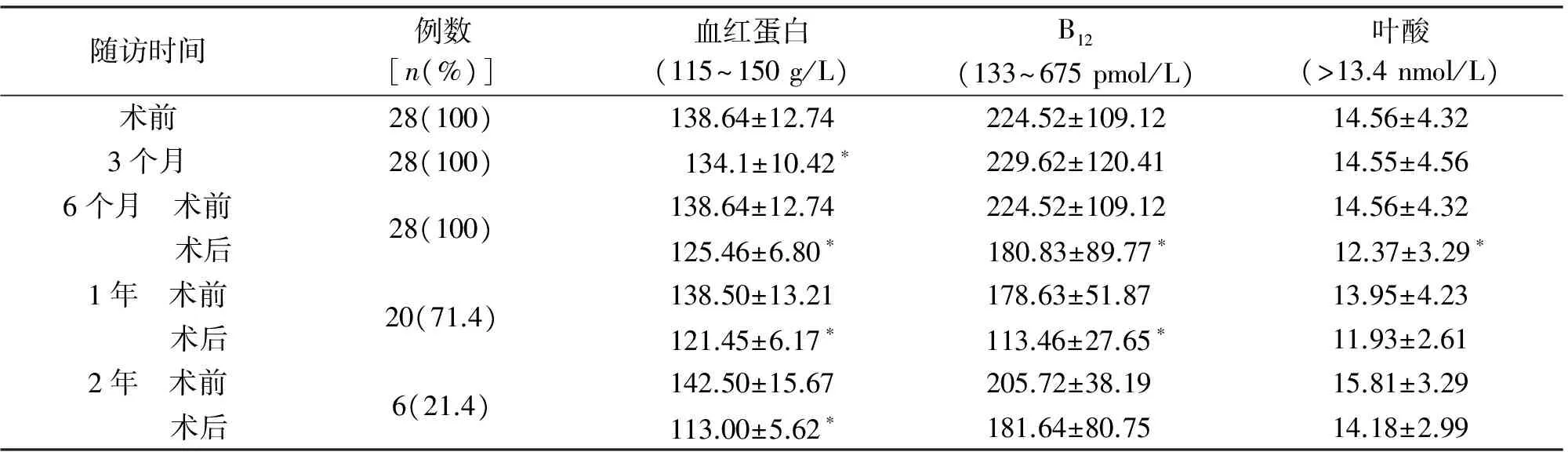
随访时间例数[n(%)]血红蛋白(115~150g/L)B12(133~675pmol/L)叶酸(>13.4nmol/L)术前28(100)138.64±12.74224.52±109.1214.56±4.323个月28(100) 134.1±10.42∗229.62±120.4114.55±4.566个月 术前 术后28(100)138.64±12.74224.52±109.1214.56±4.32125.46±6.80∗180.83±89.77∗12.37±3.29∗1年 术前 术后20(71.4)138.50±13.21178.63±51.87 13.95±4.23121.45±6.17∗113.46±27.65∗11.93±2.612年 术前 术后6(21.4)142.50±15.67205.72±38.19 15.81±3.29113.00±5.62∗181.64±80.75 14.18±2.99
*P<0.01
3 讨 论
目前减重手术分为两大类,一类以腹腔镜胃旁路术(laparoscopic Roux-en-Y gastric bypass,LRYGB)为代表,术中需胃肠改道及重建;另一种即LSG,术中仅切除胃大弯改变胃容积。LSG最初仅作为复杂减重手术如十二指肠转流术、腹腔镜胆胰旷置术或LRYGB的前期手术[6],可降低严重肥胖症患者(BMI≥60 kg/m2)二期手术的术中风险。经过近年大量对比研究发现,与LRYGB相比,LSG操作相对简单,且疗效相近[7],已逐渐发展为独立的减重手术方式。Angrisani等[8]统计分析,2013年全世界共施行减重手术468 609例,其中LRYGB、LSG为45%与37%,具体到亚洲地区,这两种手术所占百分比分别为25%与49%。
本研究经统计分析发现,术后1年内减重效果最佳,随后出现个体差异,部分患者体重略有回升。3个月内因体重下降过快需每日补充电解质、水至少2 000 ml,蛋白质至少1 g/kg,以防止患者出现头晕、心悸、低血压等表现。其中2例减重效果欠佳,EWL%分别为47.2%与42.9%,患者均为维吾尔族单纯性肥胖症患者,随访发现因其术前未合并肥胖相关并发症,术后半年饮食习惯逐渐回归术前状态(依旧喜欢高糖高盐饮食)。不同于汉族饮食文化,维吾尔族以烤馕、牛、羊肉及乳制品为主食,喜爱加盐及酥油奶茶伴囊同食,多食腌肉,不喜食蔬菜等,此饮食结构可逐渐形成高脂肪、高盐、高蛋白、低维生素状态,是影响疗效的主要原因。2例患者术后1年行胃镜检查示残胃扩张,建议患者如可耐受二次手术,可行修正手术,如LRYGB[9]。本研究中,10例患者术前合并T2DM,术后3个月时,空腹血糖即恢复正常;术后1年,2例患者需靠单种降糖药物控制血糖,余8例仅靠控制饮食及运动便可维持血糖在正常范围内。笔者考虑,术后患者3个月内以流质饮食为主,患者进食主食少,热量少,因此高血糖得到改善。3个月后,大部分患者可缓慢多次进食少量固体食物,但患者因体重下降,肌肉对于糖的利用增加,可使T2DM病情继续得到缓解。但不止于此,LSG对T2DM的治疗是多因素的,不止是体重的下降,还包括胃大弯的切除,对此,有学者提出了胃中心学说[10]来解释,胃大弯可分泌某类激素参与代谢过程,切除胃大弯可使某种特殊因子减少,导致胰岛素抵抗减弱。减重手术还可迅速、有效的降低甘油三酯、胆固醇,升高HDL,降低心脑血管并发症的风险[11-12]。目前,对于我国中重度T2DM合并肥胖的患者,LSG已是首选治疗方式[13]。
本研究中合并OSAS的患者术后短时间内症状可得到好转,大部分患者术后3个月内夜间憋醒症状可治愈,疗效与国外文献报道相当(98%)[14]。术前合并GERD的2例患者,术后随访1年,行两次内镜检查均显示GERD未明显好转,发作时服用抑酸药可对症治疗,考虑LSG可使His角变钝,降低患者胃顺应性等因素,不利于GERD的好转。对于术前合并GERD的患者是否是LSG的禁忌,第五次LSG国际会议中专家及外科医生还处于争论阶段[15],目前有更多的文献表明,LSG术后第1年GERD症状加重,术后第3年症状逐渐减轻,不过这需要更长时间的随访资料证实。
虽然LSG不改变胃肠道的生理结构,相较LRYGB不容易引起营养不良;但患者仍会出现叶酸等维生素降低导致的脱发、贫血等症状[16],手术1个月后予以口服复合维生素,6个月后嘱患者多食新鲜蔬菜、水果等可改善预后。对于医从性好的患者,随访过程中未发现营养性并发症发生。
综上所述,LSG是高效、安全、远期并发症少的独立减重手术,术后体重下降迅速,且肥胖相关并发症缓解明显。文献报道[14,17],BMI≤50 kg/m2的患者,LSG与LRYGB疗效无明显差异。亚洲患者以腹型肥胖为特点,BMI明显低于欧美国家水平,BMI≤50 kg/m2的患者较多,因LSG操作简单,术中出血、胃瘘的风险小,可广泛推广。LSG治疗肥胖症及肥胖相关并发症具有广阔前景,不过其远期疗效仍需长期随访研究评判。
参考文献:
[1] 房红芸,于文涛,郭齐雅,等.2010-2012年中国居民超重与肥胖状况[J].中华预防医学杂志,2015,49(4):311-314.
[2] Rubino F,Nathan DM,Eckel RH,et al.Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes:A Joint Statement by International Diabetes Organizations[J].Surg Obes Relat Dis,2016,12(6):1144-1162.
[3] 刘金刚,郑成竹,王勇.中国肥胖和2型糖尿病外科治疗指南(2014)[S].中国实用外科杂志,2014,34(11):1005-1010.
[4] Reinhold RB.Critical analysis of long term weight loss following gastric bypass[J].Surg Gynecol Obstet,1982,155(3):385-394.
[5] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[S].中华内分泌代谢杂志,2014,30(10):447-498.
[6] Sasaki A,Wakabayashi G,Yonei Y.Current status of bariatric surgery in Japan and effectiveness in obesity and diabetes[J].J Gastroenterol,2014,49(1):57-63.
[7] Leyba JL,Llopis SN,Aulestia SN.Laparoscopic Roux-en-Y gastric bypass versus laparoscopic sleeve gastrectomy for the treatment of morbid obesity.a prospective study with 5 years of follow-up[J].Obes Surg,2014,24(12):2094-2098.
[8] Angrisani L,Santonicola A,Iovino P,et al.Bariatric Surgery Worldwide 2013[J].Obes Surg,2015,25(10):1822-1832.
[9] 王存川,黄勇.减重代谢外科修正手术临床应用价值[J].中国实用外科杂志,2014,34(11):1041-1043.
[10] 朱江帆.减肥手术治疗代谢综合征的机制:胃中心假说[J/CD].中华肥胖与代谢病电子杂志,2015,1(1):39-40.
[11] Zhang X,Liu S,Zhang G,et al.Bariatric Surgery Ameliorates Diabetic Cardiac Dysfunction by Inhibiting ER Stress in a Diabetic Rat Model[J].Obes Surg,2017,27(5):1324-1334.
[12] Leung M,Xie M,Durmush E,et al.Weight Loss with Sleeve Gastrectomy in Obese Type 2 Diabetes Mellitus:Impact on Cardiac Function[J].Obes Surg,2016,26(2):321-326.
[13] 陈璐璐.中国2型糖尿病合并肥胖综合管理专家共识的解读[J].中华内分泌代谢杂志,2016,32(8):11-12.
[14] Nocca D,Loureiro M,Skalli EM,et al.Five-year results of laparoscopic sleeve gastrectomy for the treatment of severe obesity[J].Surg Endosc,2017,31(8):3251-3257.
[15] Gagner M,Hutchinson C,Rosenthal R.Fifth International Consensus Conference:current status of sleeve gastrectomy[J].Surg Obes Relat Dis,2016,12(4):750-756.
[16] 郭海军,朱江帆,马颖璋,等.肥胖症腹腔镜胃袖状切除术后脱发相关危险因素分析[J].中华消化外科杂志,2017,16(6):592-595.
[17] Li J,Lai D,Wu D.Laparoscopic Roux-en-Y Gastric Bypass Versus Laparoscopic Sleeve Gastrectomy to Treat Morbid Obesity-Related Comorbidities:a Systematic Review and Meta-analysis[J].Obes Surg,2016,26(2):429-442.
