PTEN介导的自噬对慢性酒精刺激引起的心肌损害的保护作用
2018-05-03高学忠黄隐青黄亦炜吴连拼
高学忠,黄隐青,林 丛,黄亦炜,张 鑫,吴连拼
长期大量饮酒,摄入体内的酒精及其代谢产生毒性更为巨大的乙醛等对心脏产生毒害作用,使心肌代谢和组织学异常,导致心肌变形、心脏扩大、心肌收缩力降低,心功能下降,临床上称之为酒精性心肌病(alcohol cardiomyopathy,ACM)[1]。随着现代饮酒人数的逐渐增多,饮酒量的加大,ACM的发病率也逐年上涨[2]。酒精对心脏的损害已成为威胁人类健康的世界性问题,越来越受到关注,但ACM的发病机制目前尚不十分清楚。
自噬(autophagy)是将机体内受损、变性或衰老的蛋白质以及细胞器运输到溶酶体内进行消化降解的动态过程,是维持机体内环境稳态的重要调节机制[3]。正常水平的自噬对心脏的结构和功能发挥着至关重要的作用。但自噬过度和自噬不足却可能导致疾病的发生。此外,大量文献表明自噬在多种心血管疾病中都扮演着重要的作用,如心肌缺血、再灌注、心肌肥大、糖尿病心肌病等均可诱导心肌内自噬水平增强[4,5]。因此自噬在不同的病理条件下,扮演着不同的角色,需要进一步的研究确认。而在慢性酒精心肌病的发生和发展过程中,自噬的研究却很少涉及。本研究通过建立小鼠酒精心肌病模型,观察心肌自噬的变化,旨在探讨自噬对酒精心肌病的作用以及人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)介导的自噬的发生机制。
1 材料和方法
1.1 材料、试剂与仪器:40只雄性C57BL/6小鼠,12周龄(温州医科大学实验动物中心);酒精饲料(南通特洛菲饲料科技有限公司);TUNEL试剂盒购自Roche公司。3_Methyladenine和SF1670试剂购自Sigma_Aldrich公司;PTEN抗体、LC3A/B抗体、p_mTOR抗体、mTOR抗体、β_actin抗体购自Abcam公司;AKT抗体、p_AKT抗体、p_s6抗体、s6抗体、cleaved Caspase_3抗体购自CST公司;荧光二抗驴抗兔IgG购自Invitrogen公司;激光共聚焦显微镜(日本Niko公司);Vevo7701型超声心动仪(加拿大公司)。
1.2 方法:
1.2.1 小鼠分组:40只雄性C57BL/6小鼠,随机分为四组,分别为对照组(Con)、慢性酒精心肌病组(EtOH)、慢性酒精心肌病+3_MA组及慢性酒精心肌病+PTEN抑制剂(SF1670)组,每组各10只。
1.2.2 小鼠慢性酒精心肌病模型的构建:对小鼠进行连续8周的含有4%(vol/vol)酒精饲料喂养[6]。对照小鼠用普通等量饲料喂养。连续喂养8周后进行超声心动图检测。
1.2.3 小鼠心脏功能检测:对照小鼠和给药小鼠,按照60mg/kg的比例,腹腔注射0.1%戊巴比妥钠麻醉。应用高分辨的彩色多普勒超声心动图分析小鼠心功能(Vevo 7701;Canada)。检测射血分数(ejection fraction,EF)、短轴缩短率(fractional shortening,FS),以上数值均连续检测5个心动周期,计算平均值。
1.2.4 心肌细胞凋亡检测:采用TUNEL染色法检测心肌细胞凋亡情况[9]。
1.2.5 提取心肌总蛋白:各心脏样品取出后,置于研钵中,加入液氮,在低温下迅速碾磨至粉末状,加一定量的组织总蛋白提取裂解液,4℃静置3h,置于超声细胞破碎仪中破碎细胞,15000rpm,4℃,15min离心,提取上清。
1.2.6 心脏LC3_II免疫荧光检测:各组小鼠心脏于4%的多聚甲醛固定24小时,置于20%的蔗糖脱水24小时,30%的蔗糖脱水24小时。用OCT包埋,包埋块固定于冰冻切片机上,调整切片厚度,6μm切片,制片。用LC3_II抗体4℃孵育过夜,然后用荧光二抗37℃孵育2小时,于共聚焦显微镜观察。
1.2.7 Western blot提取各组心肌组织蛋白,BCA蛋白定量后,对样品进行电泳,转膜和化学发光,条带扫描后应用Quantity one软件半定量分析蛋白条带的灰度值,相对表达量以各蛋白条带与对应β_actin条带灰度计算比值,评估目的蛋白的表达变化。
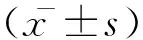
2 结果
2.1 慢性酒精刺激会促进C57BL/6小鼠心肌自噬的发生,诱导心肌凋亡:小鼠用酒精饲料连续喂养8周后,然后通过免疫印迹方法检测心肌细胞中自噬相关蛋白LC3_II的表达水平。和对照组小鼠相比,酒精刺激能够显著上调LC3_II的蛋白表达量(图1A,1B)。我们进一步使用免疫荧光染色方法对自噬进行检测,LC3_II的红色荧光斑点的积累也表明了酒精刺激能够促进小鼠心肌自噬的发生(图1D,1E)。此外,与对照小鼠相比,酒精组心肌内的凋亡相关蛋白cleaved caspase_3(c_CAS_3)的表达量也有显著的增加,说明酒精刺激能够诱发心肌细胞凋亡。
2.2 自噬的激活缓解酒精刺激引起的心功能下降和细胞凋亡:酒精刺激能够诱导自噬的激活,但自噬在不同疾病中发挥着不同的作用。为了确定自噬的激活在酒精性心肌病中的作用,我们利用自噬的抑制剂3_MA,按照10mg/kg剂量,每周腹腔注射一次。结果可以发现,酒精组小鼠心功能有所下降,同时射血分数和缩短分数都有所下调,而当共同作用3_MA和酒精的小鼠,心功能损伤的更为明显,EF、FS进一步下降(图2A_C)。酒精刺激能够诱导c_CAS_3蛋白的表达量增加,共同作用3_MA和酒精的小鼠,c_CAS_3的蛋白表达量也进一步的上调,表明细胞凋亡增加(图2D,2E)。由此说明酒精刺激诱导的自噬激活对酒精性心肌病具有保护作用。

图1 慢性酒精刺激诱导心肌自噬发生,促进细胞凋亡 注:A:Western blot的检测小鼠心肌组织LC3_II、c_CAS_3蛋白表达水平;B:LC3_II的表达量;C:c_CAS_3的表达量;D:免疫荧光检测自噬的发生;E:LC3阳性细胞的数量。与Con比较*P<0.01

图2 自噬在酒精引起的心功能紊乱中起到保护作用 注:A:各组小鼠的心功能示意图;B各组小鼠心脏射血分数;C:各组小鼠心脏缩短分数;D:Western blot的检测小鼠心肌组织c_CAS_3蛋白表达水平;E:c_CAS的表达量。与Con比较*P<0.05,**P<0.01;与EtOH比较#P<0.05
2.3 慢性酒精刺激上调PTEN蛋白的表达量:免疫印迹技术表明在慢性酒精刺激下,小鼠心脏内的PTEN蛋白表达水平有明显地增加(图3A,3B),PTEN表达的增加对AKT/mTOR有着进一步的负调控作用,AKT和mTOR的磷酸化水平下降(图3A,3C,3D),s6是mTOR的下游,其磷酸化水平也有显著下降(图3E)。

图3 慢性酒精刺激引起小鼠心脏内PTEN蛋白表达量上调 注:A:Western blot的检测小鼠心肌组织PTEN、p_AKT/AKT、p_mTOR/mTOR、p_s6/s6以及β_actin蛋白表达水平;B:PTEN的表达量;C:p_AKT/AKT的比值;D:p_mTOR/mTOR的比值;E:p_s6/s6的比值。与Con比较*P<0.01
2.4 慢性酒精刺激诱导的自噬上调主要由PTEN调控:为了探究PTEN在酒精诱导的自噬中的作用,我们利用PTEN的抑制剂SF1670,按照3mg/kg,每周皮下注射3次,8周后检测自噬的变化。与单纯作用酒精小鼠相比,共同作用酒精和SF1670的小鼠心肌内PTEN的表达量下调至正常水平,同时AKT、mTOR、s6的磷酸化水平也回升了。进一步检测自噬相关蛋白LC3_II的表达量,作用SF1670可以显著下调酒精刺激诱导的LC3_II表达量的增加,抑制自噬的发生。由此说明PTEN在酒精刺激诱导的自噬中发挥着重要的调控作用。
2.5 PTEN的抑制进一步加剧心肌细胞凋亡:为了证明PTEN活性对酒精引起的心脏功能损伤和心肌细胞凋亡具有作用,我们研究了SE1670在酒精刺激的小鼠心肌中的作用。通过检测c_CAS_3蛋白表达水平(图5A,5B)、TUNEL实验(图5C)得到结果,发现SF1670在抑制自噬激活情况下,明显加剧了酒精引起心肌细胞的凋亡。

图4 PTEN介导酒精刺激诱导的自噬 注:A:Western blot的检测小鼠心肌组织PTEN、p_AKT/AKT、p_mTOR/mTOR、p_s6/s6蛋白表达水平;B:PTEN的表达量;C:p_AKT/AKT的比值;D:p_mTOR/mTOR的比值;E:p_s6/s6的比值;F:Western blot的检测小鼠心肌组织LC3_II;G:LC3_II的表达量。与Con比较*P<0.01;与EtOH比较#P<0.01
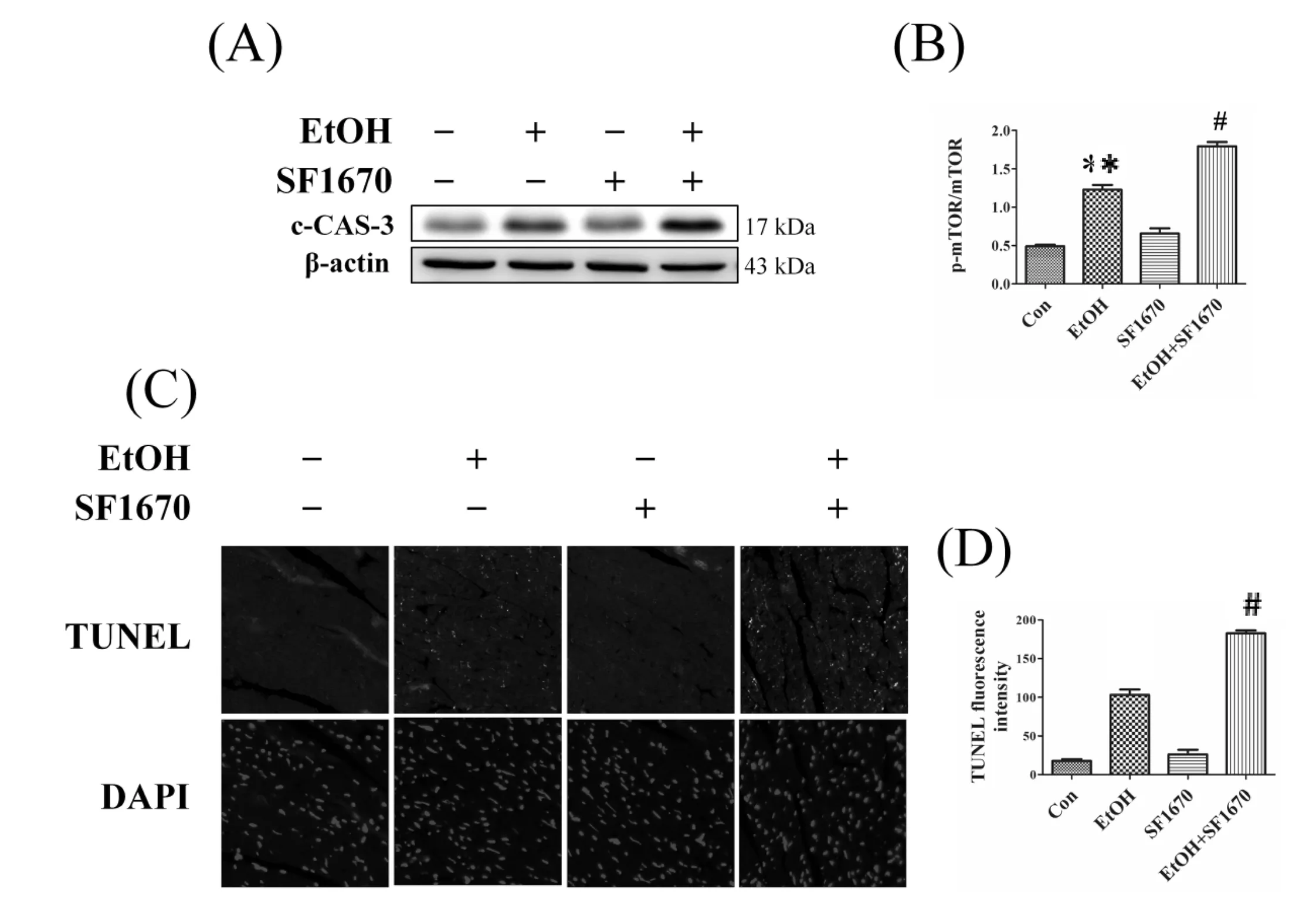
图5 PTEN的上调在酒精引起的细胞凋亡中起到保护作用 注:A:Western blot的检测小鼠心肌组织c_CAS_3;B:c_CAS_3的表达量;C:TUNEL检测细胞凋亡;D:TUNEL阳性细胞的数量。与Con比较*P<0.01;与EtOH比较#P<0.01
3 讨论
慢性酒精性心肌病发病率、死亡率逐年增高,已经成为21世纪严重威胁人类健康的疾病。酒精性心肌病的发病机制可能包括细胞坏死和凋亡、细胞器损伤、心肌收缩蛋白功能变化、钙稳态失衡、氧化应激以及神经内分泌系统紊乱等,但是确切机制尚无定论[7]。本研究采用酒精饲料喂养,使小鼠对酒精产生依赖,饲养8周后心脏超声显示小鼠心腔普遍扩大,心室壁变薄,心脏的收缩功能明显降低,小鼠心脏EF、FS都有显著的降低,说明慢性酒精刺激造成了心脏结构及功能受损。
心肌自噬是在生理和病理条件下普遍存在的生命现象,在心脏疾病的发生发展中具有双重作用,自噬在心血管应激和心脏疾病中都扮演着重要角色。然而,自噬在慢性酒精引起的心肌功能失调和心肌细胞凋亡中的确切作用仍是不清楚的。本研究证实了,3_MA抑制自噬都会加剧酒精引起的心脏功能失调和心肌细胞凋亡。
自噬的发生在不同病理条件下受到不同的信号通路影响而发挥不同的作用。研究指出,mTOR在自噬通路中起重要的调控作用。在营养、能量充足的情况下,mTORC1能使ULK1(自噬相关基因1同系物)的757丝氨酸位点磷酸化,抑制ULK1的活性,从而抑制AMPK和ULK1的作用,抑制自噬的发生[8]。另外,mTOR上游PI3K/AKT在心脏疾病中也发挥着重要角色,小鼠扩张型心肌病的模型中发现,运动可延长患有扩张型心肌病小鼠的寿命,主要原因是由于心肌PI3K被激活,自噬抑制所致。相反,心肌中PI3K的活性降低,诱导自噬的发生会明显加速心衰的进程,说明PI3K对维持心脏的结构和功能起重要作用[9]。PTEN是脂质磷酸酶,可通过特异性地促使PIP3的脱磷酸化,使之转化为PIP2,致使PIP3不能激活下游的AKT,从而抑制AKT的活性。相关文献也报道,PTEN可通过对PI3K/AKT/mTOR的抑制对自噬进行调控[9,10]。小鼠实验表明,在酒精刺激下,心肌内的PTEN蛋白表达量明显上调,与此同时,AKT/mTOR/s6的磷酸化水平下调,当作用PTEN抑制剂SF1670后,情况出现反转,同时LC3_II的表达量也下调,抑制自噬,进一步增加细胞凋亡。
综上所述,我们的研究证明了慢性酒精刺激激活自噬发生,对慢性酒精刺激引起的心脏毒性起到一定的保护作用,自噬的激活主要通过PTEN来调控的,有可能在今后为慢性酒精心肌病患者的治疗提供一种新的思路。
[1]Patel VB, Why HJ, Richardson PJ, et al. The effects of alcohol on the heart[J]. Adverse drug Reactions & Toxicological Reviews,1997,15(11):15-43.
[2]Morland J. Alcohol and the heart[J]. J Int Med,2016,279(10):362-364.
[3]Boya P, Reggiori F, Codogno P. Emerging regulation and functions of autophagy[J]. Nature Cell Biology,2013,15(6):713-720.
[4]Schiattarella GG, Hill JA. Therapeutic targeting of autophagy in cardiovascular disease[J]. J Molecular Cellular Cardiology,2016,95(12):86-93.
[5]Matsui Y, Takagi H, Qu X, et al. Distinct roles of autophagy in the heart during ischemia and reperfusion: roles of AMP_activated protein kinase and Beclin 1 in mediating autophagy[J]. Circulation Research,2007,100(11):914-922.
[6]Guo R, Hu N, Kandadi MR, et al. Facilitated ethanol metabolism promotes cardiomyocyte contractile dysfunction through autophagy in murine hearts[J]. Autophagy,2012,8(12):593-608.
[7]Skotzko CE, Vrinceanu A, Krueger L, et al. Alcohol use and congestive heart failure: incidence, importance, and approaches to improved history taking[J]. Heart Failure Reviews,2009,14(1):51-55.
[8]Chen G, Ke Z, Xu M, et al. Autophagy is a protective response to ethanol neurotoxicity[J]. Autophagy,2012,8(12):1577-1589.
[9]Ghigo A, Li M. Phosphoinositide 3_kinase: friend and foe in cardiovascular disease[J]. Frontiers Pharmacology,2015,6(2):161-169.
[10]Meric_Bernstam F, Akcakanat A, Chen H, et al. PIK3CA/PTEN mutations and Akt activation as markers of sensitivity to allosteric mTOR inhibitors[J]. Clinical Cancer Research J Ame Association Cancer Research,2012,18(9):1777-1789.
