恩度联合化疗治疗晚期难治性乳腺癌的疗效与安全性分析
2018-05-03雷雯宋国红李惠平张如艳邵彬王环冉然
雷雯,宋国红,李惠平,张如艳,邵彬,王环,冉然
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京100142
乳腺癌是一种女性最常见的恶性肿瘤[1],根据临床分期、病理类型及患者一般情况的不同,可以选择手术、化疗、放疗、内分泌治疗、靶向治疗等方式进行治疗。紫杉类和蒽环类药物是乳腺癌化学治疗的基石[2],而对于许多乳腺癌晚期患者,接受了含有紫杉醇类或蒽环类药物辅助化疗后1年内出现复发转移,或者转移后经二线治疗仍然失败,被认为难治性乳腺癌。恩度(重组人血管内皮抑素)作为一种抗血管生成的靶向药物,近年来逐渐应用于常规治疗困难的晚期转移性乳腺癌中[3-4]。本研究对34例进展迅速、治疗困难的晚期难治性乳腺癌使用恩度联合化疗方案的患者的临床资料进行回顾性分析,以探讨恩度在晚期难治性乳腺癌中的疗效及安全性。
1 资料与方法
1.1 一般资料
选取2014年12月至2016年6月北京大学肿瘤医院收治的接受恩度联合化疗治疗的晚期难治性乳腺癌患者34例,纳入标准:①均经病理组织学检查确诊为乳腺癌;②至少有1个可测量病灶;③重要脏器功能基本正常。晚期难治性乳腺癌标准[5]:既往接受过含紫杉醇类或蒽环类药物辅助化疗结束后1年内出现复发或转移者,或转移后经二线及以上化疗治疗失败者。34例晚期难治性乳腺癌患者中,年龄29~72岁,中位年龄48.5岁;均为女性;未绝经19例(55.9%),已绝经15例(44.1%);ER阳性18例(52.9%),PR阳性14例(41.2%),HER2阳性2例(5.9%),三阴性15例(44.1%);转移部位:内脏转移21例(61.8%);既往化疗线数:≤1线(辅助化疗结束1年内复发转移)11例(32.4%),≥2线23例(67.6%);既往用药情况:仅蒽环类0例,仅紫杉醇类4例(11.8%),蒽环类联合紫杉醇类30例(88.2%)。
1.2 治疗方案
所有患者使用的恩度给药方法为15 mg恩度加生理盐水500 ml均匀慢速滴注3 h,d1~d14,q21d。联合的化疗方案:吉西他滨1000 mg/m2,d1、d8,q21d;顺铂75~80 mg/m2,分2 d使用,q21d;卡铂AUC=4~5,d1,q21d;长春瑞滨25 mg/m2,d1、d8,q21d;吉西他滨1000 mg/m2,d1、d8+卡培他滨 1000 mg/m2,bid,P.O.d1~d14,q21d。
1.3 疗效及不良反应评价标准
1.3.1 疗效 可测量病灶的近期疗效评价按照实体肿瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST1.1)[6],分为完全缓解(CR):所有目标病灶消失,无新病灶出现;部分缓解(PR):基线病灶长径总和缩小>30%;稳定(SD):基线病灶长径总和有缩小但未达PR或有增大但未达PD;进展(PD)为基线病灶长径总和增加≥20%或出现新病灶。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%。疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。无进展生存时间(progression free survival,PFS)定义为开始治疗至第1次发生PD的时间或任何原因死亡的时间间隔。总生存期(overall survival,OS)计算从化疗开始之日起至死亡或末次随访之日止。1年生存率(one-year suivival)定义为随访患者第1年末的累积生存比。
1.3.2 不良反应 不良反应按美国国立癌症研究所不良反应事件通用术语标准(National Cancer Institute-Common Terminology Criteria for Adverse Events,NCI-CTC 4.0)进行判定[7],分为0~4级。
1.4 统计学方法
采用SPSS 18.0软件对数据进行统计分析。采用Kaplan-Meier方法计算累积生存率、绘制生存曲线,计算中位PFS及中位OS,使用Cox比例风险回归模型分析预后影响因素。以P﹤0.05为差异有统计学意义。
2 结果
2.1 疗效
34例乳腺癌患者均完成2周期以上化疗,均可评价疗效,接受恩度化疗周期数为2.0~11.52个,中位周期数为3.35个,34例患者接受恩度化疗周期数共147.0个周期。其中无CR患者,PR 6例(17.6%),SD 17例(50.0%),PD 11例(32.4%);ORR 17.6%(6/34),DCR 67.6%(23/34)。中位PFS为 4.04(95%CI:2.59~5.50)个月,详见图1。中位OS未能获得,详见图2。其中死亡11例,1年生存率为59.6%。根据临床病理特征区分亚组,多因素分析显示,亚组内ORR、DCR、1年生存率、PFS及OS比较,差异均无统计学意义(P﹥0.05),详见表1、表2。
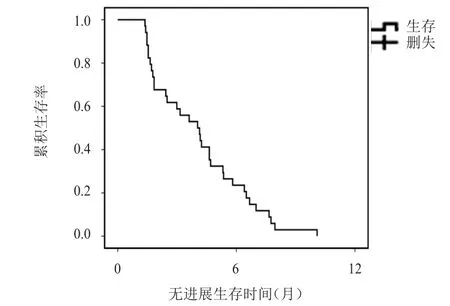
图1 34例晚期难治性乳腺癌患者的无进展生存曲线
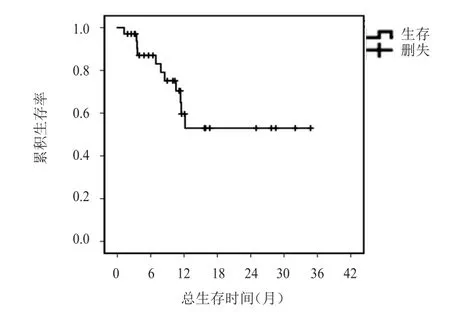
图2 34例晚期难治性乳腺癌患者的总生存曲线
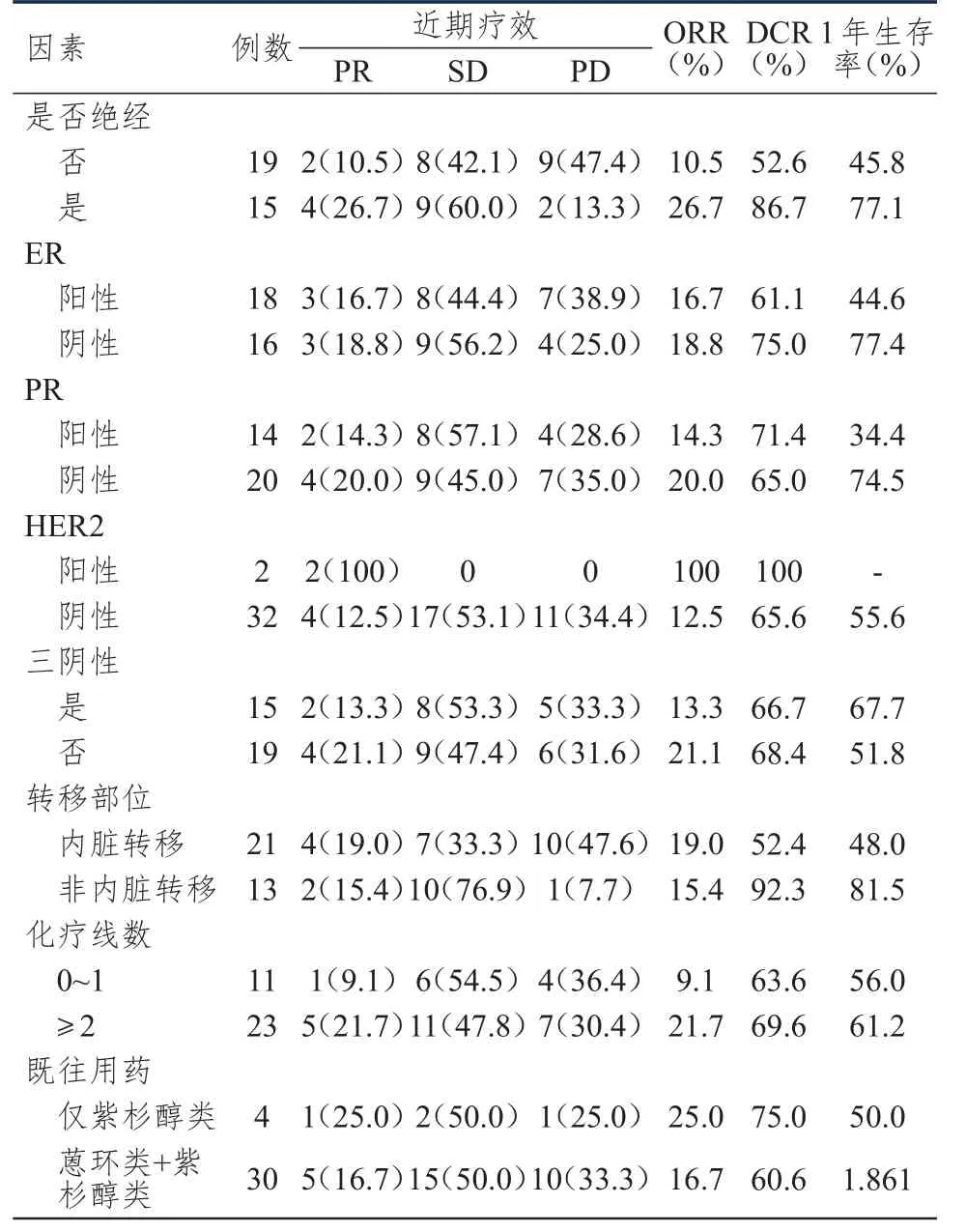
表1 影响乳腺癌患者ORR、DCR及1年生存率的因素分析

表2 影响34例难治性乳腺癌患者PFS及OS的多因素分析
2.2 不良反应发生情况
恩度联合化疗的整体安全性较好,其中1~2级骨髓抑制8例(23.5%),3~4级骨髓抑制3例(8.8%),乏力4例(11.8%),恶心3例(8.8%),神经毒性1例(2.9%),肝损伤1例(2.9%),失眠1例(2.9%),未观察到皮肤相关不良反应。
3 讨论
重组人血管内皮抑素(恩度)是由我国学者自主创新研发的人血管内皮抑素和抗肿瘤血管生成药物,其在动物肿瘤模型中的抗肿瘤作用至少为血管内皮抑素的2倍[8]。既往研究证实,恩度主要的生物学抗肿瘤机制包括通过抑制内皮前体细胞中血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor-2,VEGFR-2)的表达抑制肿瘤血管生成以及通过阻止细胞内表达基质金属蛋白酶 2(matrix metalloprotein,MMP-2)和 MMP-9从而阻止乳腺癌细胞的远处转移[9-10]。
回顾既往应用恩度联合化疗治疗晚期转移性乳腺癌的临床研究,Huang等[11]报道的恩度联合紫杉醇等治疗55例HER2阴性转移性乳腺癌的前瞻性临床研究,得出ORR为68.4%,中位PFS为10.8个月,本研究结果与之存在一定差异,分析其可能的原因为Huang等[11]的研究并非针对晚期难治性乳腺癌,入组样本中50.9%的病例均为一线化疗,2线及以上化疗的病例只有10.5%,而本研究入组患者2线及以上化疗的病例占67.6%,且88.2%的病例为蒽环类及紫杉醇类药物治疗后进展,纳入的2例HER2阳性乳腺癌患者均曾应用曲妥珠单抗的靶向治疗。
目前,晚期难治性乳腺癌无标准的治疗方案。回顾既往观察性研究,李丹等[12]报道的培美曲塞联合铂类治疗60例难治性乳腺癌患者的客观缓解率为36.7%,疾病控制率为70.0%,中位PFS为4.5个月;胡夕春等[13]报道的丝裂霉素加顺铂治疗38例难治性乳腺癌患者的ORR为33.3%,DCR为88.8%,中位肿瘤进展时间为4个月;袁泉等[14]报道的多西他赛、吉西他滨和奥沙利铂治疗7例难治性乳腺癌患者的ORR为71.42%,DCR为85.71%;梁旭等[15]报道的白蛋白结合型紫杉醇单药或联合方案治疗58例晚期难治性乳腺癌患者的ORR为13.8%,DCR为60.3%,中位PFS为4.0个月。综上所述,晚期难治性乳腺癌各化疗方案的疗效有所差异 ,ORR为 13.8%~71.42%,DCR为 60.3%~88.8%,中位PFS相似(4~4.5个月)。本研究所得结果与既往研究结果类似,但入组患者多是多线治疗后的耐药患者,因此认为恩度联合化疗对晚期难治性乳腺癌仍有一定疗效,是难治性乳腺癌的治疗选择之一。
三阴性乳腺癌是一组侵袭性强、进展较快、复发率高、预后较差的乳腺癌类型,由于缺乏激素受体及HER2的靶点,治疗选择相对较少,目前常用的治疗方式以铂类为基础的化疗。Miles等[16]的荟萃分析得出化疗联合贝伐珠单抗一线治疗晚期转移性三阴性乳腺癌的疗效明显优于单纯化疗,ORR提高19%(42%vs23%),PFS延长2.7个月(8.1个月vs5.4个月)。RIBBON-2是一项比较贝伐珠单抗联合化疗与单纯化疗二线治疗HER2阴性乳腺癌疗效的随机、双盲、对照的Ⅲ期临床试验[17],亚组分析结果显示三阴性乳腺癌贝伐珠单抗联合化疗的疗效明显优于单纯化疗(PFS:6.0个月vs2.7个月)。故对于晚期转移性三阴性乳腺癌,化疗基础上加用抗血管治疗优于单纯化疗,本试验的亚组分析中三阴性乳腺癌患者较总体并未显示出更显著的获益,分析其可能原因为本研究纳入的病例67.6%为二线及以上,恩度应用时间较晚,导致药物反应下降[18],但至少获得了与其他分子分型患者同样的疗效,因而对于临床有效的抗血管治疗,应尽早应用以提高疗效。
根据临床病理特征进行进一步分层比较,可以看出在绝经、内脏转移、组织学类型、既往治疗等亚组内PFS、OS及1年生存率方面比较,差异均无统计学意义(P﹥0.05),提示现有的临床病理特征不能很好地筛选适用人群。结合机制研究结果可以提示,检测血液中或组织中生物学标志物可能对筛选疗效更好的人群存在帮助,如血管内皮生长因子及VEGFR等在血液、组织中均存在的生物标志物,血管细胞间黏附因子-1、细胞间黏附因子-1、血管紧张素-2等血液学指标,低氧诱导因子-2、碳酸酐酶9等组织学指标等[19]。
恩度联合化疗的安全性较好,主要不良反应表现为乏力及血液学毒性。乏力均为1~2级,并未影响后续治疗。3~4级血液学毒性的发生率为8.8%,经积极临床处理,骨髓抑制均可恢复。
综上所述,恩度联合化疗是晚期难治性乳腺癌患者有效且安全的方案,但是否优于单纯化疗或与哪种药物联合治疗的疗效更佳尚未明确,且筛选表达特定生物学标志物的人群是否会获得更好的疗效也尚不可知,还需进一步扩大入组病例数量和更加详尽的基础研究数据加以论证。
[1]Bray F,Jemal A,Grey N,et al.Global cancer transitions according to the Human Development Index(2008-2030):a population-based study[J].Lancet Oncol,2012,13(8):790-801.
[2]Piccart-Gebhart MJ,Burzykowski T,Buyse M,et al.Taxanes alone or in combination with anthracyclines as firstline therapy of patients with metastatic breast cancer[J].J Clin Oncol,2008,26(12):1980-1986.
[3]Schneider BP,Wang M,Radovich M,et al.Association of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 genetic polymorphisms without comeinatrial of paclitaxel compared with paclitaxel plus bevacizumabin advanced breastcancer:ECOG 2100[J].J Clin Oncol,2008,26(28):4672-4678.
[4]Miller KD,Chap LI,Holmes FA,et al.Randomized phaseIII Trial of capecitabine compared with bevacizumab plus capecitabine inpatients with previously treated metastatic breast cancer[J].J Clin Oncol,2005,23(4):792-799.
[5]Perez EA,Hillman DW,Mailliard JA,et al.Randomized phase II study of two irinotecan schedules for patients with metastatic breast cancer refractory to an anthracycline,a taxane,or both[J].J Clin Oncol,2004,22(14):2849-2855.
[6]Eisenhauera EA,Therasseb P,Bogaertsc J,et al.New response evaluation criteria in solid tumours:Revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[7]Chen AP,Setser A,Anadkat MJ,et al.Grading dermatologic adverse events of cancer treatments:The Common Terminology Criteria for Adverse Events Version 4.0[J].J Am Acad Dermatol,2012,67(5):1025-1039.
[8]Ling Y,Yang Y,Lu N,et al.Endostar,a novel recombinant human endostatin,exerts antiangiogenic effect via blocking VEGF-induced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J].Biochem Biophys Res Commun,2007,361(1):79-84.
[9]Kumar A,Kumar R,Seenu V,et al.The role of 18F-FDG PET/NACT in evaluation of early response to neoadjuvant chemotherapy in patients with locally advanced breast cancer[J].Eur Radiol,2009,19(6):1347-1357.
[10]Folkman J.Anti-angiogenesis in cancer therapy-endostatin and its mechanisms of action[J].Exp Cell Res,2006,312(5):594-607.
[11]Huang W,Liu J,Wu F,et al.The efficacy and safety of endostar combined with taxane-based regimens for HER-2-negative metastatic breast cancer patients[J].Oncotarget,2016,7(21):31501-31507.
[12]李丹,朱悦茗,谢芳,等.培美曲塞联合铂类治疗难治性晚期乳腺癌疗效与安全性分析[J].现代肿瘤医学,2015,23(2):200-202.
[13]胡夕春,郭海宜,赵欣民,等.丝裂霉素加顺铂治疗难治性晚期乳腺癌[J].临床肿瘤学杂志,2006,11(8):594-597.
[14]袁泉,李河钊,李刚,等.多西他赛、吉西他滨和奥沙利铂治疗难治性乳腺癌[J].药物与临床,2007,4(21):44-45.
[15]梁旭,李惠平,邸立军,等.白蛋白结合型紫杉醇治疗晚期难治性乳腺癌的疗效及安全性分析[J].中国癌症杂志,2014,24(11):836-845.
[16]Miles DW,Diéras V,Cortés J,et al.First-line bevacizumab in combination with chemotherapy for HER2-negative metastatic breast cancer:pooled and subgroup analyses of data from 2447 patients[J].Ann Oncol,2013,24(11):2773-2780.
[17]Brufsky AM,Hurvitz S,Perez E,et al.RIBBON-2:a randomized,double-blind,placebo-controlled,phase III trial evaluating the efficacy and safety of bevacizumab in combination with chemotherapy for second-line treatment of human epidermal growth factor receptor 2-negative metastatic breast cancer[J].J Clin Oncol,2011,29(32):4286-4293.
[18]Macpherson GR,Ng SS,Forbes SL,et al.Anti-angiogenic activity of human endostatin is HIF-1-independent in vitro and sensitive to timing of treatment in a human saphenous vein assay[J].Mol Cancer Ther,2003,2(9):845-854.
[19]Bear HD,Tang G,Rastogi P,et al.Bevacizumab added to neoadjuvant chemotherapy for breast cancer[J].N Engl J Med,2012,366(4):310-320.
