ID3基因在逆转骨肉瘤顺铂耐药中的作用及其机制的研究
2018-05-03池晓峰姜宏杨东
池晓峰,姜宏,杨东
吉林省肿瘤医院骨及软组织肿瘤外科,长春 130000
骨肉瘤是一种高度侵袭性的恶性肿瘤,源自原始的骨形成间充质细胞,主要发生在骨骼生长和修复迅速的区域周围,如膝关节、股骨下骨和上胫骨[1]。顺铂(cisplatin,DDP)是骨肉瘤患者的常用化疗药物之一,具有广谱的抗肿瘤活性,但临床上初始化疗缓解后产生的多药耐药(multidrug resistance,MDR)现象严重影响其治疗效果[2-3]。分化抑制因子(inhibitors of differentiation,ID)在生物体中广泛表达,并且在多种肿瘤中呈现高表达的趋势[4]。ID3是ID蛋白家族的重要成员之一,其表达具有细胞类型的特异性[5-7]。据相关文献报道,ID3的表达差异与前列腺癌[5]、肺腺癌[6]以及卵巢癌[7]等多种肿瘤相关,然而,其在骨肉瘤中的作用机制及骨肉瘤细胞的顺铂耐药性方面尚不明确。本研究首先筛选了骨肉瘤顺铂耐药株;其次运用荧光定量聚合酶链反应(polymerase chain reaction,PCR)和 Western blot方法,检测了ID3基因与顺铂耐药的关系;最后通过细胞毒性实验与凋亡检测,辅以ID3基因过表达的手段,探讨了ID3基因过表达对骨肉瘤细胞顺铂耐药性的逆转作用,以期为骨肉瘤顺铂耐药性的诊断和治疗提供新的思路。
1 材料与方法
1.1 材料与试剂
人骨肉瘤细胞株U-2 OS购自美国ATCC公司;DDP购自Sigma公司;CCK8试剂购自碧云天生物技术有限公司;逆转录试剂盒购自宝生物工程(大连)有限公司;人ID3基因过表达载体及其阴性对照载体购自上海吉凯基因化学技术有限公司;ID3、P-糖蛋白(P-glycoprotein,P-gp)、Caspase-3、RhoE和人甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自Abcam公司。
1.2 顺铂耐药细胞株的筛选
以DDP为诱导剂,对人骨肉瘤细胞株U-2 OS采用大剂量冲击与逐步增加剂量相结合的方法,诱导建立顺铂耐药细胞系U-2 OS/DDP。U-2 OS/DDP和U-2 OS细胞置于RPMI 1640培养基,37℃、5%CO2孵育箱中培养。
1.3 细胞毒性实验
取对数生长期内U-2 OS/DDP细胞和U-2 OS细胞,以每孔3×104/ml接种于96孔板中,培养24 h后,用不同浓度DDP(0、0.5、1、5、10、15、20、30、40 μg/ml)进行细胞分组处理,实验过程中每组数据设置3个复孔作为平行实验,并采用CCK8方法检测U-2 OS/DDP细胞和U-2 OS细胞的生长抑制作用,并计算其半数抑制浓度(IC50)和耐药指数(resistant index,RI)。
1.4 实时荧光定量PCR检测ID3基因的表达
采用实时荧光定量PCR(qRT-PCR)法检测U-2 OS/DDP细胞和U-2 OS细胞中ID3的mRNA表达水平。采用TRIzol方法提取细胞的总RNA。总RNA用DNase除去残留的基因组DNA后,使用具有随机引物的逆转录第一链cDNA合成试剂盒(Revert Aid First Strand cDNA Synthesis Kit)进行逆转录。使用以下引物将得到的cDNA用作ABI 7500仪器上的PCR扩增的模板,人ID3正向引物:5'-ATGAAGGCGCTGAGCCCGGTGC-3',反向引物:5'-ACGGCCGAGTCAGTGGCAAAAGC-3';GAPDH正向引物:5'-CACCCACTCCTCCACCTTTG-3',反向引物:5'-CCACCACCCTGTTGCTGTAG-3'。实验过程中每组数据设置3个复孔作为平行实验,GAPDH作为内参对照。
1.5 Western blot检测ID3蛋白表达
采用Western blot法检测U-2 OS/DDP细胞和U-2 OS细胞中ID3蛋白的表达水平。常规方法提取细胞总蛋白后,使用SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶来分离等量的蛋白质,并转移到硝化纤维过滤膜(nitrocellulose filter membrane,NC)膜上,5%脱脂奶粉封闭后,使用一抗4℃孵育过夜,TBST洗膜后,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(ID3、P-gp、Caspase-3和RhoE)孵育,随后进行增强化学发光(enhanced chemiluminescent,ECL)显影。采用Image J分析软件进行灰度值定量分析,并将ID3与GAPDH的灰度比值作为ID3蛋白的相对表达量,实验过程中每组数据设置3个复孔作为平行实验。
1.6 ID3基因过表达对骨肉瘤细胞顺铂耐药性的逆转作用
人ID3基因过表达载体及其阴性对照载体购自上海吉凯基因化学技术有限公司,并通过脂质体Lipofectamine 2000将ID3基因过表达载体及其阴性对照载体导入U-2 OS细胞和U-2 OS/DDP细胞。不同浓度DDP(0、0.5、1、5、10、15、20、30、40 μg/ml)处理U-2 OS/DDP细胞后,采用CCK8方法再次检测各组细胞的生长抑制率;同时,选取0、1、2 μg/ml的转染组细胞,37℃、5%CO2培养箱培养24 h后,用Annexin V-FITC和PI双重染色法结合流式细胞术,评估经历凋亡的细胞百分比。实验过程中每组数据设置3个复孔作为平行实验。Annexin V阳性和PI阴性染色的细胞是早期凋亡细胞,而具有Annexin V和PI阳性染色的细胞处于细胞凋亡的晚期阶段。
1.7 统计学分析
采用GraphPad Prism 6.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用方差分析,采用Pearson相关分析法进行数据相关性分析。以P﹤0.05为差异有统计学意义。
2 结果
2.1 顺铂处理对骨肉瘤细胞生长功能的影响
不同浓度的顺铂药物作用于亲本细胞株U-2 OS和顺铂耐药株U-2 OS/DDP细胞24 h后,随着顺铂浓度(0.5、1、5、10、15、20、30、40 μg/ml)的增加,细胞株 U-2 OS(r2=0.885,P=0.004)及 U-2 OS/DDP(r2=0.970,P﹤0.001)的生长抑制率亦随之升高,并呈现出一定的剂量依赖性,详见表1。DDP对U-2 OS细胞的 IC50为 6.58 μg/ml,对U-2 OS/DDP细胞的 IC50为 19.89 μg/ml,U-2 OS/DDP 细胞对 DDP 的耐药指数(RI)为3.02。
2.2 骨肉瘤细胞中ID3基因的mRNA表达
qRT-PCR检测U-2 OS细胞及U-2 OS/DDP细胞中ID3基因的mRNA表达水平差异。结果显示,U-2 OS细胞中ID3基因的mRNA表达水平为(0.85±0.04),明显高于U-2 OS/DDP细胞的(0.31±0.04),差异有统计学意义(t=16.534,P﹤0.001)。(图1)
表1 不同浓度的DDP对U-2 OS细胞及U-2 OS/DDP细胞生长抑制率的影响(%,±s)

表1 不同浓度的DDP对U-2 OS细胞及U-2 OS/DDP细胞生长抑制率的影响(%,±s)
?
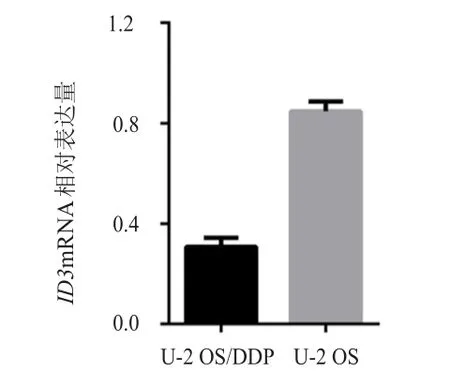
图1 qRT-PCR法检测U-2 OS细胞及U-2 OS/DDP细胞中ID3基因的mRNA表达
2.3 骨肉瘤细胞中ID3蛋白的表达
Western blot法检测ID3蛋白在U-2 OS细胞及U-2 OS/DDP细胞中的表达差异。结果显示,U-2 OS细胞中ID3蛋白的表达水平为(0.30±0.03),明显高于U-2 OS/DDP细胞的(0.14±0.03),差异有统计学意义(t=6.532,P﹤0.001)。(图2)

图2 U-2 OS细胞及U-2 OS/DDP细胞中ID3蛋白表达情况
2.4 ID3基因过表达对骨肉瘤细胞耐药性的逆转作用
U-2 OS/DDP细胞转染ID3过表达载体和阴性对照载体后,分别加入不同浓度DDP(0.5、1、5、10、15、20、30、40 μg/ml),ID3过表达耐药株U-2 OS/DDP细胞(ID3+组)与阴性对照耐药株U-2 OS/DDP细胞(对照组)的生长抑制率情况详见表2。与对照组比较,加入DDP后ID3+组U-2 OS/DDP细胞的抑制率明显上升,DDP耐药性明显下降(r2=0.936,P﹤0.001),细胞的IC50下降至 9.83 μg/ml,其逆转倍数为2.02倍。
2.5 ID3基因表达对U-2 OS/DDP凋亡的影响
U-2 OS/DDP细胞转染ID3过表达载体和阴性对照载体后,分别加入不同浓度DDP(0、1、2 μg/ml),流式细胞仪Annexin V-FITC和PI双染法测定细胞凋亡率,详见图3。与对照组比较,ID3+组U-2 OS/DDP细胞凋亡率提高(P﹤0.05);随着DDP浓度的增高,对照组和ID3+组的早期凋亡细胞所占百分比均随之增加。
表2 ID3基因过表达对U-2 OS/DDP细胞耐药性的逆转作用(%,±s)
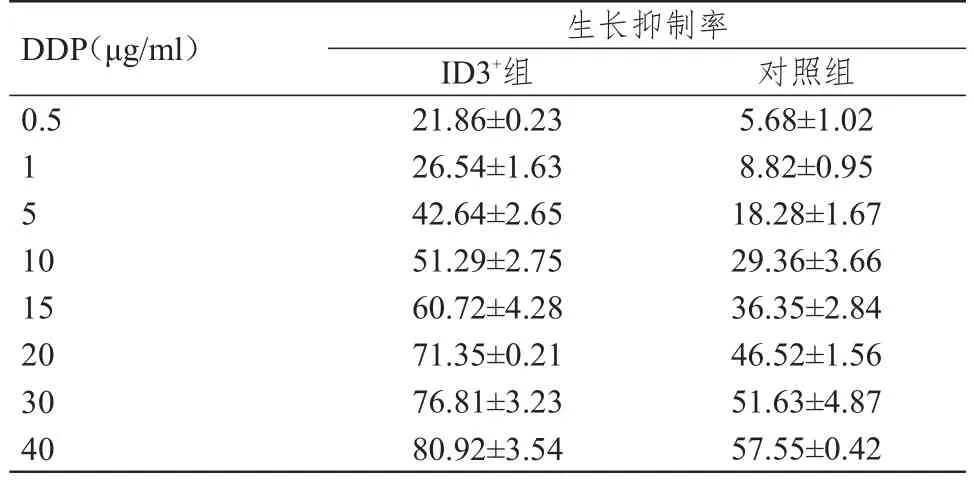
表2 ID3基因过表达对U-2 OS/DDP细胞耐药性的逆转作用(%,±s)
生长抑制率DDP(μg/ml)0.5 151 0 15 20 30 40 ID3+组21.86±0.23 26.54±1.63 42.64±2.65 51.29±2.75 60.72±4.28 71.35±0.21 76.81±3.23 80.92±3.54对照组5.68±1.02 8.82±0.95 18.28±1.67 29.36±3.66 36.35±2.84 46.52±1.56 51.63±4.87 57.55±0.42
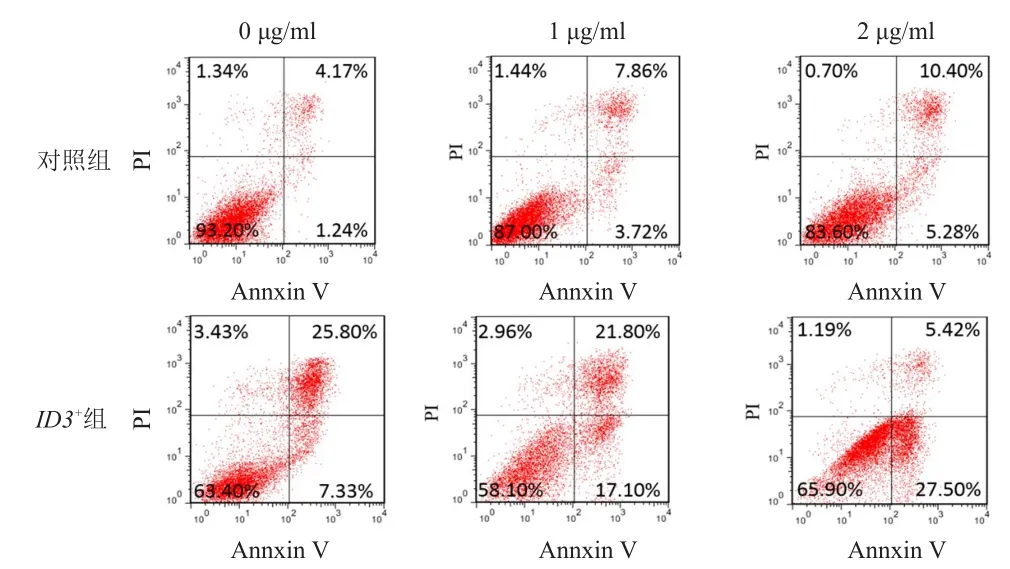
图3 不同浓度DDP作用下ID3基因表达对U-2 OS/DDP细胞凋亡的影响
2.6 Western blot法检测ID3基因过表达对P-gp、RhoE和Caspase-3表达的影响
为了进一步探讨ID3基因对U-2 OS/DDP顺铂耐药性的影响,本研究采用了Western blot法检测U-2 OS/DDP细胞中P-gp、RhoE和Caspase-3的表达情况,检测结果详见图4。对照组RhoE、Caspase-3、P-gp蛋白表达分别为(0.148±0.005)、(0.196±0.012)、(0.662±0.013),与对照组比较,ID3+组上调了RhoE(0.325±0.003,t=57.31,P﹤0.05)和Caspase-3蛋白的表达水平(0.797±0.024,t=38.37,P﹤0.05),但却下调了P-gp蛋白的表达水平(0.159±0.004,t=63.50,P﹤0.05)。

图4 ID3过表达对U-2 OS/DDP细胞中P-gp、RhoE和Caspase-3表达的影响
3 讨论
ID3是一种螺旋-环-螺旋(helix-loop-helix,HLH)转录因子,负责调控碱性螺旋-环-螺旋(bHLH),进而抑制细胞分化、促进细胞增殖[8]。有研究发现,ID3在生物体中起着致癌的作用,并且在不同的恶性肿瘤中有表达差异[5-7]。ID3对肿瘤的正向调节作用,使其有望成为肿瘤治疗的新靶点。顺铂具有抗癌活性,是癌症治疗的重要化疗药物,但由于肿瘤细胞产生的耐药性,使得顺铂药物的治疗达到了瓶颈。有研究发现,腺病毒介导的ID3基因的过表达效应可以抑制肺癌细胞A549的细胞增殖,促进其凋亡[6,9]。Koyama等[10]用CDDP诱导骨肉瘤细胞MG63时发现,CDDP诱导的细胞凋亡与ID3基因的短暂上调有关。本研究中,筛选了U-2 OS细胞的顺铂耐药株(U-2 OS/DDP),并对亲本株U-2 OS和耐药株U-2 OS/DDP中的ID3mRNA水平和蛋白水平进行了检测,结果发现,耐药株U-2 OS/DDP中ID3的转录水平和蛋白水平均明显低于亲本株的U-2 OS。
肿瘤耐药株中,凋亡抑制基因的表达增加,同时伴随着细胞增殖能力的增强以及凋亡能力的减弱。Koyama等[10]的研究发现,ID3基因过表达的骨肉瘤细胞MG63中,CDDP的诱导可增强ROS效应和Caspase-3的活性。Trougakos等[11]研究发现,ID3基因高表达的骨肉瘤细胞中,与细胞增殖相关的PCNA反而低表达。Chen等[9]研究发现,ID3基因的表达强度与A549细胞的顺铂耐药性有关,ID3基因的过表达可以逆转耐药株的顺铂耐药性。本研究为探究ID3基因在骨肉瘤顺铂耐药株U-2 OS/DDP中的耐药作用,先后对U-2 OS和U-2 OS/DDP、阴性对照耐药株(对照)和ID3基因过表达耐药株(ID3+)受不同浓度的顺铂作用后的细胞增殖活性进行了检测,结果显示,DDP对U-2 OS细胞的IC50为6.58 μg/ml,对U-2 OS/DDP细胞的IC50为19.89 μg/ml,U-2 OS/DDP细胞对DDP的耐药指数(RI)为3.02。与对照组比较,加入顺铂后ID3+组U-2 OS/DDP细胞的抑制率明显上升,顺铂耐药性明显下降,这表明ID3基因过表达对骨肉瘤细胞耐药性的逆转作用。值得注意的是,DDP在5 μg/ml时即可明显抑制亲本U-2 OS细胞的增殖,对顺铂耐药株U-2 OS/DDP也有一定程度的抑制作用,但在DDP的浓度达到20 μg/ml左右时,U-2 OS/DDP细胞的增殖抑制率才能达到相应的效果。同时,顺铂耐药细胞株U-2 OS/DDP的RI达到3.0以上,说明U-2 OS/DDP耐药株持有较好的耐药特性,达到后续实验的要求。ID3基因过表达后,DDP对U-2 OS/DDP细胞的IC50降至 9.83 μg/ml,其逆转倍数为 2.02 倍。随后,本研究又对对照组耐药株和ID3+组耐药株中的细胞凋亡情况进行了检测,结果发现,ID3+组细胞的凋亡率高于对照组,且随着DDP浓度的增加,早期凋亡细胞所占百分比亦随之增加。结合U-2 OS和U-2 OS/DDP细胞中ID3基因和蛋白的表达水平差异,推测ID3基因的表达降低骨肉瘤细胞的顺铂耐药性,其过表达效应可以逆转U-2 OS/DDP细胞对顺铂的耐药性。此结果进一步证明,ID3基因在骨肉瘤细胞顺铂耐药机制中起到关键作用。
MDR现象的产生是导致化疗失败的主要原因之一。P-gp由MDR1基因编码,可与药物结合,随后将药物排出体外,从而降低胞内药物浓度,即产生耐药性[12]。P-gp的表达高低与肿瘤细胞对化疗药物的敏感程度呈负相关[13]。RhoE是RhoGTPase家族成员之一,在肺癌细胞中表达下调,可促进肿瘤细胞的侵袭和转移[14],而RhoE的上调表达,则可能起到抑制肿瘤的作用[15]。肿瘤细胞的耐药性与细胞凋亡呈负相关,Caspase-3作为细胞凋亡的执行者,与肿瘤细胞的耐药性密切相关[16]。本研究采用Western blot法对ID3+耐药株和对照耐药株中的P-gp、RhoE和Caspase-3的蛋白水平表达进行了检测。结果显示,ID3过表达后,P-gp蛋白水平下降,RhoE和Caspase-3的蛋白水平上升,此结果进一步体现出ID3基因在骨肉瘤细胞顺铂耐药中的逆转作用。
[1]Ottaviani G,Jaffe N.The epidemiology of osteosarcoma[J].Cancer Treat Res,2009,152:3-13.
[2]Moore DD,Luu HH.Osteosarcoma[J].Cancer Treat Res,2014,162:65-92.
[3]黄涛,吕刚,高大新,等.中药制剂艾迪联合顺铂诱导骨肉瘤细胞凋亡[J].中国骨伤,2005,18(6):349-351.
[4]陈芳芳.Id3基因表达在逆转肺腺癌细胞顺铂耐药中的作用及机制研究[D].广州:南方医科大学,2016.
[5]Lim RW,Wu JM.Molecular mechanisms regulating expression and function of transcription regulator inhibitor of differentiation 3[J].Acta Pharmacol Sin,2005,26(12):1409-1420.
[6]Chen FF,Liu Y,Wang F,et al.Effects of upregulation of Id3 in human lung adenocarcinoma cells on proliferation,apoptosis,mobility and tumorigenicity[J].Cancer Gene Ther,2015,22(9):431-437.
[7]Arnold JM,Mok SC,Purdie D,et al.Decreased expression of the Id3 gene at 1p36.1 in ovarian adenocarcinomas[J].Br J Cancer,2001,84(3):352-359.
[8]Norton JD.ID helix-loop-helix proteins in cell growth,differentiation and tumorigenesis[J].J Cell Sci,2000,113(Pt 22):3897-3905.
[9]Chen F,Zhao Q,Wang S,et al.Upregulation of Id3 inhibits cell proliferation and induces apoptosis in A549/DDP human lung cancer cells in vitro[J].Mol Med Rep,2016,14(1):313-318.
[10]Koyama T,Suzuki H,Imakiire A,et al.Id3-mediated enhancement of cisplatin-induced apoptosis in a sarcoma cell line MG-63[J].Anticancer Res,2004,24(3a):1519-1524.
[11]Trougakos IP,Chondrogianni N,Amarantos I,et al.Genome-wide transcriptome profile of the human osteosarcoma Sa OS and U-2 OS cell lines[J].Cancer Genet Cytogenet,2010,196(2):109-118.
[12]Mealey KL,Barhoumi R,Burghardt RC,et al.Doxycycline induces expression of P glycoprotein in MCF-7 breast carcinoma cells[J].Antimicrob Agents Chemother,2002,46(3):755-761.
[13]Stordal B,Hamon M,McEneaney V,et al.Resistance to paclitaxel in a cisplatin-resistant ovarian cancer cell line is mediated by P-glycoprotein[J].PLoS One,2012,7(7):e40717.
[14]Grise F,Sena S,Bidaud-Meynard A,et al.Rnd3/RhoE Is down-regulated in hepatocellular carcinoma and controls cellular invasion[J].Hepatology,2012,55(6):1766-1775.
[15]武毅,郭丽丽,刘京豪,等.MiR-503逆转肺癌耐药细胞株A549/DDP的耐药性及其机制研究[J].中国肺癌杂志,2014,17(1):1-7.
[16]Cummings BS,Schnellmann RG.Cisplatin-induced renal cell apoptosis:caspase 3-dependent and-independent pathways[J].J Pharmacol Exp Ther,2002,302(1):8-17.
