RNA干扰FAK表达抑制宫颈癌细胞侵袭、迁移能力的研究
2018-05-03封菊苑中甫邱海峰
封菊,苑中甫,邱海峰
焦作煤业(集团)有限责任公司中央医院妇产科,河南 焦作 454000
宫颈癌是妇科常见的生殖系统恶性肿瘤,严重威胁女性的健康,近年来的发病率呈现年轻化趋势,且发病率在全球范围内居女性恶性肿瘤的第2位、常见恶性肿瘤的第4位[1]。宫颈癌的发生、发展与癌基因的抑制和抑癌基因的激活等因素有关[2]。目前,对于宫颈癌的发生、发展机制还处于研究阶段,随着分子生物科技的发展,宫颈癌诊断和治疗的研究重点逐渐转移到分子水平上[3]。黏着斑激酶(focal adhesion kinase,FAK)是一种存在于细胞质的非受体酪氨酸激酶,在多种组织中高表达且具有较高的蛋白同源性,是细胞内多条信号传导通路的关键因子,在肿瘤的进展、增殖、凋亡等过程中发挥重要的调节作用[4]。据研究,FAK在大肠癌、前列腺癌、乳腺癌、卵巢癌、甲状腺癌、肝癌、胃癌中异常表达,与细胞的侵袭、迁移和恶性增殖有关[5-6]。但FAK在宫颈癌中的报道较少,所以本研究通过RNA干扰FAK的表达,研究其对宫颈癌细胞侵袭、迁移能力的影响以及作用机制,以期为宫颈癌的诊断、治疗提供理论依据。
1 材料与方法
1.1 材料
宫颈癌HeLa细胞株购自中国科学院上海细胞库;FAK-pGenesil-siRNA真核表达载体由郑州大学实验室保存;Transwell小室购自美国Corning公司;胎牛血清、DMEM培养基购自美国Gibco公司;Lipofectamine 2000转染试剂盒购自美国Invitrogen公司;蛋白提取试剂盒购自上海碧云天公司;FAK抗体、基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2)抗体、基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)抗体、上皮细胞钙黏蛋白(epithelial-cadherin,E-cadherin)抗体、β-actin抗体、鼠抗兔二抗均购自美国abcam公司。
1.2 细胞培养
将冻存的细胞置于37℃水浴锅中至完全溶解,加入新鲜的含10%胎牛血清、100 U/ml青霉素、0.1 mg/ml链霉素的DMEM培养基,置于37℃、5%CO2的培养箱中,每1~2 d更换新鲜培养基,倒置显微镜下观察细胞生长状态,0.25%胰酶消化收集细胞进行传代,取生长状态良好的对数期细胞用于后续实验。
1.3 细胞转染
细胞转染前1 h将细胞培养基更换为无抗生素的培养基,胰酶消化成单细胞悬液,计数,以每孔1×106接种于6孔板上,置于恒温培养箱中培养过夜,待细胞融合度达80%左右时按转染试剂说明书进行转染。实验分3组,空白对照组:Lipofectamine 2000;阴性对照组:Lipofectamine 2000,FAK-pGenesil-Ctrl;干扰组 :Lipofectamine 2000,FAK-pGenesil-siRNA。置于37℃、5%CO2的培养箱中培养6 h后更换含10%胎牛血清和双抗的培养基培养48 h,Western blot法检测转染效果。
1.4 Transwell法检测细胞的迁移、侵袭能力
实验前将提前配置好的Matrigel胶包被在Transwell小室基底膜的上室,37℃,30 min,紫外线照射过夜。取转染培养48 h的细胞胰酶消化,用无血清培养基重悬成单细胞悬液,调整细胞密度至1×106;取200 μl细胞悬液加入已包被基底膜的小室上室中,下室中加入600 μl 10%胎牛血清的培养基作为趋化因子,置于24孔板中,37℃、5%CO2的培养箱中培养48 h后,用棉签轻轻拭去Matrigel胶和上室中未穿出的细胞,磷酸盐缓冲液(PBS)清洗3次,95%乙醇固定15 min,瑞士染色20 min,在倒置显微镜下取5个视野(上、下、左、右、中)计数,取平均数,表示细胞侵袭、迁移能力,每组3个复孔。迁移实验中小室上室不包被Matrigel胶,其余与侵袭实验相同。
1.5 Western blot法检测转染细胞中MMP-2、MMP-9、E-cadherin的蛋白表达量
取各组转染48 h的宫颈癌细胞,加入1 ml细胞裂解液和10 μl苯甲基磺酰氟(phenylemthanesulfonyl flyoride,PMSF),冰上放置30 min,在4 ℃离心机中12 000 rpm离心20 min,将上清移至干净的Eppendorf管中,-20℃保存,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。采用12%的分离胶和5%的浓缩胶覆盖在电泳槽中,加入变性蛋白样品和1×上样缓冲液,接入电压电泳,待溴酚蓝到达胶的底部,终止电泳,去除浓缩胶,保留分离胶。将凝胶转入聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%的脱脂奶粉封闭2 h,加入一抗,4℃孵育过夜,Tris-HCl缓冲盐溶液+Tween(TBST)清洗3次,每次10 min,加入二抗,室温摇床上孵育1 h,TBST清洗3次,每次10 min。显色液进行显色,反应15 min,晾干。用凝胶成像系统进行分析,以目的条带灰度值与内参β-actin灰度值的比值为各目的蛋白的相对表达量。
1.6 统计学分析
采用SPSS 22.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间比较采用LSD-t检验,以P﹤0.05为差异有统计学意义。
2 结果
2.1 RNA干扰宫颈癌细胞对FAK蛋白表达的影响
Western blot法检测FAK蛋白表达情况,空白对照组、阴性对照组、干扰组中宫颈癌细胞FAK蛋白的表达量分别为(0.735±0.082)、(0.715±0.091)、(0.362±0.049)。阴性对照组细胞中FAK蛋白表达量与空白对照组比较,差异无统计学意义(P﹥0.05);干扰组细胞中FAK蛋白表达水平低于空白对照组及阴性对照组,差异均有统计学意义(P﹤0.05)。(图1、表1)

图1 RNA干扰宫颈癌细胞对FAK蛋白表达的影响
表1 RNA干扰宫颈癌细胞对FAK蛋白表达的影响(±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别FAK蛋白表达量
2.2 RNA干扰宫颈癌细胞对其迁移能力的影响
Transwell法检测宫颈癌细胞株HeLa转染48 h后迁移能力的变化。空白对照组、阴性对照组、干扰组细胞的迁移数分别为(142.620±15.142)、(138.643±10.275)、(45.733±3.565)。阴性对照组与空白对照组迁移细胞数比较,差异无统计学意义(P﹥0.05);干扰组的迁移细胞数少于阴性对照组与空白对照组,差异均有统计学意义(P﹤0.05)。(表2)
表2 RNA干扰宫颈癌细胞对其迁移能力的影响(±s)

表2 RNA干扰宫颈癌细胞对其迁移能力的影响(±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
?
2.3 RNA干扰宫颈癌细胞对其侵袭能力的影响
Transwell法检测宫颈癌细胞株HeLa转染48 h后侵袭能力的变化。空白对照组、阴性对照组、干扰组细胞的侵袭数分别为(113.550±9.432)、(109.837±9.109)、(30.254±2.141)。阴性对照组与空白对照组侵袭细胞数比较,差异无统计学意义(P﹥0.05);干扰组的侵袭细胞数少于阴性对照组与空白对照组,差异均有统计学意义(P﹤0.05)。(表3)
表3 RNA干扰宫颈癌细胞对其侵袭能力的影响(±s)

表3 RNA干扰宫颈癌细胞对其侵袭能力的影响(±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
?
2.4 RNA干扰对宫颈癌细胞中MMP-2、MMP-9、E-cadherin蛋白表达的影响
Western blot法检测转染后细胞中MMP-2、MMP-9、E-cadherin蛋白表达量的变化。阴性对照组细胞中MMP-2、MMP-9和E-cadherin的蛋白表达量与空白对照组比较,差异均无统计学意义(P﹥0.05);干扰组细胞中MMP-2和MMP-9的蛋白表达量低于空白对照组和阴性对照组,E-cadherin的蛋白表达量高于空白对照组和阴性对照组,差异均有统计学意义(P﹤0.05)。(图2、表4)

图2 RNA干扰对宫颈癌细胞中MMP-2、MMP-9、E-cadherin蛋白表达的影响
表4 RNA干扰对宫颈癌细胞中MMP-2、MMP-9、E-cadherin蛋白表达量的影响(±s)
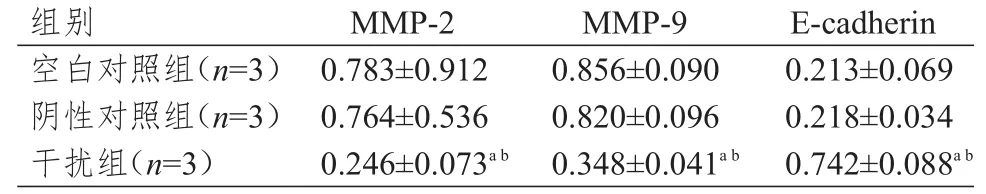
表4 RNA干扰对宫颈癌细胞中MMP-2、MMP-9、E-cadherin蛋白表达量的影响(±s)
注:a与空白对照组比较,P<0.05;b与阴性对照组比较,P<0.05
?
3 讨论
宫颈癌的治疗一般采取手术与放化疗等方式,但仍然有部分患者死于复发和远处转移,因此需要寻找更加明确的反映宫颈癌发生、发展的分子标志物,为宫颈癌的治疗方案提供合理的理论依据[7]。FAK首次发现于转染的V-Src鸡胚成纤维细胞中,位于人染色体8q24,相对分子质量为125 kD,共翻译1052个氨基酸[8]。研究报道证实,FAK在多种实体和非实体肿瘤中高表达,参与细胞的黏附、增殖、运动、转移等生命过程[9]。当细胞外基质与整合素受体群和细胞发生反应时,活化FAK,对细胞黏附、运动、迁移具有重要意义[10]。FAK可以与Src激酶形成复合物,活化促分裂素原活化蛋白激酶等下游蛋白,从而调节肿瘤细胞的侵袭、迁移、生长等过程[12-13]。研究报道表明,PF-00562271、VS-4718、VS-6063等FAK抑制剂可抑制肿瘤细胞的增殖、侵袭、迁移,因此可将FAK作为肿瘤疾病治疗的分子靶点[14]。在宫颈癌中,FAK的表达量随着宫颈癌病变临床分期、淋巴结转移等的发展逐渐增高[15]。但关于FAK对宫颈癌细胞侵袭、迁移及其作用机制的研究较少。本研究通过靶向FAK的siRNA质粒,转染宫颈癌HeLa细胞株,发现FAK表达量下调可以抑制细胞的侵袭、迁移能力,所以推测FAK可能与侵袭、迁移相关蛋白作用,从而阻碍肿瘤细胞的运动。
恶性肿瘤的基本生物学特征为细胞的侵袭、迁移,其作用机制一直是研究的热点问题。研究报道显示,恶性肿瘤侵袭、迁移的重要机制之一是上皮-间质转化(epithelial-mesenchymal transition,EMT),其主要标志是E-cadherin等上皮标志物表达量降低[16-17]。EMT是指正常情况和病变情况下,极性上皮细胞失去极性,黏附力下降,从而极易脱离细胞群而发生侵袭、迁移[18]。在结肠癌中,FAK的表达量降低可使E-cadherin的表达上升并增加细胞的黏附性,抑制肿瘤细胞的扩散、转移[19]。MMP是EMT的标志分子,能降解细胞外机制,破坏细胞基底膜的连续性和完整性,从而引起胰腺癌、肝癌、乳腺癌细胞的增殖和侵袭[20-21]。研究表明FAK信号通路可以促进MMP尤其是MMP-2、MMP-9的分泌,从而诱导血管生成、细胞浸润[18]。所以为了探究FAK影响宫颈癌细胞侵袭、迁移的作用机制,本实验检测了各组细胞中MMP-2、MMP-9、E-cadherin的表达,结果发现转染了siRNA重组质粒的细胞中MMP-2、MMP-9的表达量降低,E-cadherin的表达量升高,表明FAK通过调控MMP-2、MMP-9、E-cadherin等EMT标志物的表达量进而影响细胞的侵袭、迁移。
综上所述,RNA干扰FAK的表达通过影响细胞EMT过程从而抑制宫颈癌HeLa细胞的侵袭、迁移能力,阻碍肿瘤的发生、发展。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CACancer J Clin,2011,61(2):69-90.
[2]李苗,刘芳芳,邸媛媛,等.DNA定量分析联合阴道镜在诊断宫颈癌及高级别宫颈上皮内瘤变中的价值[J].中国妇幼保健,2012,27(18):2841-2844.
[3]王翔宇,许晋铨,孙丽,等.Rsf-1/HBXAP基因在宫颈癌中的表达及临床病理意义[J].现代妇产科进展,2017,26(2):104-108.
[4]陈瑛,王丹丹,朱虹,等.抗肿瘤新靶点黏着斑激酶FAK及其抑制剂研究进展[J].中国现代应用药学,2016,33(2):255-260.
[5]Shanthi E,Krishna MH,Arunesh GM,et al.Focal adhesion kinase inhibitors in the treatment of metastatic cancer:a patent review[J].Expert Opin Ther Pat,2014,24(10):1077-1100.
[6]李吉友,贾栋.抑制FAK的表达对人胃癌细胞SGC-7901凋亡的影响[J].现代肿瘤医学,2017,25(1):34-37.
[7]王静雯,王思念,孙锁柱,等.CXCR7沉默对HeLa细胞侵袭和迁移能力的影响及其在宫颈癌中的表达[J].国际妇产科学杂志,2017,44(2):163-166;后插1页.
[8]Schaller MD,Borgman CA,Cobb BS,et al.pp125FAK a structurally distinctive protein-tyrosine kinase associated with focal adhesions[J].Proc Natl Acad Sci U S A,1992,89(11):5192-5196.
[9]高宁,张静,杜娟,等.沉默黏着斑激酶促进人胃癌SGC-7901细胞骨架蛋白解聚及细胞形态损伤[J].中国组织化学与细胞化学杂志,2017,26(1):7-12.
[10]Brami-Cherrier K,Gervasi N,Arsenieva D,et al.FAK dimerization controls its kinase-dependent functions at focal adhesions[J].EMBO J,2014,33(4):356-370.
[11]Nader GP,Ezratty EJ,Gundersen GG.FAK,talin and PIPKIγ regulate endocytosed integrin activation to polarize focal adhesion assembly[J].Nat Cell Biol,2016,18(5):491-503.
[12]Liu L,Zong C,Li B,et al.The interaction between β1 integrins and ERK1/2 in osteogenic differentiation of human mesenchymal stem cells under fluid shear stress modelled by a perfusion system[J].J Tissue Eng Regen Med,2014,8(2):85-96.
[13]O’Brien S,Golubovskaya VM,Conroy J,et al.FAK inhibition with small molecule inhibitor Y15 decreases viability,clonogenicity,and cell attachment in thyroid cancer cell lines and synergizes with targeted therapeutics[J].Oncotarget,2014,5(17):7945-7959.
[14]Lee BY,Timpson P,Horvath LG,et al.FAK signaling in human cancer as a target for therapeutics[J].Pharmacol Ther,2015,146:132-149.
[15]郝臻凤,王娟,周留林,等.FAK在宫颈癌中的表达及临床意义[J].扬州大学学报:农业与生命科学版,2016,37(4):21-26.
[16]李晓锋,陈葳,李旭,等.宫颈癌细胞系中EMT相关基因的表达及其意义[J].西安交通大学学报(医学版),2017,38(2):210-214.
[17]Voutsadakis IA.Epithelial-mesenchymal transition(EMT)and regulation of EMT factors by steroid nuclear receptors in breast cancer:a review and in silico investigation[J].J Clin Med,2016,5(1):E11.
[18]诸葛春凤,刘诗权,谭林,等.SphK1和FAK对人结肠癌HCT116细胞上皮间质转化的影响[J].中国病理生理杂志,2016,32(3):439-444.
[19]Chen CC,Sureshbabul M,Chen HW,et al.Curcumin suppresses metastasis via Sp-1,FAK inhibition,and E-Cadherin upregulation in colorectal cancer[J].Evid Based ComplementAlternat Med,2013,2013:541695.
[20]陈劲松,黄炯强,董世濠,等.微小RNA-379-5p对肝癌细胞迁移和侵袭的影响[J].中华医学杂志,2016,96(18):1450-1453.
[21]张小博,李艳会,李开良,等.VEGF、MMP-2、MMP-9在胰腺癌中的表达及临床意义[J].中国老年学杂志,2014,34(2):327-329.
