牡荆素保护DNA氧化损伤的活性评价及机制分析
2018-05-02李达欢李熙灿
陈 班 李达欢 - 李熙灿 -
(广州中医药大学中药学院,广东 广州 510006)
由活性氧 (Reactive Oxygen Species, ROS)引起的DNA氧化损伤,可以导致细胞的氧化应激,引起基因突变、癌变以及神经退行性病变[1]。羟自由基 (·OH)为ROS中最具杀伤力的自由基,既可以进攻DNA中的鸟嘌呤碱基,生成8-羟基-2′-脱氧鸟嘌呤核苷(8-hydroxy-2′-deoxyguanosine,8-OHdG),也可以进攻脱氧核糖骨架,生成丙二醛(malondialdehyde,MDA)等产物。8-OHdG与MDA,均是细胞氧化应激的毒性产物[2]。所以, 8-OHdG 已作为重要生物标识物,用于DNA氧化损伤相关疾病的筛查[3]。而脐带血中的MDA含量的检测,可用于判断早产儿的氧化应激状况与DNA损伤的水平[4]。因此,寻找合适的抗氧化剂,保护DNA免受氧化损伤,减少相关毒性产物的生成,已成为自由基生物医学研究的一项重要内容。
前期的研究[5]表明,食用植物中的抗氧化成分主要为多酚类化合物。可食用的多酚主要有黄酮及黄酮苷、类黄酮、双黄酮等,其中以黄酮及黄酮苷最常见。牡荆素(vitexin, apigenin-8-C-glucoside)是一种典型的黄酮类化合物(图1),存在于山楂等可食用植物中。据文献[6]报道,山楂叶的牡荆素含量为0.04~0.06 mg/g。含有牡荆素的山楂叶总黄酮有抗心肌缺血及再灌注损伤、降低血脂等药理活性,这些药理活性与总黄酮的抗氧化性均有直接关联[7]。
此前,一些零星报道[8-10]提及牡荆素的抗氧化作用,不过,尚未涉及牡荆素对DNA氧化损伤的修复(或保护)活性。本试验拟采用DNA保护能力分析法,研究牡荆素的DNA保护能力;运用Ferrozine法和紫外可见光谱(UV-Vis)法,分析其Fe2+络合反应;运用Cu2+还原法,测定其电子转移ET(Electron-transfer)能力。在此基础上,进一步阐释牡荆素保护DNA氧化损伤可能的化学机制,为牡荆素应用于DNA氧化损伤相关疾病的防治提供依据。

图1 牡荆素结构式Figure 1 The structure of vitexin
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
牡荆素(CAS:3681-93-4):HPLC≥98%,四川省维克奇生物科技有限公司;
Trolox(水溶性维生素E)、BHA(丁基羟基茴香醚)、Ferrozine(菲洛嗪)、Neocuproine(新铜试剂):分析纯,西格玛奥德里奇(上海)贸易有限公司;
ABTS(2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸)、鱼精DNA钠盐:分析纯,美国Amresco公司;
KH2PO4、Na2HPO4、Na2EDTA、FeCl3、CuSO4、H2O2、DMSO(二甲基亚砜)、三氯乙酸、2-硫代巴比妥酸、抗坏血酸、柠檬酸钠、乙酸铵、甲醇、乙醇:分析纯,广州化学试剂厂。
1.1.2 主要仪器设备
可见分光光度计:2100型,上海尤尼科仪器有限公司;
电子天平:BS110S型,北京赛多利斯科学仪器有限公司;
超声波清洗机:SB3200D型,宁波新芝生物科技股份有限公司;
便携式pH计:YSI pH100型,上海维赛仪器贸易有限公司;
恒温水浴锅:DZKW型,北京市永光明医疗仪器厂;
电热恒温鼓风干燥器:DHG-9070A型,上海精宏实验设备有限公司。
1.2 方法
1.2.1 DNA保护能力分析法 参考文献[11]修改如下,取适量(0,100,150,200,250,300 μL)牡荆素溶液(2 mg/mL,DMSO溶解)至离心管中,挥干溶剂,往其中加入300 μL的KH2PO4/Na2HPO4缓冲溶液(0.2 mol/L,pH=7.4)和100 μL Na2EDTA溶液(0.25 mmol/L)。随后,依次加入50 μL FeCl3溶液(1.6 mmol/L),75 μL的H2O2溶液(16.8 mmol/L)和50 μL底物DNA溶液(5 mg/mL鱼精DNA钠盐)。再加入75 μL抗坏血酸溶液(33.6 mmol/L),补加缓冲溶液,使反应液总体积达到1 050 μL,摇匀,将该离心管置于50 ℃水浴中20 min,取出,再加入250 μL三氯乙酸溶液(100 mg/mL)和150 μL 2-硫代巴比妥酸溶液(50 mg/mL),于105 ℃烘箱中加热15 min,在532 nm处测定其吸光度值A。试验以Trolox和BHA为阳性对照。按式(1)计算牡荆素对DNA的保护率R。
(1)
式中:
R——DNA保护百分率,%;
A0——未加样品的溶液吸光度;
A——加入样品后溶液的吸光度。
1.2.2 Ferrozine法 参考文献[11]修改如下:取FeCl2溶液(250 μmol/L) 0.1 mL,加适量(0,400,600,1 200,1 600,2 000 μL)牡荆素(0.01 mg/mL,DMSO 溶解)溶液,充分混合后静置3 min,再加入0.8 mL甲醇,0.15 mL Ferrozine (500 μmol/L)溶液,静置5 min后,在562 nm下测定吸光度值A。按式(2)计算牡荆素对Fe2+络合率C。
(2)
式中:
C——Fe2+络合百分率,%;
A0——未加样品的溶液吸光度;
A——加入样品后溶液的吸光度。
1.2.3 Fe2+络合产物UV-Vis光谱分析 参考文献[12]修改如下:取样品溶液(1 mg/mL,DMSO溶解)100 μL,加入100 mg/mL FeCl2溶液300 μL,再加入甲醇水(1∶1)600 μL。在反应0,5,10,20,30,40,50,60,120 min时进行UV-Vis光谱扫描。最后对反应液、样品液和FeCl2溶液进行颜色对比。
1.2.4 Cu2+还原法 参考文献[11]修改如下:取10 mmol/L CuSO4溶液和7.5 mmol/L新铜试剂各125 μL混匀,依次加入牡荆素溶液(0.5 mg/mL,DMSO溶解)xμL(x=150,200,250,300,350),0.1 mol/L乙酸铵缓冲液(700-x) μL,混合后静置30 min,在450 nm下测吸光度值A。按式(3)计算牡荆素对Cu2+相对还原率S。
(3)
式中:
S——Cu2+的相对还原百分率,%;
A0——未加样品液时所测吸光度;
Amax——一次测量内最大的吸光度;
A——加入样品液时所测吸光度。
2 结果与分析
2.1 DNA保护能力及机制
由于·OH进攻DNA的脱氧核糖部分会生成MDA等毒性物质,从而导致多种疾病的发生[13-15]。因此,抑制MDA的生成,可有效保护DNA免受氧化损伤。通过检测MDA与2-硫代巴比妥酸形成的硫代巴比妥酸反应产物(thiobarbituric acid reactive substances, TBARS)复合物的含量,可以检测MDA的存在。TBARS在532 nm处有最大吸收。如果A532 nm值降低,则表明MDA的生成得到了有效抑制,DNA在一定程度上受到保护。因此,该模型可用来评估DNA氧化损伤的程度。如图2(a)所示,在0~0.6 mg/mL的浓度范围内,牡荆素的DNA保护能力与其浓度呈现出良好的量效关系。从表1可以看出,其DNA保护能力约为Trolox的2.50倍。这表明,牡荆素能保护DNA免受·OH诱导的氧化损伤。

表1 各个检测指标下样品和阳性对照的IC50值†Table 1 The IC50 values of vitexin and the positive controls
†IC50指被测量的拮抗剂的半抑制浓度;同行不同上标字母表示数据有显著差异(P<0.05);比值指相应指标下水溶性维生素E或柠檬酸钠的IC50与牡荆素的IC50之比;N.D.指不需测。

图2 牡荆素抗氧化作用的量效关系图Figure 2 The dose response curves of vitexin in various antioxidant assays
2.2 Fe2+络合活性及机制
据文献[16]报道,在H2O2对酒石酸的氧化过程中,Fe2+可以极大提高反应速率,后通过顺磁共振试验(ESR)证实,在此反应体系中,·OH是实际的氧化中间体。在没有金属离子存在时,DNA能对抗浓度约10 mmol/L的H2O2[17],但只要有皮克级的Fe2+参与反应,就能够使H2O2转化成·OH,从而引起DNA 的氧化损伤[18]。在细胞中,这种催化作用通过Fenton反应(Fe2++H2O2→Fe3++·OH+·OH-)实现[12,19-22]。因此,络合Fe2+可以有效地减少·OH 的生成,从而保护DNA免受·OH诱导的氧化损伤,使细胞能健康成长甚至分化[23]。
从图2(b)中可以看出,在0~7 μg/mL的浓度范围内,牡荆素对Fe2+的络合能力与其浓度呈现剂量相关性。据表1可知,牡荆素、柠檬酸钠的铁络合能力的IC50值分别为(9.3±1.2),(9.6±2.8) μmol/L,二者没有显著的统计学差异,表明两者的铁络合能力相似。从图3(a)可知,络合产物在200~400 nm 的波长范围内,其紫外吸收强度有一定程度的增加。从图3(b)可以看出,牡荆素在与Fe2+混合的60 min 与120 min 的吸收强度很接近(线条⑧和⑨),说明该反应在60 min时已基本达到平衡。而在二者混合的瞬间(0 min),即在554 nm处生成新的吸收峰(线条①),其强度已超过120 min时(线条⑨)吸收强度的50%,说明牡荆素的Fe2+络合反应是一个快速反应。此时,牡荆素样品溶液由淡黄色变成了黄绿色,其554 nm处摩尔吸光系数ε=2 680.74 L/(mol·cm)。总之,牡荆素对Fe2+有一定的络合作用,该络合作用可能是牡荆素保护DNA免受氧化损伤的机制之一。
牡荆素络合Fe2+的能力,与其分子结构的特点有关。牡荆素分子的4-羰基和5-羟基为共平面构型,Fe2+易在此处构成一个平面的环状结构。因此,牡荆素可能在4-羰基-5-羟基之间存在一个Fe2+络合位点,其络合反应式见图4。由图4 可知,Fe2+在4-羰基-5-羟基之间形成了一个六元环,由于六元环的角张力最小,所以,其Fe2+络合的片段结构是稳定的,与此前的一些报道[18,19,22,24]相吻合。综上,牡荆素的Fe2+络合能力得益于其环状的结构。对于一些链状的脂肪酸(如十六酸)而言,则不可能与Fe2+络合[25-26];而对于一些环状的倍半萜内酯(如白术内酯[27])而言,由于没有环外的羰基或羟基,同样不能表现出Fe2+络合活性。这反过来印证了:牡荆素络合Fe2+的能力,与分子的环状结构(特别是平面构型的4-羰基-5-羟基)相关。

①~⑨ 分别为0.1 mg/mL牡荆素与30 mg/mL Fe2+络合0,5,10,20,30,40,50,60,120 min后的扫描结果; ⑩ 为0.1 mg/mL牡荆素溶液扫描结果;为30 mg/mL FeCl2溶液扫描结果
图3 牡荆素与Fe2+络合产物的UV光谱图及Vis光谱图
Figure 3 The UV-spectra and Vis-spectra of vitexin
binding to Fe2+complexing
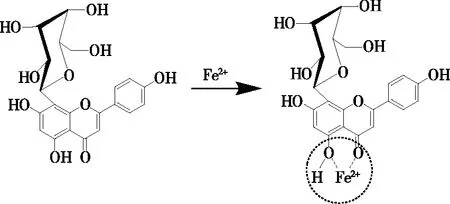
图4 牡荆素络合Fe2+的可能反应Figure 4 The possible reaction of vitexin complexing with Fe2+
2.3 Cu2+还原活性及机制
由图2(c)可知,在0.00~0.16 mg/mL的浓度范围内,牡荆素对Cu2+的还原能力与其浓度呈现出良好的剂量相关性。这表明牡荆素具有一定的Cu2+还原能力。而Cu2+还原本质是一个电子转移的过程[16-18],因此,在牡荆素保护DNA免受·OH诱导的氧化损伤的过程中,可能涉及到电子转移。
3 结论
牡荆素具有良好的保护DNA免受·OH诱导的氧化损伤的能力。其保护机制可能与电子转移及Fe2+络合有关。其Fe2+络合反应的位点,可能在4-羰基-5-羟基之间。这些抗氧化化学机制的阐释,将推动牡荆素在DNA氧化损伤相关的疾病方面发挥作用。
[1] CADET J, WAGNER J R. DNA base damage by reactive oxygen species, oxidizing agents, and UV radiation[J]. Cold Spring Harbor Perspectives in Biology, 2013, 5(2): a12 559.
[2] KULMS D, ZEISE E, PÖPPELMANN B, et al. DNA damage, death receptor activation and reactive oxygen species contribute to ultraviolet radiation-induced apoptosis in an essential and independent way[J]. Oncogene, 2002, 21(38): 5 844.
[3] KARKI K, PANDE D, NEGI R, et al. An Assessment of oxidative damage and non-enzymatic antioxidants status alteration in relation to disease progression in breast diseases[J]. Med Sci (Basel), 2016, 4(4): 17.
[4] NORISHADKAM M, ANDISHMAND S, ZAVAR REZA J, et al. Oxidative stress and DNA damage in the cord blood of preterm infants[J]. Mutat Res, 2017, 824: 20-24.
[5] LI Xi-can, CHEN Dong-feng, MAI Ying, et al. Concordance between antioxidant activities in vitro and chemical components of Radix Astragali (Huangqi)[J]. Natural Product Research, 2012, 26(11): 1 050-1 053.
[6] 王鑫波, 高敏, 童丽姣, 等. 山楂叶提取物中牡荆素鼠李糖苷的含量测定[J]. 中华中医药学刊, 2010, 28(10): 2 098-2 100.
[7] JURIKOVA T, SOCHOR J, ROP O, et al. Polyphenolic profile and biological activity of Chinese hawthorn (Crataegus pinnatifida BUNGE) fruits[J]. Molecules, 2012, 17(12): 14 490-14 509.
[8] KANG Jie, LI Zhi-min, WU Tong, et al. Anti-oxidant capacities of flavonoid compounds isolated from acai pulp (Euterpe oleracea Mart)[J]. Food Chemistry, 2010, 122(3): 610-617.
[9] ZHANG Xue, XU Dao-hua. Research progress of pharmacolog-ical action of vitexin[J]. China Medical Herald, 2013, 35: 41-44.
[10] NI Qin-xue, LIU Ying-kun, GONG Ling-xiao, et al. Active components in six kinds of ground bamboo leaves and their anti-oxidant activities[J]. Chinese Traditional & Herbal Drugs, 2011, 42(11): 2 317-2 321.
[11] LI Xi-can, MAI Wen-qiong, LI Wang, et al. A hydroxyl-scavenging assay based on DNA damageinvitro[J]. Analytical Biochemistry, 2013, 438(1): 29-31.
[12] JIANG Qian, LI Xi-can, TIAN Ya-ge, et al. Lyophilized aqueous extracts of Mori Fructus and Mori Ramulus protect mesenchymal stem cells from ·OH-treated damage: bioassay and antioxidant mechanism[J]. Bmc Complementary & Alternative Medicine, 2017, 17(1): 242-252.
[13] LI Xi-can, HU Qiu-ping, JIANG Shu-xia, et al. Flos Chrysanthemi Indici protects against hydroxyl-induced damages to DNA and MSCs via antioxidant mechanism[J]. Journal of Saudi Chemical Society, 2015, 19(4): 454-460.
[14] KIWI J, LOPEZ A, NADTOCHENKO V. Mechanism and kinetics of the ·OH-radical intervention during Fenton oxidation in the presence of a significant amount of radical Scavenger (Cl-)[J]. Environmental Science & Technology, 2000, 34(11): 2 162-2 168.
[15] PERRON N R, BRUMAGHIM J L. A review of the antioxid-ant mechanisms of polyphenol compounds related to iron binding[J]. Cell Biochemistry & Biophysics, 2009, 53(2): 75-100.
[16] LIN Jing, LI Xi-can, LI Chen, et al. Protective effect against hydroxyl radical-induced DNA damage and antioxidant mechanism of [6]-gingerol: A Chemical Study[J]. Bulletin of the Korean Chemical Society, 2014, 35(6): 1 633-1 638.
[17] LI Xi-can, LIU Jing-jing, LIN Jing, et al. Protective effects of dihydromyricetin against ·OH-induced mesenchymal stem cells damage and mechanistic chemistry[J]. Molecules, 2016, 21(5): 604-616.
[18] LI Xi-can, MAI Wen-qiong, CHEN Dong-feng. Chemical study on protective effect against hydroxyl-induced DNA damage and antioxidant mechanism of myricitrin[J]. Journal of the Chinese Chemical Society, 2014, 61: 383-391.
[19] LI Xi-can, JIANG Qian, WANG Ting-ting, et al. Comparison of the antioxidant effects of quercitrin and isoquercitrin: understanding the role of the 6″-OH group [J]. Molecules, 2016, 21(9): 1 246-1 256.
[20] MARINOV N M. A detailed chemical kinetic model for high temperature ethanol oxidation[J]. International Journal of Chemical Kinetics, 2015, 31(3): 183-220.
[21] XIE Yu-lu, LI Xi-can, XU Jie-ying, et al. Two phenolic antioxidants in Suoyang, enhance viability of ·OH-damaged mesenchymal stem cells: comparison and mechanistic chemistry [J]. Chemistry Central Journal, 2017, 11(1): 84-94.
[22] WANG Ting-ting, ZENG He-ping, LI Xi-can, et al. In vitro studies on the antioxidant and protective effect of 2-substituted-8-hydroxyquinoline derivatives against H2O2-Induced oxidative stress in BMSCs[J]. Chemical Biological Drug Design, 2010, 75(2): 214-222.
[23] LI Xi-can, LU Han, LI Yun-rong, et al. Protective effect of sinapine against hydroxyl radical-induced damage to mesenchymal stem cells and possible mechanisms[J]. Chem. Pharm. Bull. 64, 319-325,
[24] WANG Guang-rong, LI Xi-can, ZENG He-ping. Synthesis, antioxidation activity of (E)-9-p-Tolyl-3-[2-(8-hydroxy-quinol-2-yl)vinyl]-carbazole and (E)-9-(p-Anisyl)-3-[2-(8-hydroxy-quinol-2-yl)vinyl]-carbazole and their induction proliferation of mesenchymal stem cells[J]. Act Chimica Sinica, 2009, 67(9): 974-982.
[25] CHEN Dong-feng, LI Xi-can, XU Zhi-wei, et al. Hexadecanoic acid from Buzhong Yiqi decoction induced proliferation of bone marrow mesenchymal stem cells [J]. Journal of Medicinal Food, 2010, 13(4): 967-970.
[26] LI Xi-can, HAN Wei-juan, MAI Wen-qiong, et al. Antioxidant activity and mechanism of tetrahydroamentoflavone in vitro[J]. Natural Product Communications, 2013, 8(6): 787-789.
[27] LI Xi-can, WEI Gang, WANG Xiao-zhen, et al. Targeting of the Shh pathway by atractylenolides promotes chondrogenic differentiation of mesenchymal stem cells[J]. Biological & Pharmaceutical Bulletin, 2012, 35(8): 1 328-1 335.
