不同萃取剂测定茶叶中氯噻啉残留量的方法比对
2018-05-02郭明义军ANG李丽君曹小彦
李 青 郭明义 - 梁 军ANG 袁 晓 李丽君 - 曹小彦 -
(1. 广电计量检测﹝湖南﹞有限公司,湖南 长沙 410205;2. 长春市食品药品监测中心,吉林 长春 130033)
氯噻啉(imidaclothiz)是中国农药技术公司自行研制开发的一种硝基亚甲基烟碱类杀虫剂[1],在柑橘蚜虫、十字花科蔬菜蚜虫、水稻飞虱、温室白粉虱、茶树叶蝉等病虫防治方面有着很好的效果。目前新烟碱类杀虫剂对蜜蜂形成急性毒害,可能会对蜜蜂种群的生存和发展带来不可接受的影响[2],欧盟已经开始对部分新烟碱类杀虫剂进行限制使用。目前对氯噻啉残留量测定的方法有高效液相色谱法[3-6],高效液相色谱-串联质谱法[7-8]、气相色谱-串联质谱法[9],其研究过程的前处理大部分需要经过固相萃取柱进行净化,有关提取试剂的研究都只比较了几种常规的单一提取试剂[10-12]。近年来QuEChERS[13-14]方法在农药中应用比较广泛,但是其成本也相对较高。本研究拟对茶叶中氯噻啉测定的前处理进行优化,分别采用正己烷、乙腈、丙酮3种纯试剂,以及正己烷-乙腈(体积比1∶1)、乙腈-丙酮(体积比1∶1)、正己烷-乙酸乙酯(体积比1∶1)3种混合试剂,作为萃取溶剂对茶叶中氯噻啉进行萃取,通过对萃取时间、萃取体积及萃取回收率几个方面进行分析,选择一种提取效率高、杂质干扰少的提取试剂。
1 材料与方法
1.1 仪器
超高效液相色谱仪:L-30A型,日本岛津公司;
氮吹仪:UGC-24C系列,北京优晟联合科技有限公司;
超声仪:KQ-300DB系列,昆山市超声仪器有限公司;
电子天平:BT125D系列,德国赛多利斯公司;
离心机:LD4-2D系列,北京京立离心机有限公司;
涡旋混合仪:Vortex Genie 2系列,上海芃奇科学仪器有限公司;
超纯水仪:Ultra-pure Wster Sytem系列,湖南科尔顿水务有限公司。
1.2 试验材料
甲醇、乙腈:色谱纯,德国默克公司;
正己烷、乙酸乙酯:色谱纯,上海安谱实验科技股份有限公司;
丙酮:色谱纯,上海阿拉丁生化科技股份有限公司;
磷酸:分析纯,国药集团化学试剂有限公司;
实验室用水:18.25 MΩ超纯水,超纯水仪制备。
1.3 标准品与配制
氯噻啉标准物质:纯度≥95.0%,上海安谱实验科技股份有限公司;
标准溶液的配制:取10.0 mg标准物质于10 mL容量瓶,加乙腈溶解并定容至刻度,配制成浓度为1.0 mg/mL的标准储备液。吸取不同体积的标准储备液用乙腈稀释成浓度为0.05,0.10,0.20,0.50,0.80 μg/mL的标准使用液。
1.4 色谱条件
色谱柱:Agilent C18(5 mm×25 mm×0.45 μm);流动相:甲醇+乙腈+0.1%磷酸溶液=10∶25∶65(体积比);检测波长:270 nm;柱温:35 ℃;进样体积:10 μL。
1.5 样品处理
准确称取1.00 g样品,加入20 mL正己烷-乙酸乙酯(体积比1∶1)混合溶剂,涡旋混合1 min,超声提取20 min,4 000 r/min 离心5 min,准确移取10 mL上清液于比色管,在40 ℃水浴条件下氮吹干,用乙腈溶解残留物并定容至1 mL,过0.22 μm滤膜,滤液供高效液相色谱测定。
2 结果与分析
2.1 色谱条件的优化
2.1.1 流动相选择 分别对比甲醇+水(体积比25∶75)、乙腈+水(体积比35∶65)、甲醇+乙腈+0.1%磷酸水溶液(体积比10∶25∶65)3种流动相组合的峰型和杂质分离效果,结果表明,在以甲醇+乙腈+0.1%磷酸水溶液(体积比10∶25∶65)作为流动相时,氯噻啉的峰型最好,在样品测定时其杂质的分离效果较佳,最终选择其作为氯噻啉测定的流动相,氯噻啉标准物质色谱图见图1。
2.1.2 检测波长的选择 通过对DAD二极管阵列检测器所得氯噻啉标准溶液的光谱进行分析,其在270 nm处具有最大吸收波长,杂质峰的干扰较少,比对270 nm附近多个波长下氯噻啉标准溶液峰面积(见表1),结果表明,在270 nm波长下,氯噻啉标准溶液的峰面积最高,氯噻啉标准物质光谱图见图2。

图1 氯噻啉色谱图Figure 1 The chronatogram of imidaclothiz
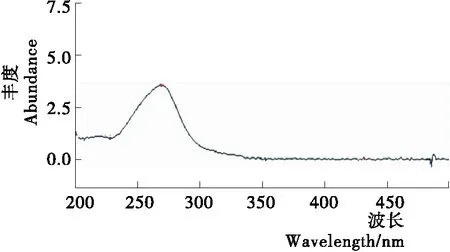
图2 氯噻啉标准物质光谱图Figure 2 The spectrogram of imidaclothiz表1 氯噻啉标准溶液各波长峰面积响应值Table 1 Response value of peak area of each wavelength of imidaclothiz standard solution

波长/nm265266267268269270271272273274275峰面积4556847786490464962049869499884988749705497824926648304
2.2 萃取时间的影响
称取等质量的茶叶样品多份,加入相同质量浓度的标准溶液,用等体积的萃取剂分别超声5,10,15,20,25,30 min,测定的回收率数据见图3。试验结果表明,当超声时间超过15 min后,萃取效果会显著提高,但超声时间越长提取出来的杂质越多,溶液颜色变化也非常明显,综合考虑萃取效果和杂质干扰问题,最终选择超声20 min为最佳萃取时间。
2.3 萃取体积的影响
称取多份茶叶空白样品,分别加入1 mg/kg的氯噻啉标准溶液,各萃取剂分别移取5,10,15,20,25,30 mL的溶液进行提取,其回收率见表2。由表2可知,随着萃取剂体积的增加,回收率增加较快,当萃取体积为20 mL时,各萃取剂回收率最大,当萃取体积超过20 mL后,萃取回收率变化不大且有降低的趋势。因此,选择20 mL作为萃取剂的萃取体积。
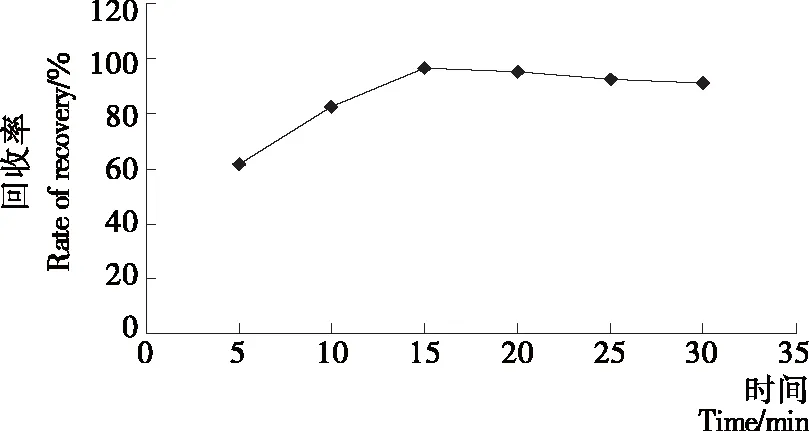
图3 不同萃取时间回收率数据Figure 3 Different extraction time recovery rate data
2.4 样品的测定
选取绿茶作为试验样品,按照2.3和2.4的条件进行前处理提取后对样品空白和样品加标测定。从图4可以看出,各萃取剂萃取效果和杂质干扰差异较大,其中正己烷-乙酸乙酯(体积比1∶1)萃取剂萃取出的杂质最少,目标物的萃取效果最为理想。
2.5 回收率和精密度
称取一定质量的茶叶样品,样品中加入不同浓度的标准溶液,配制成0.5,1.0,1.5,2.0,3.0,5.0,10.0 mg/kg不同浓度加标样品,每个质量浓度的样品称取3份,分别用正己烷、乙腈、丙酮、正己烷-乙腈(体积比1∶1)、乙腈-丙酮(体积比1∶1)、正己烷-乙酸乙酯(体积比1∶1)进行提取,按2.1的方法测定,计算各质量浓度加标样品的回收率,见表3。由表3可知,各萃取剂不同浓度3份样品的回收率相对标准偏差均低于10%;各萃取剂的回收率都在80%~110%,其中正己烷-乙酸乙酯的平均回收率最高。

图4 样品加标色谱图Figure 4 Standard chromatogram of sample表2 各萃取剂不同萃取体积回收率数据Table 2 Recovery rate data of different extraction volume of each extractant

萃取剂/mL回收率/%正己烷乙腈丙酮正己烷-乙腈(体积比1︰1)乙腈-丙酮(体积比1︰1)正己烷-乙酸乙酯(体积比1︰1)543.542.146.744.941.843.61055.651.654.858.253.654.91578.681.382.380.379.277.32092.893.591.892.392.893.62591.290.389.190.590.190.73088.388.187.288.186.787.4
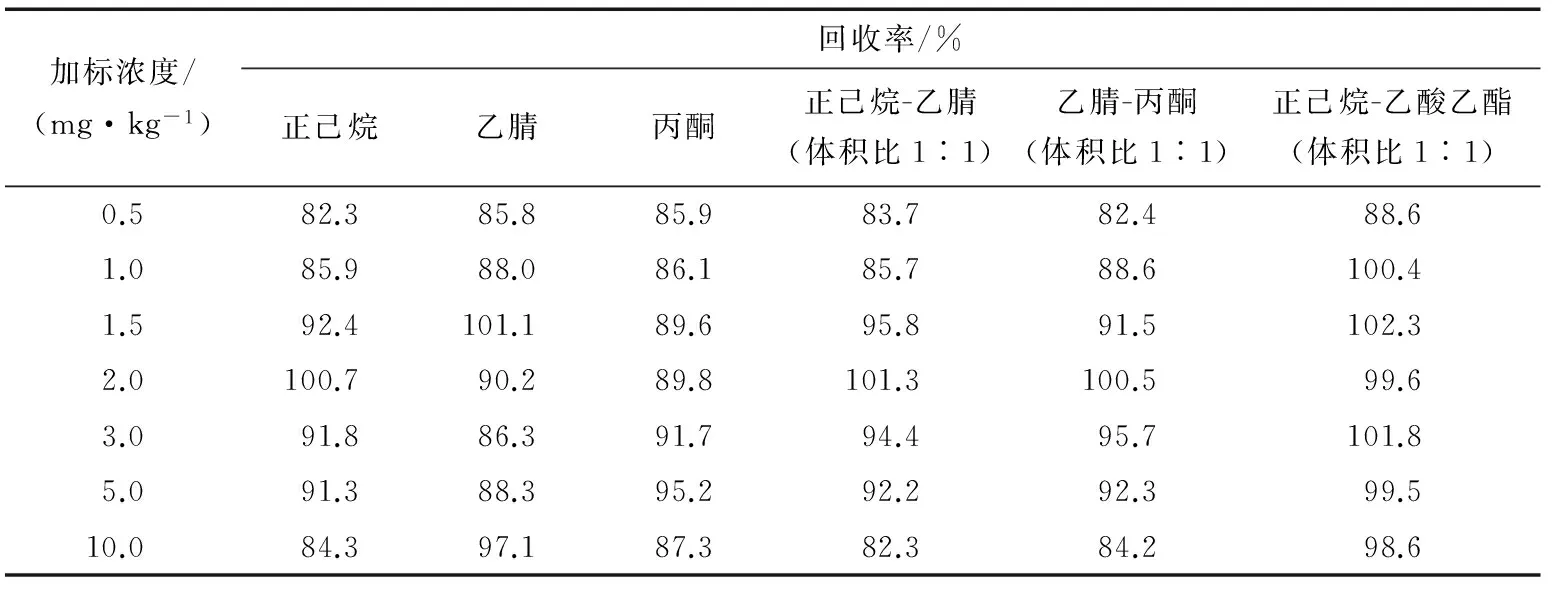
表3 各萃取剂不同加标浓度回收率数据Table 3 Different spiked concentration of extractant recovery data
3 结论
本试验对比了正己烷、乙腈、丙酮、正己烷-乙腈(体积比1∶1)、乙腈-丙酮(体积比1∶1)、正己烷-乙酸乙酯(体积比1∶1)6种萃取剂对茶叶中氯噻啉的萃取能力。以270 nm 为波长,甲醇+乙腈+0.1%磷酸溶液为流动相对氯噻啉进行测定,通过对萃取时间、萃取体积进行比对后选择20 mL萃取剂体积、超声萃取20 min对茶叶中氯噻啉进行提取试验,结果表明,6种萃取剂对氯噻啉都有较好的响应,并且杂质干扰较少,样品加标平均回收率分别为82.3%~100.7%,85.8%~101.1%,85.9%~95.2%,82.3%~101.3%,82.4%~100.5%,88.6%~102.3%。因此,6种萃取剂对氯噻啉都有较好的萃取能力,组合试剂萃取能力较优,其中正己烷-乙酸乙酯(体积比1∶1)萃取能力最强,稳定性较好。
[1] 万有葵, 文保元, 王庆林. 农药毒性博览[M]. 济南: 山东科学技术出版社, 1986: 3-4.
[2] 段丽芳, 李贤宾, 柯昌杰, 等. 欧盟新烟碱类农药限用政策对我国农药相关产业的风险分析[J]. 农药科学与管理, 2013, 34(9): 15-20.
[3] 侯如燕, 卞红正, 赵秀霞, 等. 固相萃取-液相色谱测定复杂基质蔬菜中9种烟碱类残留[J]. 分析测试学报, 2011, 30(1): 58-63.
[4] 王志敏, 雷雨, 陆雪芳. 氯噻啉的高效液相色谱分析[J]. 南通大学学报: 自然科学版, 2005, 4(2): 23-24.
[5] 张丽芬. 氯噻啉在甘蓝中残留分析方法的研究[J]. 河北北方学院学报: 自然科学版, 2004(2): 60-63.
[6] 贺敏, 贾春虹, 余平中, 等. 水稻中氯噻啉的高效液相色谱残留分析方法[J]. 农药, 2009, 48(4): 285-286.
[7] 刘松南, 赵新颖, 董晓倩, 等. QuEChERS净化-液相色谱-串联质谱法测定茶叶中氯噻啉[J]. 色谱, 2015, 33(11): 1 205-1 209.
[8] 陆小磊, 叶美君, 周卫龙. 超高效液相色谱-串联质谱法测定茶叶中氯噻啉的残留量[J]. 农药, 2014(11): 825-828.
[9] 高智席, 吴艳红, 敖克厚, 等. 水果中甲霜灵和氯噻啉的固相萃取-反相高效液相色谱测定法[J]. 环境与健康杂志, 2012, 29(3): 258-259.
[10] 仲伶俐, 胡莉, 雷绍荣, 等. 超高效液相色谱-串联质谱法测定茶叶中6种农药残留[J]. 食品安全质量检测学报, 2016, 7(5): 2 081-2 086.
[11] 吴晓刚, 陈孝权, 肖海军, 等. 超高效液相色谱-电喷雾串联质谱法检测茶叶中8种杀虫剂残留[J]. 农药学学报, 2013, 15(6): 655-660.
[12] 楼正云, 汤富彬, 陈宗懋, 等. 高效液相色谱法检测茶叶中噻虫嗪残留量[J]. 分析试验室, 2009, 28(b05): 76-78.
[13] 孙志高, 盛冉, 郝静梅, 等. QuEChERS—高效液相色谱法检测柑桔中毒死蜱、吡虫啉和残杀威农残[J]. 食品与机械, 2017, 33(6): 68-72.
[14] 曹慧, 郑军科, 黄丽英, 等. QuEChERS—UPLC/MS/MS快速测定茶叶中的草甘膦和氨甲基磷酸[J]. 食品与机械, 2016, 32(4): 84-87.
