超高效液相色谱-串联质谱法测定6-巯基嘌呤血浆药物浓度方法的建立与评价*
2018-05-02邹远高白杨娟唐江涛王兰兰
苗 强,邹远高, 白杨娟,唐江涛,刘 婕,王兰兰
四川大学华西医院 实验医学科(成都 610041)
6-巯基嘌呤(6-MP)及其前体药物硫唑嘌呤(AZA)属于抗代谢药物,该类药物治疗窗窄,不良反应严重[1-3],临床应用时常需实行治疗药物浓度监测(therapeutic drug monitoring ,TDM)[4-6]。目前,已报道[7-9]的测定血浆中6-MP的方法,包括高效液相色谱法(HPLC)、反相高效液相色谱法(RP-HPLC)以及高效液相色谱-串联质谱联用法(LC-MS/MS)等。其中,HPLC和RP-HPLC法虽然成本低,但是有测定时间长、灵敏度不高的缺点,不适用于临床检测以及血浆中低浓度6-MP的测定。LC-MS/MS法采用二级质谱定量,具有更好的专一性、准确性,可用于人血浆中6-MP的低浓度测定,适用于临床常规进行治疗药物监测。本研究通过建立简单、快速、准确的超高效液相色谱-串联质谱法(ultra performance liquid chromatography tandem mass spectrometry, UPLC-MS/MS)检测血浆6-MP浓度, 为进一步考察其相应代谢酶活性以及临床及时掌握病情、评价疗效和制定个体化给药方案提供依据。
1 材料与方法
1.1 仪器设备
Waters公司超高效液相色谱(I-Class)-质谱(TQ-S)联用仪(美国Waters公司);赛多利斯BT125D电子分析天平[赛多利斯科学仪器(北京)有限公司];IKA MS3旋涡混匀器(德国IKA公司);Eppendorf高速冷冻型离心机(德国Eppendorf公司);Milli-Q 超纯水机(Millipore中国有限公司)。
1.2 药品试剂
6-MP标准品及内标6-硫鸟嘌呤(6-TG) (色谱纯,Sigma-Aldrich公司),乙腈、甲酸(色谱纯,美国赛默飞世尔公司),醋酸铵(分析纯,Sigma-Aldrich公司),甲醇、氨水(色谱纯,中国成都科龙有限公司)。
1.3 方法
1.3.1 色谱条件 色谱柱:Waters ACQUITY BEH HILIC(2.1 mm×50 mm,1.7 μm),流动相为pH 3.0, 0.02 mol/L醋酸铵缓冲液(含0.3%HCOOH)-乙腈(20∶80),流速0.4 mL/min,进样量4 μL,柱温40 ℃,总运行时间1 min。以6-TG为内标。
1.3.2 质谱条件 采用电喷雾电离源(ESI)技术,正离子扫描下的多离子反应监测(MRM)作为检测模式。毛细管电压2.0 kV,检测离子6-MP m/z 153.03→119.1,碰撞能19 eV,锥电压12 V;内标6-TG m/z 168.06→134.13,碰撞能和锥电压分别为17 eV和10 V。去溶剂气体温度为400 ℃,去溶剂气体流速800 L/h,锥气体流速为150 L/h。
1.3.3 溶液配制 精密称取6-MP标准品,用甲醇溶解,配制1 mg/mL的6-MP储备液,置-20 ℃冰箱保存,备用。取6-MP储备液1 mL,用甲醇∶水(1∶1, v/v)稀释制成10 μg/mL的6-MP工作液,置于2~8 ℃保存。精密称取内标6-TG标准品,用甲醇溶解并加入氨水,配制1 mg/mL的内标储备液,置-20 ℃冰箱保存,备用。取内标储备液1 mL,用甲醇∶水(1∶1, v/v)稀释制成1 μg/mL的内标工作液,置于2~8 ℃保存。
1.3.4 血浆样品预处理 肝素抗凝全血,离心速度2 500 r/min,离心半径18 cm,离心5 min,取血浆样品200 μL加入40 μL内标(1 μg/mL),再加入500 μL乙腈沉淀蛋白,旋涡混匀1 min,离心速度12 000 r/min,离心半径9.5 cm,离心5 min,移取上清液至上样瓶,进样4 μL。
2 结果
2.1 基质效应
取空白血浆200 μL,按“1.3.4”方法处理后,加入相应浓度的6-MP标准溶液和内标溶液各适量,配制成5个不同浓度梯度的质控样本,将其进样分析,得相应峰面积A;取相应浓度的6-MP标准溶液和内标溶液直接混合,按照同样的方法处理,以纯水补足体积差,然后进样分析得相应峰面积B,基质效应=A/B×100%。结果显示,5个不同浓度梯度的质控样本基质效应分别为(119.74±6.33)%、(95.69±4.09)%、(95.51±7.76)%、(92.57±7.80)%、(102.34±6.37)%,RSD<10%,表明该方法不受基质效应的影响。
2.2 标准曲线的制备与最低检测限
取空白血浆、10 μg/mL的6-MP工作液适量,配制浓度为2 000、1 000、500、250、125、62.5、31.25、15.6、7.8、3.9、2.0、1.0、0.5、0.25、0.125、0.062 5、0.031 25、0.015 6 ng/mL的血浆样品,按“1.3.4”方法处理后,进样测定,记录色谱图。以样品峰面积与内标峰面积的比值(Y)为纵坐标、待测物6-MP的质量浓度为横坐标,用加权最小二乘法(权重系数1/X)进行线性回归,得回归方程为Y=0.010 525X+0.001 047 7,r=0.998 8。根据色谱图和回归方程分析结果,6-MP血浆药物浓度在0.5~2 000 ng/mL范围内线性关系良好,其最低检测限为0.125 ng/mL。
2.3 专属性考察
在“1.3.1和1.3.2”项条件下,取20个体检样本血浆,不加入内标及标准品,同时取空白血浆+6-MP+内标,按“1.3.4”方法处理后,进样分析考察方法的专属性。结果表明,6-MP和内标的色谱峰峰形良好,其保留时间分别为0.58 min和0.53 min,而20个体检样本血浆中未发现有内源性物质干扰待测物和内标的测定,表明该方法专属性良好(图1)。
2.4 精密度与回收率试验
取空白血浆、相应浓度的6-MP标准溶液各适量,配制浓度为1 000、125、15.6、2.0、0.5 ng/mL的质控样品,取每个浓度样本各20份,按照“1.3.4”方法处理后,进样分析,考察方法的日内精密度。另取每个浓度样本5份进行分析,连续测定5 d,根据当日标准曲线计算各样品的测定浓度,考察方法的日间精密度。以测定的浓度与加入的浓度比值来考察样品的方法回收率,已经提取所得血浆样品的色谱峰面积与未经提取所得的色谱峰面积的比值来考察样品的提取回收率。结果显示,日内、日间的RSD均<6%,各样品的方法回收率89%~104%(RSD<6%),提取回收率>95%(RSD<8%)。精密度与回收率的试验结果如下(表1)。

表1 精密度与回收率试验结果
2.5 稳定性试验
取空白血浆、相应浓度的6-MP标准溶液各适量,配制浓度为1 000、125、15.6、2.0、0.5 ng/mL的质控样品,分别考察其在室温放置6 h、经历反复冻融(-20 ℃)(室温)3次、-20 ℃冷冻保存15 d、自动进样器内(16 ℃)放置72 h等条件下的稳定性,每个浓度取5份样品进行分析。结果显示,血浆样品在上述条件下稳定性良好,RSD<10%(表2)。
表2 稳定性试验结果
2.6 临床样本测定
纳入12例长期服用AZA维持治疗的炎症性肠病患者,分别测定其血浆6-MP的浓度。由表可知,服用相同剂量的AZA,其血药浓度存在明显个体差异。其中,1例患者由于服药后2 h内采集血样本,测定结果为峰浓度值60.42 ng/mL(表3)。
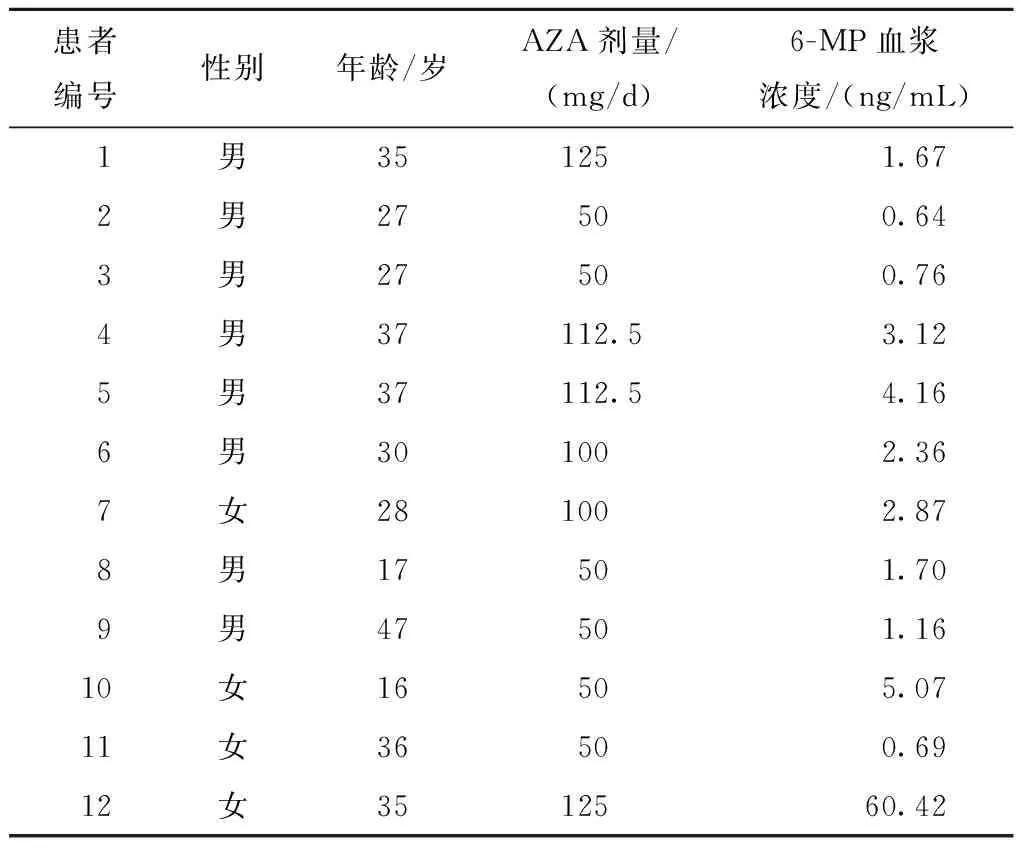
表3 服用AZA患者血浆中6-MP浓度
3 讨论
巯嘌呤类药物包括AZA、6-MP及6-TG,从20世纪80年代开始,巯嘌呤类免疫抑制剂被广泛应用于炎症性肠病和自身免疫性肝炎患者维持缓解的治疗中[10-11],并被证实具有良好疗效。但由于基因多态性等多种因素原因,巯嘌呤类药物的疗效和安全性个体差异较大,不同患者对相同剂量的AZA应答率不同,且对同等剂量AZA的药物耐受性、副作用发生率也具有明显差异,有必要进行药物浓度监测,对AZA进行合理的剂量调整。6-MP血浆药物浓度测定方法,文献[8, 12-13]报道较多的是HPLC法,该法易受患者联合用药的干扰,检测的线性范围较窄,为20~2 000 ng/mL,分析时间需要7 min以上,灵敏度低,最低检测限仅能达到20 ng/mL。本试验建立的UPLC-MS/MS法,通过质谱多级反应监测来提升灵敏度,将线性范围扩展到0.5~2 000 ng/mL ,最低检测限可达0.125 ng/mL。通过UPLC提高柱效将样本的分析时间由原来的>7 min缩短至1 min,大大提高了检测效率,同时串联质谱又较一级质谱更能精确的检测待测物,足够满足临床合并用药TDM监测的需求。
3.1 血浆生物样品处理方法
血浆样本的处理方法会明显影响测定结果,本研究考察了液-液萃取和沉淀蛋白两类方法,在不同pH值条件下采用二氯甲烷进行萃取,结果发现样品及内标回收率低。采用甲醇、乙腈作为蛋白沉淀剂去除蛋白,通过综合比较色谱峰形、保留时间以及提取回收率,本研究选择采用乙腈作为蛋白沉淀剂。考虑到沉淀法对血样处理不彻底,直接进样会污染质谱仪,因此本研究考察了沉淀蛋白后直接进样分析与挥干浓缩复溶后进样分析,发现由于6-MP及内标溶解性的原因,采用纯水、甲醇水、流动相以及弱碱性纯水复溶提取回收率均低,反而沉淀蛋白后直接进样分析的回收率相对较高,方法学评价中提取回收率>95%(RSD<8%)。因此,本实验样品预处理方法最终选择采用乙腈沉淀蛋白后直接进样分析。
3.2 色谱条件的优化
在本实验中考察了Waters ACQUITY BEH C18 (2.1 mm×50 mm, 1.7 μm)和Waters ACQUITY HSS T3(2.1 mm×50 mm, 1.8 μm)色谱柱的分离效果和峰形,结果无论是否加预柱峰形均有分叉与拖尾现象,考虑到6-MP和内标的溶解性属于极性物质,尝试采用Waters ACQUITY BEH HILIC(2.1 mm×50 mm, 1.7 μm)色谱柱,将标准品进样分析,结果分离效果良好,峰形对称。本研究在流动相的选择中对比了甲醇-水-甲酸和乙腈-水-甲酸两种不同的系统,发现采用甲醇-水-甲酸时,有色谱峰太宽和拖尾现象,乙腈-水-甲酸作为流动相,峰形对称,且峰宽较窄,进一步对不同比例流动相的峰形、保留时间等综合分析,最终选择流动相比例为20∶80[pH3.0, 0.02 mol/L醋酸铵缓冲液(含0.3%HCOOH)-乙腈],此时分离度良好,且保留时间适中。因此,本研究最终确定色谱条件:Waters ACQUITY BEH HILIC(2.1 mm×50 mm, 1.7 μm)色谱柱,流动相为pH3.0, 0.02 mol/L醋酸铵缓冲液(含0.3%HCOOH)-乙腈(20∶80),流速0.4 mL/min。
3.3 稳定性分析
由于6-MP见光易分解,在整个提取过程中尽量避光操作,样品贮存和上样分析均采用棕色瓶。为了考察操作过程中的影响,进行了室温放置6 h的稳定性试验,结果不同浓度的样品室温放置6 h后进样分析RSD均<5%,且相对误差(RE)均<8%。进一步进行了样本检测过程中稳定性考察,即提取样品在自动进样器内放置72 h稳定性试验,结果其RSD与RE均<8%。在长期稳定性方面,6-MP血浆样本可在-20 ℃稳定保存15 d。因此,本研究中生物样品在各种贮存条件下足够稳定,能够满足临床及科研中药物浓度监测的要求。
本研究建立的UPLC-MS/MS检测血浆中6-MP浓度的方法操作简单、快速、灵敏度高、稳定性强,能为临床提供可靠的测定结果,适用于血浆6-MP药物浓度检测。在实际应用中测定了12例长期服用AZA的炎症性肠病患者血浆6-MP浓度,结果6-MP的血浆浓度存在明显个体差异,结合AZA药物代谢动力学特点,其达峰时间约为1.5 h,故测定6-MP血浆浓度时应严格控制采血时间点,以更好地反映患者体内血浆6-MP的浓度。
[1]Qiu Y, Mao R, Zhang S H,etal. Safety Profile of Thiopurines in Crohn Disease[J]. Medicine, 2015, 94(41): e1513.
[2]Teich N, Mohl W, Bokemeyer B,etal. Azathioprine-induced acute pancreatitis in patients with inflammatory bowel diseases-A prospective study on incidence and severity[J]. J Crohns Colitis, 2015, 10(1): 61-68.
[3]肖冬媛. 硫唑嘌呤不良反应的临床表现与安全用药[J]. 中国处方药, 2016, 14(2): 38-39.
[4]Haines M L, Ajlouni Y, Irving P M,etal. Clinical usefulness of therapeutic drug monitoring of thiopurines in patients with inadequately controlled inflammatory bowel disease[J]. Inflamm Bowel Dis, 2011, 17(6): 1301-1307.
[5]Konidari A, Anagnostopoulos A, Bonnett L J,etal. Thiopurine monitoring in children with inflammatory bowel disease: a systematic review[J]. Br J Clin Pharmacol, 2014, 78(3): 467-476.
[6]Gilissen L P, Wong D R, Engels L G,etal. Therapeutic drug monitoring of thiopurine metabolites in adult thiopurine tolerant IBD patients on maintenance therapy[J]. J Crohns Colitis, 2012, 6(6): 698-707.
[7]Cangemi G, Barabino A, Barco S,etal. A validated HPLC method for the monitoring of thiopurine metabolites in whole blood in paediatric patients with inflammatory bowel disease[J]. Int J Immunopathol Pharmacol, 2012, 25(2): 435-444.
[8]朱妍妍, 柏智能, 唐丽琴. 反相高效液相色谱法测定硫唑嘌呤代谢产物6-巯基嘌呤血浆药物浓度[J]. 安徽医药, 2016, 20(6): 1081-1083.
[9]AL-Ghobashy M A, Hassan S A, Abdelaziz D H,etal. Development and validation of LC-MS/MS assay for the simultaneous determination of methotrexate, 6-mercaptopurine and its active metabolite 6-thioguanine in plasma of children with acute lymphoblastic leukemia: Correlation with genetic polymorphism[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1038: 88-94.
[10] 陈曲波. 自身免疫性肝炎的诊断与治疗[J]. 临床肝胆病杂志, 2007, 23(6): 457-459.
[11] Chande N, Patton P H, Tsoulis D J,etal. Azathioprine or 6-mercaptopurine for maintenance of remission in Crohn's disease[J]. Cochrane Database Syst Rev, 2015(10): CD000067.
[12] 匡荣, 陈男, 倪维芳. HPLC测定硫唑嘌呤片有关物质[J]. 中国现代应用药学, 2013, 30(2): 180-183.
[13] Zakrzewski R, Borowczyk K, uczak A,etal. Determination of urinary 6-mercaptopurine and three of i.ts metabolites by HPLC-UV coupled with the iodine-azide reaction[J]. Bioanalysis, 2013, 5(8): 869-877.
