口服幽门螺杆菌多价表位疫苗的构建及其免疫效果研究*
2018-05-02牛晓娟潘龙瑞
柯 鸿,牛晓娟,潘龙瑞,潘 兴
1. 湖北医药学院附属人民医院 血液内科(十堰 442000);2.湖北医药学院 生物科学系(十堰 442000); 3.湖北医药学院 药理学教研室(十堰 442000);4.十堰市太和医院感染与免疫性疾病研究所(湖北医药学院附属医院)(十堰 442000)
幽门螺杆菌(Helicobacterpylori,H.pylori)在全球范围内的感染率已超过50%,在我国的感染率为42%~90%,现已确定为慢性胃炎、消化性溃疡、胃癌等消化道疾病的主要致病菌,1994 年被世界卫生组织列为Ⅰ类致癌因子[1-2]。
抗原表位,又称抗原决定簇或抗原决定基(antigenic determinant,AD),决定了抗原分子的特异性。H.pylori感染可刺激机体产生强烈的免疫应答反应,但却不能使其清除,原因在于机体对H.pylori自身天然抗原产生了免疫耐受,选择H.pylori保护性抗原的优势表位来构建表位疫苗,有可能打破机体的免疫耐受,从而达到免疫预防和清除H.pylori感染的目的[3]。
本研究根据文献查找、筛选出了幽门螺杆菌相关抗原的12个显性表位序列,分别为HpaA88-100、HpaA132-141、UreA27-53、UreA183-203、UreB229-251、UreB317-329、UreB321-339、UreB373-385、UreB438-452、UreB546-561、CagA149-164、CagA196-217[4]。通过Linker将其串联,在其N端引入分子内佐剂CTB序列,即为口服幽门螺杆菌多价表位疫苗CTB-HUUC,并初步探究了其对BABL/c小鼠的免疫治疗效果。
1 材料和方法
1.1 材料
1.1.1 小鼠及菌株 SPF级BABL/c小鼠,雌性,5~6周龄,体质量14~18 g。H.pyloriSS1为本实验室传代保种。
1.1.2 仪器与主要实验试剂 AKTA pure 25蛋白纯化仪、Ni Sepharose HP层析填料、GSTrap HP层析柱购自GE公司;胶回收试剂盒、质粒提取试剂盒购自TIANGEN;蛋白胨、酵母抽提物购自OXOID公司;其他试剂为进口或国产分析纯。
1.2 方法
1.2.1 重组ctB-HUUC基因设计与合成 通过Linker序列(KK)将以下表位进行串联:HpaA88-100、HpaA132-141、UreA27-53、UreA183-203、UreB229-251、UreB317-329、UreB321-339、UreB373-385、UreB438-452、UreB546-561、CagA149-164、CagA196-217,并通过Linker序列(GSGS)在其N端引入分子内佐剂CTB序列,见图1。密码子优化后,由上海生工进行基因合成。ctB-HUUC基因序列如下。

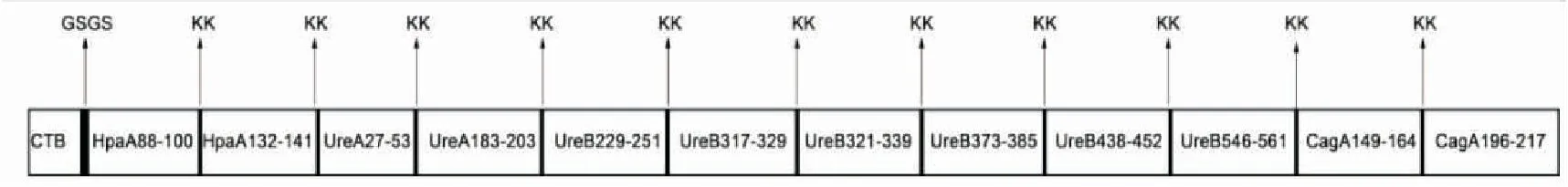
图1 口服幽门螺杆菌多价表位疫苗CTB-HUUC的设计示意图
1.2.2 重组质粒pET28a(+)/ctB-HUUC构建 将ctB-HUUC基因通过NcoⅠ、XhoⅠ酶切位点与pET28a(+)载体相连,酶切、测序鉴定。
1.2.3 重组蛋白CTB-HUUC的诱导、表达及纯化
将测序正确的重组质粒pET28a(+)/ctB-HUUC转化大肠杆菌BL21(DE3)感受态。挑取单克隆至100 mL LB液体培养基中,37 ℃过夜培养。第二天以1∶100接种至2 000 mL LB液体培养基中,培养至OD600约0.6,加入IPTG至终浓度为0.5 mM,诱导18 h。12 000 rpm离心30 min收集菌体;超声裂解液重悬菌体,超声60 min;18 000 rpm离心45 min,收集上清;0.22 μm过滤,备用。采用Ni Sepharose HP层析填料纯化,纯化结合缓冲液为25 mM Tris-HCl、150 mM NaCl、30 mM咪唑,pH7.4;洗脱缓冲液为25 mM Tris-HCl、150 mM NaCl、500 mM咪唑,pH7.4。
1.2.4 Western Blot 蛋白经SDS-PAGE凝胶电泳分离,浓缩胶电压80 V、15 min;分离胶120 V、50 min。之后采用半干转法进行Western Blot转膜,调整电压至24 V、恒压转PVDF膜1 h。5%脱脂奶粉室温封闭30 min,TBST洗涤3次,5 min/次。添加兔抗幽门螺杆菌抗体(1∶1 000稀释)(ThermoFisher Scientific,美国)或者鼠抗CTB单抗(1∶5 000稀释)(Abcam,美国),室温孵育2 h,TBST洗涤4次,5 min/次。添加HRP-羊抗鼠IgG(1∶10 000稀释)(Sigma,美国)或者HRP-羊抗兔IgG(1∶10 000稀释)(Sigma,美国),室温孵育1 h,TBST洗涤4次,5 min/次。采用Immobilon Western Chemiluminescent HRP Substrate(Millipore,美国)试剂进行显影,Carestream 医用X光洗片机进行洗片。
1.2.5 GM1-ELISA 采用神经节苷脂(GM1)酶联免疫吸附法(GM1-ELISA)测定重组蛋白CTB-HUUC体外结合GM1的能力。实验组酶标板包被1 μg/孔GM1,对照组酶标板包被1 μg/孔牛血清白蛋白(BSA),4 ℃过夜。采用含有5%BSA 的PBST封闭液37 ℃封闭1 h。每孔加入0、2、4、8、16、32 μg CTB-HUUC;0、2、4、8、16、32 μg CTB或者0、2、4、8、16、32 μg BSA,每孔再加入小鼠抗CTB单抗(1∶5 000稀释),37 ℃孵育1 h。HRP标记的羊抗鼠IgG(1∶10 000稀释),37 ℃孵育1 h。加入配制的TMB底物溶液100 μL/孔,37 ℃孵育15 min。各反应孔中加入2 M硫酸50 μL,终止反应。在酶标仪450 nm处,以空白对照孔调零后测各孔OD值,若大于规定的阴性对照OD值的2.1倍,即为阳性。
1.2.6H.pyloriSS1感染BABL/c 小鼠 SPF级BABL/c小鼠,雌性,6周龄,随机分为3组,每组6只。口服灌胃50 μLH.pyloriSS1,菌落总数为109CFU,口服1次/d,连续感染4次。末次感染后4周,CTB-HUUC组和CTB组口服灌胃重组蛋白200 μg/次,每周1次,连续免疫4次。PBS组口服PBS 100 μL/次,每周1次,连续灌胃4次。末次免疫后2周,脱颈处死小鼠,取出小鼠胃组织,沿着胃大弯一分为二。将其中1/2胃组织放入2 mL EP管中,组织匀浆器进行匀浆,梯度稀释,涂布幽门螺杆菌选择性固体平板培养、计数。
1.3 统计学方法
2 结果
2.1 重组质粒pET28a(+)/ctB-HUUC酶切鉴定
pET28a(+)/ctB-HUUC经NcoⅠ、XhoⅠ双酶切后,琼脂糖凝胶电泳时出现一条约1 000 bp的条带;与ctB-HUUC基因理论大小1 071 bp一致(图2)。测序结果与ctB-HUUC基因理论序列100%一致,重组质粒pET28a(+)/ctB-HUUC构建正确。
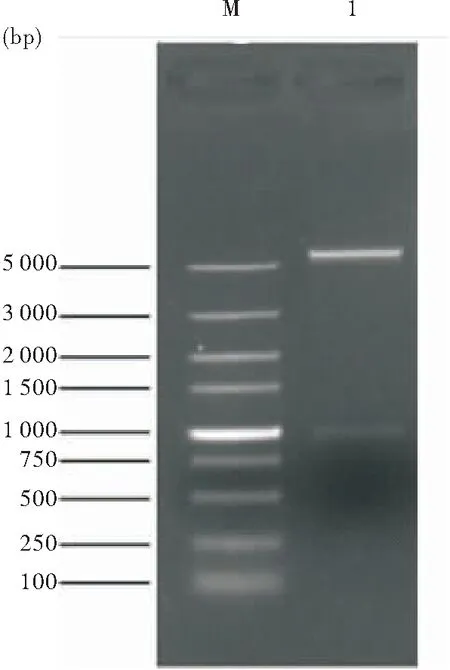
图2 重组质粒pET28a(+)/ctB-HUUC酶切鉴定
注:M:DNA Marker;1:pET28a(+)/ctB-HUUC质粒经NcoⅠ、XhoⅠ双酶切
2.2 重组蛋白CTB-HUUC的诱导、表达及纯化
pET28a(+)/ctB-HUUC转化大肠杆菌BL21(DE3),经IPTG诱导表达,SDS-PAGE电泳检测,诱导后的菌体在40 kDa处出现显著加粗的蛋白条带,与理论蛋白大小一致,灰度扫描结果显示,其表达量占菌体总蛋白的28.6%。重组蛋白CTB-HUUC经镍离子层析柱纯化后纯度为96.3%(图3)。
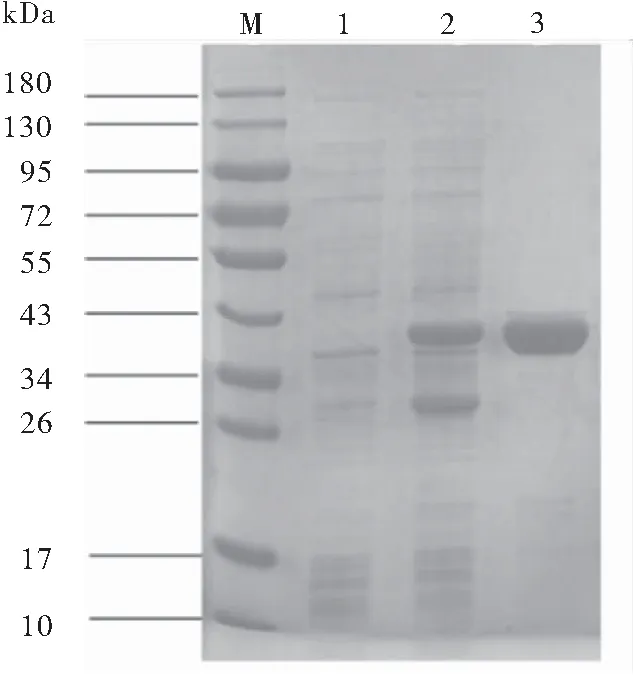
图3 重组蛋白CTB-HUUC的诱导表达及纯化
注:M:Protern Marker;1:诱导前菌体;2:诱导后菌体;3:纯化后CTB-HUUC样品
2.3 Western Blot鉴定重组蛋白CTB-HUUC
重组CTB蛋白、重组CTB-HUUC蛋白经SDS-PAGE分离后,分别进行考马斯亮蓝染色及Western Blot分析,结果见图4。CTB-HUUC蛋白均可与CTB单抗及抗H.pyloriSS1小鼠血清发生特异性反应。
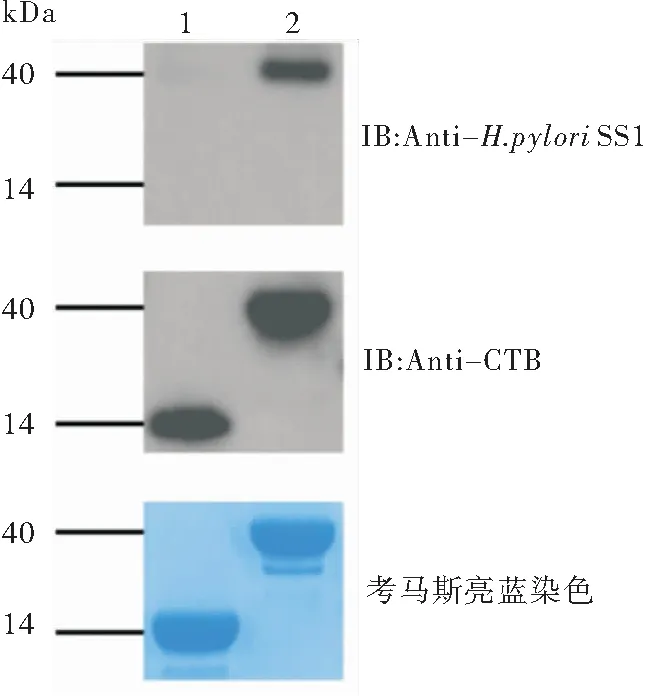
图4 Western Blot鉴定重组蛋白CTB-HUUC
注:1:CTB蛋白;2:CTB-HUUC蛋白。一抗:鼠抗CTB单抗1∶5 000稀释,兔抗幽门螺杆菌抗体1∶1 000稀释;二抗: HRP-羊抗鼠IgG1∶10 000稀释,HRP-羊抗兔IgG 1∶10 000稀释
2.4 GM1-ELISA检测重组蛋白CTB-HUUC体外结合GM1的能力
重组CTB蛋白、重组CTB-HUUC蛋白体外均可和GM1结合,并且在一定浓度范围内,随着CTB-HUUC浓度升高其结合GM1的能力加强,呈浓度依赖关系,而对照组BSA蛋白不能结合GM1(图5)。说明重组蛋白CTB-HUUC具有良好的分子内佐剂活性。
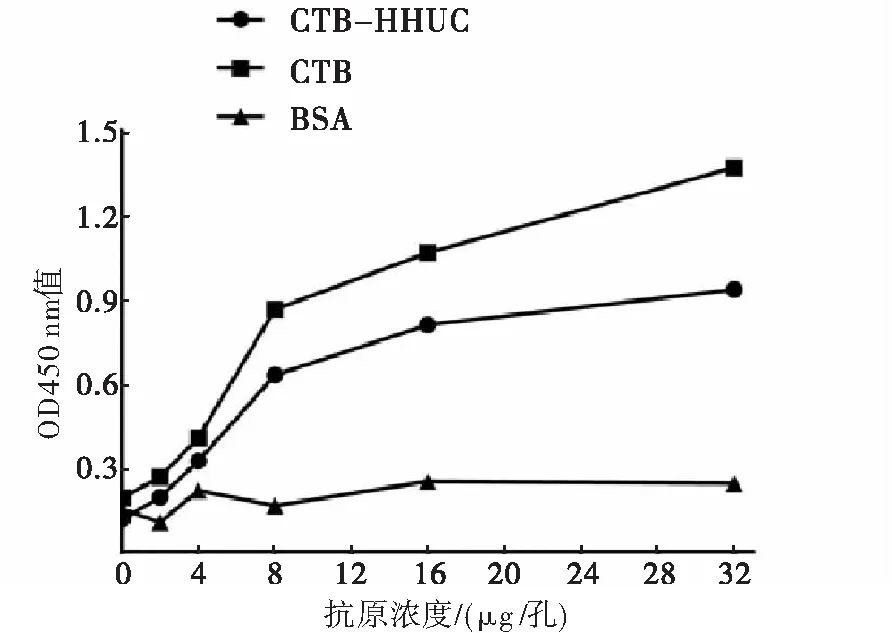
图5 GM1-ELISA检测重组蛋白CTB-HUUC的分子内佐剂活性
注:实验组酶标板包被1 μg/孔GM1,对照组酶标板包被1 μg/孔牛血清白蛋白(BSA)。CTB-HUUC组、CTB组和BSA组每孔分别加入0、2、4、8、16、32 μg蛋白 。每孔再加入小鼠抗CTB单抗(1∶5 000稀释),37 ℃孵育1 h。HRP标记的羊抗鼠IgG(1∶10 000稀释),37 ℃孵育1 h。TMB显色,测各孔OD450 nm值
2.5 口服幽门螺杆菌多价表位疫苗CTB-HUUC的免疫治疗效果
H.pyloriSS1在固体选择性平板培养3~5 d后,菌落呈圆形、无色、透明、针尖样(图6A)。H.pyloriSS1为革兰阴性细菌,呈弯曲、S 形或海鸥形(图6B)。BABL/c小鼠口服幽门螺杆菌多价表位疫苗CTB-HUUC的免疫治疗方案见图6C。末次免疫后2周,小鼠胃组织研磨液在幽门螺杆菌固体选择性平板上进行培养计数统计,CTB-HUUC组、CTB组和PBS组分别为:6.14×103、5.72×106、6.70×106CFU/g(图6D)。
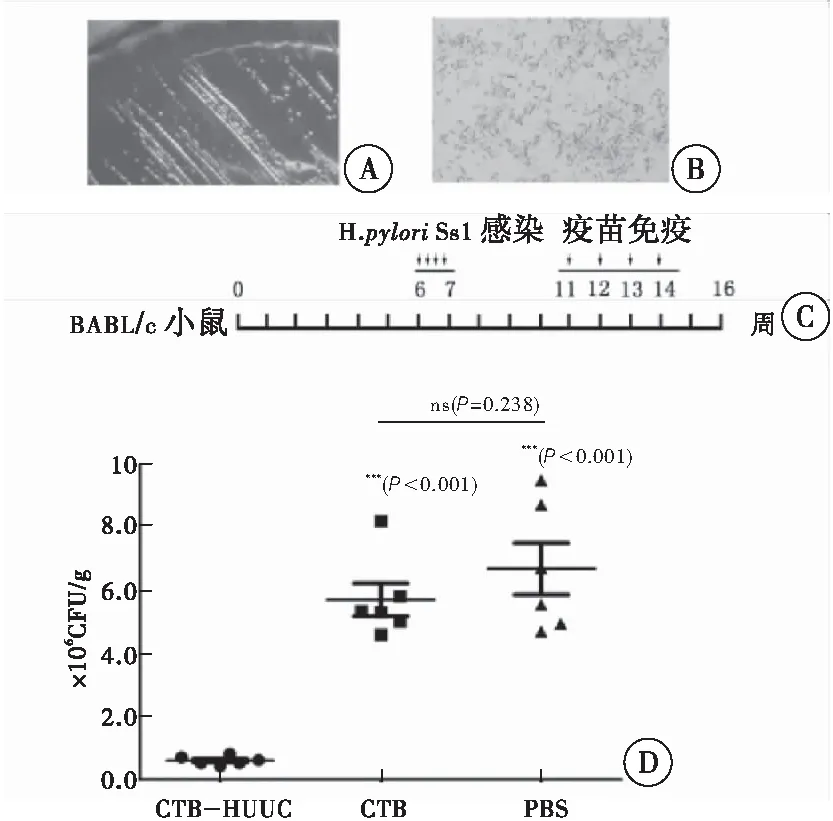
图6 幽门螺杆菌多价表位疫苗CTB-HUUC的免疫治疗效果
注: A:H.pyloriSS1在固体选择性平板培养3 d后菌落形态;B:H.pyloriSS1革兰染色,显微镜下放大1 000倍观察;C:小鼠感染与免疫治疗实验方案; D:末次免疫后2周,小鼠胃组织研磨液在幽门螺杆菌固体选择性平板培养计数统计。与CTB-HUUC组比较,***P<0.001;CTB组与PBS组比较,ns(P=0.238)
3 讨论
目前H.pylori感染的治疗方案为质子泵抑制剂、 阿莫西林加上甲硝唑或克拉霉素的“三联疗法”,但随着抗生素的大量使用,H.pylori产生了较普遍的耐药性,且抗生素疗法疗效不良反应较多,菌体清除后机体易产生二次感染等缺陷,因此,研发H.pylori疫苗显得尤为重要[3]。
N-乙酰神经氨酰乳糖结合原纤维血凝素(H.pyloriadhesion A subunit, HpaA)是由H.pylori产生于菌体表面并参与和胃上皮细胞发生特异性黏附,以其作为免疫原进行疫苗研究得到了极大关注[5]。
尿素酶分布在H.pylori表面,占全菌体蛋白的5%~10%,它由A、B 2个亚单位组成,呈六聚体,几乎所有H.pylori菌株均能产生尿素酶,且尿素酶氨基酸同源性很高。在胃部强酸性环境中,H.pylori的尿素酶能够水解尿素释放氨和水,在菌体周围形成“氨云”以抵抗胃部中的酸性环境[6]。因此,尿素酶是H.pylori最佳的疫苗候选抗原之一[7]。
细胞毒素相关蛋白A (Cytotoxin-associated gene A, CagA)是H.pylori编码的一种重要毒力因子,由Cag致病岛(Cag pathogenicityisland, cag PAI)编码、经Ⅳ型分泌系统(type 4 secretion system,T4SS)分泌并转入胃上皮细胞内,具有致癌作用[8]。东亚国家人群的H.pylori分离株90%以上可编码CagA蛋白,在欧美国家人群中约有60%~70%的H.pylori编码CagA蛋白,因而,CagA作为H.pylori疫苗的候选抗原也得到了大量研究[9]。
自1983年两位澳大利亚科学家Marshall和Warren发现并分离出H.pylori以来,H.pylori疫苗的研发一直广受关注[10]。近年来,H.pylori疫苗的研发取得了重要进展,第三军医大学与安徽芜湖康卫生物科技有限公司研制出了以尿素酶B亚单位为疫苗抗原,以LTA2B为分子内黏膜佐剂的口服幽门螺杆菌疫苗,Ⅲ期临床试验结果显示,在6~15岁儿童体内疫苗的保护率为71.8%[11]。
尽管H.pylori单亚单位疫苗取得了重要突破,多价疫苗或许会进一步提高疫苗的免疫强度和广度,进而阻止病原体H.pylori的变异性免疫逃避[12]。
本研究选择HpaA、UreA、UreB及CagA作为口服幽门螺杆菌多价疫苗的靶抗原,但考虑到重组蛋白HpaA-UreA-UreB-CagA的分子量过大及其在诱导表达、纯化过程中潜在的问题,因而,根据文献报道,分别在靶抗原HpaA中选择了1个Th细胞表位HpaA88-100和1个B细胞表位HpaA132-141[13];在靶抗原UreA中选择了1个Th细胞表位UreA27-53和1个B细胞表位UreA183-203[14];在靶抗原UreB中选择了5个Th细胞表位UreB229-251、UreB317-329、UreB373-385、UreB438-452、UreB546-561和1个B细胞表位UreB321-339[15-16];在靶抗原CagA中选择了2个Th细胞表位CagA149-164和CagA196-217[15];再通过Linker序列(KK)将其进行串联,并通过Linker序列(GSGS)在其N端引入分子内佐剂CTB序列,形成口服幽门螺杆菌多价表位疫苗CTB-HUUC(图1)。
SDS-PAGE检测CTB-HUUC蛋白纯度为96.3%,可很好满足小鼠免疫治疗要求(图3);Western Blot结果显示,CTB-HUUC蛋白均可与CTB单抗及抗H.pyloriSS1小鼠血清发生特异性反应(图4);GM1 ELISA结果显示,重组CTB-HUUC蛋白体外可和GM1结合,并且在一定浓度范围内,随着重组蛋白浓度的升高其结合GM1的能力也随着加强,呈浓度依赖关系,具有良好的分子内佐剂活性(图5)。BABL/c小鼠口服幽门螺杆菌多价表位疫苗CTB-HUUC后,其在幽门螺杆菌选择性固体平板培养计数为6.14×103(CFU/g),较CTB组5.72×106(CFU/g)以及PBS组6.70×106(CFU/g)降低(P<0.001)(图6)。
综上所述,本研究获得了纯度高达96.3%的重组CTB-HUUC蛋白,BABL/c小鼠口服CTB-HUUC后体内的H.pyloriSS1定值量明显降低。本研究下一步将深入研究CTB-HUUC刺激BABL/c小鼠所产生的免疫应答类型及其免疫保护机制。
[1]Eusebi L H, Zagari R M, Bazzoli F. Epidemiology of helicobacter pylori infection[J]. Helicobacter, 2014, 19: 1-5.
[2]Plummer M, Franceschi S, Vignat J,etal. Global burden of gastric cancer attributable toHelicobacterpylori[J]. Int J Cancer, 2014, 136(2): 487-490.
[3]Malfertheiner P, Megraud F, O′Morain C A,etal. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report[J]. Gut, 2017, 66(1): 6-30.
[4]Chen L, Li B, Yang W C,etal. A dominant CD4(+) T-cell response to Helicobacter pylori reduces risk for gastric disease in humans[J]. Gastroenterology, 2013, 144(3): 591-600.
[5]Hu J, Chen L, Yang W,etal. Systematic identification of immunodominant CD4+T cell responses to HpaA in Helicobacter pylori infected individuals[J]. Oncotarget, 2016, 7(34): 54380-54391.
[6]Fong Y H, Wong H C, Yuen M H,etal. Structure of UreG/UreF/UreH complex reveals how urease accessory proteins facilitate maturation of Helicobacter pylori urease[J]. PLoS Biol, 2013, 11(10): e1001678.
[7]Peleteiro B, Bastos A, Ferro A,etal. Prevalence of Helicobacter pylori infection worldwide: a systematic review of studies with national coverage[J]. Dig Dis Sci, 2014, 59(8): 1698-1709.
[8]Hatakeyama M. Helicobacter pylori CagA and gastric cancer: a paradigm for hit-and-run carcinogenesis[J]. Cell Host Microbe, 2014, 15(3): 306-316.
[9]Garza-González E, Perez-Perez G I, Maldonado-Garza H J,etal. A review of Helicobacter pylori diagnosis, treatment, and methods to detect eradication[J]. World J Gastroenterol, 2014, 20(6): 1438-1449.
[10] Graham D Y. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits[J]. Gastroenterology, 2015, 148(4): 719-731.
[11] Zeng M, Mao X H, Li J X,etal. Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2015, 386(10002): 1457-1464.
[12] Guo L, Yin R, Xu G,etal. Immunologic properties and therapeutic efficacy of a multivalent epitope-based vaccine against four Helicobacter pylori adhesins (urease, Lpp20, HpaA, and CagL) in Mongolian gerbils[J]. Helicobacter, 2017, 22(6): e12428.
[13] Li H B, Zhang J Y, He Y F,etal. Systemic immunization with an epitope-based vaccine elicits a Th1-biased response and provides protection against Helicobacter pylori in mice[J]. Vaccine, 2012, 31(1): 120-126.
[14] Guo L, Yang H, Tang F,etal. Oral Immunization with a Multivalent Epitope-Based Vaccine, Based on NAP, Urease, HSP60, and HpaA, Provides Therapeutic Effect on H. pylori Infection in Mongolian gerbils[J]. Front Cell Infect Microbiol, 2017, 7: 349.
[15] Yang W C, Chen L, Li H B,etal. Identification of two novel immunodominant UreB CD4(+) T cell epitopes in Helicobacter pylori infected subjects[J]. Vaccine, 2013, 31(8): 1204-1209.
[16] Nedrud J G, Bagheri N, Schön K,etal. Subcomponent vaccine based on CTA1-DD adjuvant with incorporated UreB class II peptides stimulates protective Helicobacter pylori immunity[J]. PLoS One, 2013, 8(12): e83321.
