介孔分子筛搭载槲皮素食品抗氧化活性包装膜制备及其性能研究
2018-05-01丘晓琳唐亚丽詹光颖
李 成,丘晓琳,唐亚丽,詹光颖
(1.江南大学,江苏无锡 214122; 2.江苏省食品先进制造装备技术重点实验室,江苏无锡 214122)
槲皮素(Quercetin)是一种多羟基黄酮类化合物,化学名为3,5,7,3′,4′-五羟基黄烷酮,存在于多种果实中,具有较好的耐热性,可承受300 ℃的高温[1]。槲皮素能提供氢原子与过氧化物自由基ROO·反应生成稳定的氢过氧化物ROOH,从而中断游离自由基链式反应[2]。Roedig[3]用含槲皮素的材料包装葵花籽油,发现槲皮素可以延缓油脂的氧化。Pekkarinen[4]用含槲皮素的材料进行抗氧化性测试,发现槲皮素的浓度不同其抗氧化效果也有一定差异。LaCoste等[5]将α-生育酚充填到薄膜中,发现抗氧化剂的释放速率有明显延缓。1992年,Beck等[6]首次合成MCM(Mobil Composition of Matter)系列介孔分子筛之后,其多功能性的研究便成为国际热点[7-8]。其中,介孔分子筛作为吸附剂,有介孔结构稳定、孔径规则可调、高比表面积的优点,搭载天然高分子物质后,可达到控制释放的作用[9]。控释包装(Controlled Realease Packaging,CRP)就是能够控制活性物质从基体包装材料中以可控的合适速率释放出来的包装,起到保证食品品质的安全,延长食品货架寿命的作用。Heirlings等[10]通过将天然抗氧化剂吸附于二氧化硅介孔材料(SBA-15)中,再将其添加到薄膜基材中,发现抗氧化剂的释放速率有所降低。
本研究通过控制原料的配比,制备出一种比表面积较高,孔道有序的二维六方分子筛(MCM-41),并对其各项性能进行表征。吸附槲皮素后将其填充到LDPE基材中制备出食品抗氧化活性包装膜,采用DPPH自由基清除法,研究其抗氧化活性及其缓释性。
1 材料与方法
1.1 材料与仪器
槲皮素、十六烷基三甲基溴化铵(CTAB)、正硅酸乙酯(TEOS)、25%氨水、无水乙醇(EtOH)、浓盐酸、二甲基硅油、95%乙醇 国药集团化学试剂有限公司;聚(乙二醇)-block-聚(丙二醇)-block-聚(乙二醇)Mn~2900(P131345)、1,1-二苯基-2-三硝基苯肼(DPPH) 上海阿拉丁生化科技股份有限公司;低密度聚乙烯(LDPE) ExxonMobil公司。
WH220-HT磁力搅拌器 德国Wiggens公司;水热合成反应釜 上海一凯仪器设备有限公司;RJ-TDL-50A低速台式大容量离心机 无锡瑞江分析仪器有限公司;真空干燥箱 上海一恒公司;TENSOR红外光谱仪(FT-IR) 德国Bruker公司;D2 PHASER θ立式测角仪 德国Bruker公司;ASAP 2010氮气吸附装置 美国Georgia公司,;1510扫描电子显微镜(SEM) 日本日立株式会社;DSCQ2000热重分析仪(TG) 美国沃特世公司;LTE16-40双螺杆挤出机、LMCR-300五层流延共挤机 LAB TECH 工程有限公司;TYS-T透湿测试仪、BYT-B1透气测试仪 济南兰光机电技术有限公司;LRX PLUS 5KN电子材料实验机 英国劳埃德(LLOYD)仪器公司;UV-1800紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 介孔分子筛MCM-41的制备 先将CTAB、25%氨水、P131345按0.4884∶2.6∶0.00954(本研究中使用0.96 g CTAB、1.8 g 25%氨水、0.15 g P131345)的摩尔比混合,用83.00 g去离子水溶解,在60 ℃下剧烈搅拌0.5 h,待模板剂完全溶解,逐滴加入6.00 g TEOS,继续搅拌2 h,转入150 mL水热反应釜中,在100 ℃晶化24 h。然后取出混合物,分别用无水乙醇和去离子水洗涤数次,采用酸醇萃取法将产物分散于100 mL无水乙醇和10 mL浓盐酸的混合物中,在80 ℃下回流6 h[11],取出产物,在550 ℃马弗炉中煅烧1 h,冷却后密封保存。
1.2.2 槲皮素的吸附 将1.00 g槲皮素在50 ℃溶解于50 mL无水乙醇中,得金黄色溶液,取1.2.1中0.50 g产物,加入到槲皮素无水乙醇溶液中,500 r/min下磁力搅拌3 h。分离后置于真空干燥箱中,真空度为0.08 MPa,烘干过夜,称重得1.13 g,得到MCM-41/Quercetin。
1.2.3 抗氧化活性包装膜的制备 在170 ℃下,使用双螺杆挤出机分别制备质量分数为1%的介孔分子筛、质量分数为1%的槲皮素、质量分数为1%的MCM-41/Quercetin的LDPE混合粒子,同时未添加介孔分子筛、槲皮素、MCM-41/Quercetin的LDPE粒子作为对照[12]。在190 ℃下,使用单螺杆挤出机分别制备对照膜和质量分数为1%的介孔分子筛、质量分数1%的槲皮素、质量分数为1%的MCM-41/Quercetin的LDPE薄膜,各类薄膜的厚度均为(55±2) μm。
1.2.4 介孔分子筛的分析 形貌分析:使用扫描电子显微镜(SEM)在15000倍下观察产物的表面形貌特征;结构分析:采用小角X射线衍射分析(SAXS),测试条件:CuKα(0.154 nm)靶,光管功率为2.2 kW,2θ扫描范围1~10°;氮气吸附脱附实验分析:根据等温吸附线,通过BET(Brunauer-Emmet-Teller)理论模型算法得其比表面积和孔体积,通过BJH(Barrett-Joyner-Halenda)模型得其孔径分布[13]。
1.2.5 搭载槲皮素的分析 成分分析:分别对介孔分子筛、槲皮素、吸附槲皮素后的介孔分子筛组装体MCM/Quercetin进行FT-IR分析,扫描范围为500~4500 cm-1;热稳定性分析:分别对MCM-41、槲皮素、MCM-41/Quercetin进行热失重分析(TG),测试条件:升温范围:25~800 ℃,升温速率:氮气保护下,10 ℃/min。
1.2.6 抗氧化活性包装膜的性能分析
1.2.6.1 力学性能 分别对1.2.3中充填1%介孔分子筛的薄膜、1%槲皮素的薄膜、1% MCM-41/Quercetin的薄膜进行拉伸性能测试,测试方法参照GBT 1040.3-2006:样品薄膜厚度为(55±2) μm,宽度为15 mm,实验速度为200 mm/min,夹具间的初始距离为50 mm,测试三次取算数平均值。
1.2.6.2 阻隔性能 分别对1.2.3中充填1%介孔分子筛的薄膜、1%槲皮素的薄膜、1% MCM-41/Quercetin的薄膜进行阻隔性能测试。氧气透过性测试参照GB/T 1038-2000压差法,每类薄膜各取三张12 cm×12 cm的样品,测试三次取算数平均值;透水蒸气性测试参照GB 1037-88杯式法,每类薄膜各取三张直径为8 cm的样品,测试三次取算数平均值。
1.2.6.3 DPPH自由基清除率 DPPH法目前并未有一个标准化的方法,根据本研究中紫外分光光度计的精度及实际实验条件[14],设计以下实验方法:精确称取19.7 mg DPPH,加入到500 mL 95%乙醇中,充分溶解,配制成浓度为0.1 mol/L的DPPH 95%乙醇溶液。将未添加抗氧化剂的对照膜和不同成分的复合膜裁成40 mm×40 mm大小的试样,切成均匀碎片,放入10 mL棕色样品瓶中,在瓶中加入所配DPPH溶液后密封,置于37 ℃的培养箱中,避光反应0.5 h和24 h。待复合薄膜释放出的槲皮素与DPPH完全反应,用紫外分光光度计测定反应后体系在517 nm处吸光度,使用公式(1)计算活性膜的DPPH自由基清除率。将所有活性膜密封保存1200 h(50 d)后,重复上述实验,计算DPPH自由基清除率:
式(1)
式(1)中,A对照-对照薄膜的吸光度,即对照膜的DPPH自由基95%乙醇溶液的吸光度;A样品-多层薄膜的吸光度,即多层薄膜与DPPH自由基95%乙醇溶液反应混合溶液体系的吸光度。
1.2.6.4 槲皮素释放速率的测定 槲皮素标准曲线的绘制:精确称量0.0020 g干燥的槲皮素,用800 mL/L的乙醇溶液溶解,定容于250 mL容量瓶,得浓度为8 μg/mL 槲皮素标准品溶液。用紫外分光光度计测定不同浓度槲皮素溶液的吸光度,设置扫描最大吸收波长为374 nm,绘制槲皮素标准曲线[15]。
槲皮素从活性膜向食品模拟液中的释放测试:将1.2.3中槲皮素薄膜、MCM/Quercetin薄膜分别裁成15个80 mm×40 mm的矩形膜样,放入40 mL的棕色样品瓶中,选用40 mL 95%乙醇作为食品模拟物,加入棕色样品瓶中,密封后置于37 ℃的生化培养箱中,进行释放实验。分别定期取15次样品瓶中的模拟液,测定吸光度,按照(1)中的线性回归方程求得对应测试时间点模拟液中槲皮素的浓度。
活性膜扩散系数的拟合:本研究中,槲皮素的释放量很低且双面释放,扩散过程属于非稳态情况下,活性膜在模拟物中初始分布均匀,表面浓度相等的数学模型[16]。活性物质的扩散过程用基于菲克第二扩散定律的数学模型来描述,扩散系数D用以评估活性物质的扩散速率。使用公式(2)对扩散系数D进行估算:
式(2)
式(2)中,Mt-时间t内释放到食品模拟液中的抗氧化剂的质量,μg;t-扩散时间,s;M∞-释放达到平衡时模拟液中的抗氧化剂的质量,μg;dp-膜厚度,cm;D-扩散系数,cm2/s。
若活性物质从材料向食品模拟液中的释放程度较低(Mt/M∞<0.6),实验结束时释放还未达到平衡,可以将公式(2)简化成公式(3)[17]:
式(3)
式(3)中,Mp-活性材料中抗氧化剂的初始含量。
将槲皮素薄膜、MCM/Quercetin薄膜分别测得的15组数据用Matlab拟合得到扩散系数D(cm2/s)。
2 结果与分析
2.1 介孔二氧化硅的结构与表面形貌特征
2.1.1 形貌分析 如图1所示,在15000倍下明显观察到本研究制备的MCM-41呈六方棒状,并且大小均匀。MCM-41的SAXS分析如图2所示,介孔MCM-41的射线衍射图谱存在与孔道的六方排列对应在2θ为1.80°处有较强的衍射峰,即(100)面,另外几个次峰分别对应(110)、(200)等晶面,表明所制得的纳米二氧化硅为典型MCM-41的二维六方结构。

图1 MCM-41扫描电镜图Fig.1 Scanning electron microscopy of MCM-41

图2 MCM-41小角X射线分析图Fig.2 Analysis of MCM-41 small angle x-ray scattering
2.1.2 孔结构分析 如图3所示,MCM-41的吸附脱附等温线呈现典型的Ⅳ型等温线,在P/P0=0.1~0.4时,等温线向上凸,吸附量持续增加。相对压力增加到0.85附近时,等温线上升平缓;在P/P0=0.85~1.0时,等温线向下凹,吸附量徒然上升,达到吸附量的最高值,然后出现脱附等温线,P/P0回到0,这是高度有序介孔材料的特征[18]。另外,从图3中可以看出,吸附等温线和脱附等温线不重合,这可能是由于发生毛细凝聚现象,导致吸附滞后(Adsorption Hysteresis)的结果。将所得的氮气吸附脱附等温线通过BET(Brunauer-Emmet-Teller)理论模型算法得到MCM-41的表面积为439.173 m2/g,孔体积为0.665 cm3g-1;如图4所示,介孔分子筛在两个孔尺寸处的吸附体积达到峰值,得到孔径分布图,根据BJH(Barrett-Joyner-Halenda)模型得其孔径分布为2.4 nm和4.0 nm,MCM-41较小的孔径分布和较高的比表面和孔体积,有利于天然高分子的搭载。

图3 MCM-41氮气吸附脱附等温线Fig.3 Nitrogen adsorption desorption isotherm of MCM-41

图4 MCM-41孔径分布Fig.4 Pore size distribution of MCM-41
2.2 介孔二氧化硅搭载槲皮素性能分析
2.2.1 成分分析 如图5所示,波数1086 cm-1附近的吸收谱带,是由孔道内部和外部的Si-O和外部的Si-O非对称伸缩振动引起的,800 cm-1附近的吸收峰归因于对称的Si-O-Si伸缩振动和四面体Si-O-Si弯曲振动,在970 cm-1附近,样品有一个窄而尖的吸收谱带,归因于Si-O基团的伸缩振动,这是MCM-41介孔分子筛骨架特征的吸收峰[19]。MCM-41/Quercetin分别出现了槲皮素的特征吸收峰和MCM-41的970 cm-1特征吸收峰,则表明MCM-41/Quercetin样品吸附了槲皮素天然抗氧剂,并且很容易被检测到。
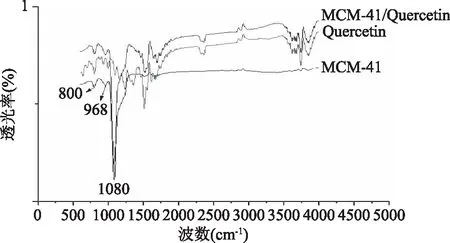
图5 MCM-41、槲皮素、MCM-41/Quercetin红外光谱图Fig.5 Infrared comparison of MCM-41 and molecular sieve loaded with Quercetin
2.2.2 温度的影响 由图6可知,MCM-41样品有轻微的热失重,考虑其多孔性以及可能残留的少量反应有机物,其减小的质量可能是吸附的空气中的水分以及少量的残留物,属于正常范围;槲皮素的热失重图可得出其在350 ℃左右分解速率最高,加热到800 ℃后并未完全分解,其现象为黑色的产物,应为槲皮素高温反应后的碳化物;MCM-41吸附槲皮素的样品经热重测试后,可看出其失重速率明显减慢,则MCM-41可能可以增加槲皮素的热稳定性。

图6 MCM-41、槲皮素、MCM-41/Quercetin热重分析图Fig.6 Comparative analysis of termogravimetric analysis of MCM-41 and molecular sieve loaded with Quercetin
2.3 抗氧化活性包装膜性能分析
2.3.1 力学性能分析 由表1可知,在分别添加了纯槲皮素、纯分子筛和搭载槲皮素的分子筛后,薄膜的杨氏模量降低,但断裂伸长率变大,说明粉体的添加可以使高聚物薄膜韧性变好。当向高聚物基材中充填粉体,粉体粒子在高聚物基体中的分散性较好时,可以作为应力集中点,引发大量的银纹,从而吸收冲击能量,使得复合材料的韧性变好,但是,同时造成界面缺陷增多,无机填料周围产生应力集中,导致复合材料杨氏模量降低[20]。
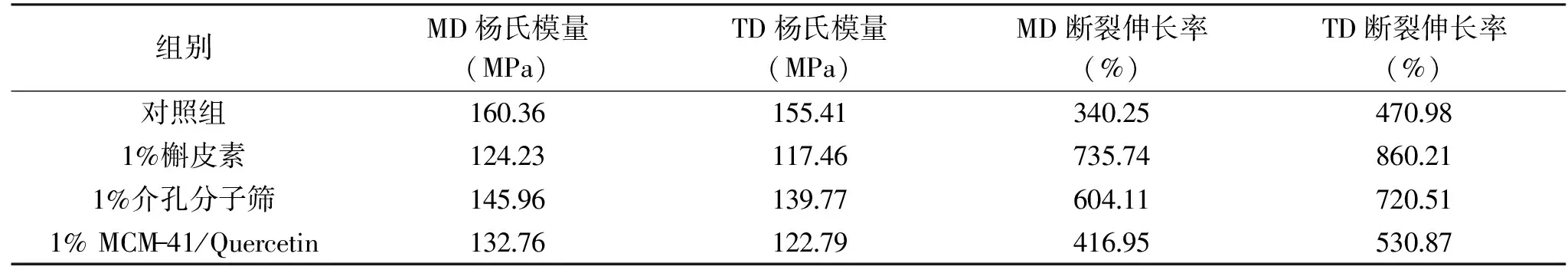
表1 MCM-41、槲皮素、MCM-41/Quercetin薄膜力学性能Table 1 Mechanical properties of films
2.3.2 透湿透氧性分析 由表2可知,添加介孔分子筛后对薄膜的透湿性影响不大;添加纯槲皮素和MCM-41/Quercetin组装体后,薄膜的透湿量下降,因为槲皮素的疏水性,使水蒸气的透过受阻;抗氧剂的添加,使O2的吸收加快,透气系数增加。

表2 MCM-41、槲皮素、MCM-41/Quercetin薄膜透湿透氧性Table 2 Water vapor permeability and oxygen permeability of films
2.3.3 DPPH自由基清除结果 由表3可得,0.5、24、1200 h时,质量分数1%的槲皮素活性膜的DPPH自由基清除率均最高,但第1200 h时,质量分数1%的槲皮素活性膜的清除率相较24 h时稍有下降,质量分数1% MCM-41/Quercetin的活性膜的清除率相较24 h时有所提高,对照组的实验和质量分数1%的介孔分子筛膜的实验验证了实际实验中存在一些偏差。

表3 MCM-41、槲皮素、MCM-41/Quercetin薄膜的吸光度及自由基清除率分析Table 3 Absorbance and free radical scavenging rate analysis of films
2.3.4 活性膜中抗氧化剂释放速率 如图7所示,槲皮素标准曲线的线性回归方程为y=0.0858x+0.0053,R2=0.9991,实验结果表明在0.2~8 μg/mL范围内呈现良好的线性关系。图8为质量分数1%槲皮素膜和质量分数1% MCM-41/Quercetin膜中槲皮素释放行为的拟合曲线,由Mt/Mp的值可以看出,实验结束时(约52 d),两类活性膜中槲皮素的释放均未达到平衡。槲皮素膜中槲皮素的扩散系数D=2.127×10-13cm2/s,实验结束时食品模拟物中槲皮素的浓度为6.52 μg/mL;MCM-41/Quercetin膜中槲皮素的扩散系数D=3.089×10-14cm2/s,实验结束时食品模拟物中槲皮素的浓度为2.70 μg/mL。槲皮素经过分子筛搭载后,在高聚物基材中的扩散系数下降了一个数量级,说明介孔分子筛对槲皮素的释放有明显的控释作用。
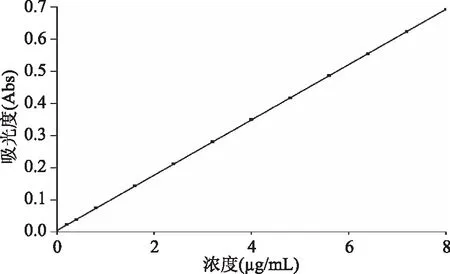
图7 槲皮素标准曲线Fig.7 The standard curve of quercetin

图8 槲皮素膜、MCM-41/Quercetin膜的释放行为Fig.8 Release behavior of quercetin film and MCM-41/Quercetin film
3 结论
利用TEOS、CTAB、NH3·H2O和P131345按摩尔比为1∶0.4884∶2.6∶0.00954,制备出一种双孔道介孔二氧化硅,SEM、SAXS和氮气吸附脱附研究表明产物为高度有序的二维六方结构,其比表面积为439.173 m2/g,孔体积为0.665 cm3g-1,孔径分布为2.4和4.0 nm。TG测试表明以介孔分子筛为载体可以增加天然抗氧剂的热稳定性。DPPH自由基清除实验表明了MCM-41/Quercetin抗氧化活性膜的有效性,同时第1200 h(50 d)的清除率为66.01%,表明活性膜的长效性。MCM-41/Quercetin膜中槲皮素的扩散系数D(cm2/s)比未经分子筛搭载槲皮素膜的扩散系数低,由2.127×10-13下降到3.089×10-14,表明介孔分子筛对抗氧化剂有控释作用。
[1]Boots A W,Haenen G R M M,Bast A. Health effects of quercetin:From antioxidant to nutraceutical[J]. European Journal of Pharmacology,2008,585(2):325-337.
[2]李银聪,阚建全,柳中. 食品抗氧化剂作用机理及天然抗氧化剂[J]. 中国食物与营养,2011,17(2):24-26.
[3]Roedig-Penman A,Gordon M H. Antioxidant properties of myricetin and quercetin in oil and emulsions[J].Journal of the American Oil Chemists Society,1998,75(2):169-180.
[4]Pekkarinen S S,Heinonen I M,Hopia A I. Flavonoids quercetin,myricetin,kaemferol and catechin as antioxidants in methyl linoleate[J]. Journal of the Science of Food and Agriculture,1999,79(4):499-506.
[5]LaCoste A,Schaich K M,Zumbrunnen D,et al. Advancing controlled release packaging through smart blending[J].Packaging Technology and Science,2005,18(2):77-87.
[6]Beck J S,Vartuli J C,Roth W J,et al. A new family of mesoporous molecular sieves prepared with liquid crystal templates[J].Journal of the American Chemical Society,1992,114(27):10834-10843.
[7]Davis M E. Organizing for better synthesis[J].Nature,1993,364(6436):391-393.
[8]Yang P,Zhao D,Margolese D I,et al. Generalized syntheses of large-pore mesoporous metal oxides with semicrystalline frameworks[J]. Nature,1998,396(6707):152.
[9]Qu F,Zhu G,Lin H,et al. A controlled release of ibuprofen by systematically tailoring the morphology of mesoporous silica materials[J].Journal of Solid State Chemistry,2006,179(7):2027-2035.
[10]Heirlings L,Siró I,Devlieghere F,et al. Influence of polymer matrix and adsorption onto silica materials on the migration ofα-tocopherol into 95% ethanol from active packaging[J].Food Additives and Contaminants,2004,21(11):1125-1136.
[11]Möller K,Kobler J,Bein T. Colloidal suspensions of mercapto-functionalized nanosized mesoporous silica[J].Journal of Materials Chemistry,2007,17(7):624-631.
[12]Gargiulo N,Attianese I,Buonocore G G,et al.α-Tocopherol release from active polymer films loaded with functionalized SBA-15 mesoporous silica[J].Microporous and Mesopororous Materials,2013,167(167):10-15.
[13]金彦任,黄振兴. 吸附与孔径分布[M].北京:国防工业出版社,2015:108-150.
[14]韦献雅,殷丽琴,钟成,等. DPPH法评价抗氧化活性研究进展[J]. 食品科学,2014,35(9):317-322.
[15]陈志刚,山光强,谭玉琴,等. 紫外分光光度法测定槲皮素含量方法的建立[J]. 动物医学进展,2016,37(1):122-124.
[16]王利兵. 食品包装安全学[M].北京:科学出版社,2011:992-993.
[17]Chen X,Lee D S,Zhu X,et al. Release kinetics of tocopherol and quercetin from binary antioxidant controlled-release packaging films[J].Journal of Agricultural and Food Chemistry,2012,60(13):3492.
[18]Das D,Lee J F,Cheng S. Selective synthesis of Bisphenol-A over mesoporous MCM silica catalysts functionalized with sulfonic acid groups[J]. Journal of Catalysis,2004,223(1):152-160.
[19]Umamaheswari V,Palanichamy M,Murugesan V. Isopropylation of m-cresol over mesoporous Al-MCM-41 molecular sieves[J]. Journal of Catalysis,2002,210(2):367-374.
[20]王茹,许文才,李东立.无机纳米粒子改性剂对高聚物增强增韧的研究[C].全国包装工程学术会议,2008.
