鼠尾藻岩藻黄素超声辅助提取及其纯化工艺优化
2018-05-01牟海津
王 乐,李 丽,牟海津
(中国海洋大学食品科学与工程学院,山东青岛 266003)
岩藻黄素(fucoxanthin)亦称岩藻黄质、褐藻素,是一种脂溶性天然类胡萝卜素,为褐藻、硅藻、金藻及黄绿藻所含的色素,在褐藻中的量很高,其结构如图1所示。其外观为黄色粉末,不溶于水,易溶于乙醇。在偏酸性溶液、弱光和低温下比较稳定;在弱酸、弱碱条件下,发生颜色可逆变化;在强碱、强光或高温条件下则被破坏[1]。已经有研究证明岩藻黄素具有一定的抗癌、抗炎、抗氧化、抗肥胖等生物活性[2-6]。

图1 岩藻黄素结构Fig.1 Structure of fucoxanthin
鼠尾藻(Sargassumthunbergii(Mert.)O’Kuntze)属于马尾藻科马尾藻属,是太平洋西部特有的暖温带性海藻,是我国沿海常见的一种经济褐藻,主要分布于浙江东海近海区域、辽宁至福建沿海北起辽东半岛,南至雷州半岛的硇州岛,均有分布[7]。目前,鼠尾藻主要作为海参的饲料,应用于海参的养殖。国内大多关注于海带(Lam-inariajaponica)、裙带菜(Undariapinnatifida)、羊栖菜(Sargassumfusiforme)中岩藻黄素的提取工艺,对鼠尾藻中岩藻黄素的提取纯化工艺的报道很少,且传统方法提取时间长、溶剂消耗多、提取成本高[8-10],这严重制约了鼠尾藻岩藻黄素的大力开发以及工业化生产。
本文以鼠尾藻为原料,首先利用超声波辅助提取法和响应曲面法对岩藻黄素的提取工艺进行优化,然后运用硅胶层析柱对岩藻黄素粗品进行纯化,最后借助高效液相色谱法和质谱分析法对岩藻黄素进行分析。这不仅为鼠尾藻的大力开发利用提供了新的方向,同时也为制备高纯度岩藻黄素的工业化生产提供了技术支持。
1 材料与方法
1.1 材料与仪器
鼠尾藻 浙江舟山;200~300 目层析柱硅胶 青岛邦凯高新技术材料有限公司;醋酸铵 国药集团化学试剂有限公司;无水乙醇 天津市富宇精细化工有限公司;L-抗坏血酸 天津市瑞金特化学品有限公司;乙腈 美国Merck公司;甲醇 美国Merck公司;岩藻黄素标品 纯度≥99%,Sigma-Aldrich试剂公司。
Agilent 1260 Infinity高效液相色谱仪、Agilent 1260 Infinity/6410B液质联用仪 Agilent公司;Millipore Q超纯水器 美国Millipore公司;KQ5200E超声波清洗器 昆山市超声仪器有限公司;JA1003分析天平 上海天平仪器厂;TQ-2000Y粉碎机 永康市天祺盛世工贸有限公司。
1.2 实验方法
1.2.1 鼠尾藻干粉的制备 新鲜的鼠尾藻用自来水清洗,纱绢过滤去除多余水分,置于50 ℃鼓风干燥箱内干燥至恒重。干燥后的鼠尾藻用粉碎机粉碎,过60目筛,制得鼠尾藻干粉。
1.2.2 鼠尾藻岩藻黄素的提取 参照闫相勇等[10]的方法并做适当调整:精确称取一定量的鼠尾藻干粉和L-抗坏血酸,按照一定的液料比与一定体积分数的乙醇溶液均匀混合,在一定的超声温度下提取一定时间,提取液于4800 r/min离心20 min后取上清液测定吸光值,计算岩藻黄素得率。
1.2.3 单因素实验
1.2.3.1 乙醇体积分数对岩藻黄素得率的影响 称取10 g鼠尾藻粉,加入1.0%的L-抗坏血酸,按液料比为10 mL/g,分别加入50%、60%、70%、80%、90%的乙醇溶液,置于温度为50 ℃的超声波清洗器中,超声30 min,提取2次,取上清液,测定吸光值,计算岩藻黄素得率。
1.2.3.2 超声时间对岩藻黄素得率的影响 称取10 g鼠尾藻粉,加入1.0%的L-抗坏血酸,按液料比为10 mL/g,加入80%的乙醇溶液,置于温度为50 ℃的超声波清洗器中,分别超声10、20、30、40、50、60 min,提取2次,取上清液,测定吸光值,计算岩藻黄素得率。
1.2.3.3 超声温度对岩藻黄素得率的影响 称取10 g鼠尾藻粉,加入1.0%的L-抗坏血酸,按液料比为10 mL/g,加入80%的乙醇溶液,置于超声波清洗器中,设置温度分别为30、40、50、60、70 ℃,超声30 min,提取2次,取上清液,测定吸光值,计算岩藻黄素得率。
1.2.3.4 液料比对岩藻黄素得率的影响 称取10 g鼠尾藻粉,加入1.0%的L-抗坏血酸,分别按液料比为4、7、10、13、15 mL/g,加入80%的乙醇溶液,置于温度为50 ℃的超声波清洗器中,超声30 min,取上清液,提取2次,测定吸光值,计算岩藻黄素得率。
1.2.3.5 L-抗坏血酸添加量对岩藻黄素得率的影响 称取10 g鼠尾藻粉,分别加入0、0.2%、0.4%、0.6%、0.8%、1.0%的L-抗坏血酸,按液料比为10 mL/g,加入80%的乙醇溶液,置于温度为50 ℃的超声波清洗器中,超声30 min,提取2次,取上清液,测定吸光值,计算岩藻黄素得率。
1.2.3.6 提取次数对岩藻黄素得率的影响 称取10 g鼠尾藻粉,加入1.0%的L-抗坏血酸,按液料比为10 mL/g,加入80%的乙醇溶液,置于温度为50 ℃的超声波清洗器中,超声30 min,分别提取1次、2次、3次,取上清液,测定吸光值,计算岩藻黄素得率。
1.2.4 岩藻黄素响应曲面优化实验设计 根据响应面分析软件Design Expert 8.0所提供的 Box-Behnken 模型[12-13],以超声温度(A)、超声时间(B)和乙醇体积分数(C)三因素为自变量,岩藻黄素得率为响应值,设计出三因素三水平的实验。实验因素与水平的取值见表1。
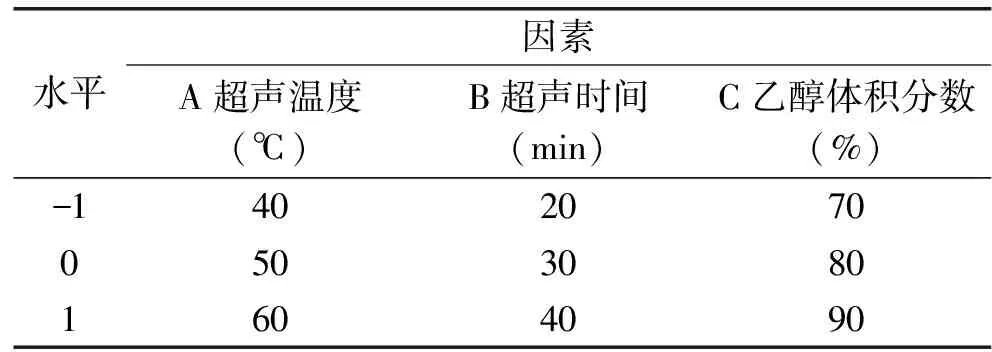
表1 响应面因素水平编码表Table 1 Factors and levers of response surface test
1.2.5 鼠尾藻岩藻黄素的纯化 将粗提液于45 ℃减压浓缩至原体积的1/5,浓缩液用三倍体积的石油醚在室温下萃取30~60 min,萃取3次,合并提取液,45 ℃减压浓缩至原体积的1/5,浓缩液用硅胶柱(16 mm×400 mm)进行纯化,以石油醚∶乙酸乙酯(7∶1、5∶1、3∶1、3∶2、1∶1、2∶3)混合溶剂为洗脱液,分别洗脱三个柱体积,洗脱速度为1 mL/min,收集分离物中金黄色液体,即鼠尾藻岩藻黄素纯化物。放入棕色瓶中,4 ℃冰箱避光保存。
1.2.6 高效液相色谱法测岩藻黄素含量 取岩藻黄素醇提液和硅胶柱分离纯化液进行HPLC色谱鉴定。色谱条件[11]:Agilent Eclipse XDB-C18色谱柱(5 μm×4.6 mm×250 mm),检测波长:450 nm,柱温:30 ℃,流动相:乙腈∶甲醇∶0.1%醋酸铵(V/V/V,75∶15∶10),流速:1 mL/min。
精确称取1 mg岩藻黄素标品,用甲醇定容至5.0 mL,配制成浓度分别为200 μg/mL的标准液。分别取0.01、0.02、0.05、0.08、0.1、0.15 mL标准液,用甲醇定容至0.4 mL,配制成浓度分别为5、10、25、40、50、75 μg/mL的岩藻黄素溶液,采用HPLC法测定岩藻黄素含量并绘制标准曲线,各浓度梯度重复测定三次,取平均值。以岩藻黄素峰面积(Y)对其浓度(X)进行线性回归,得岩藻黄素线性回归方程为Y=108.79 X+41.616(R2=0.9994),根据标准曲线计算岩藻黄素含量。
1.2.7 岩藻黄素质谱(ESI/MS)分析 将硅胶层析柱纯化后的岩藻黄素溶液上样质谱分析。采用电喷雾(ESI)质谱直接进样法,正离子检测模式,电子轰击能量70 eV,扫描范围为100~1000 m/z,柱流速1.0 μL/min,通过进样阀将样品溶液送入仪器中进行检测。
1.3 数据处理
2 结果与分析
2.1 单因素实验结果分析
2.1.1 乙醇体积分数对岩藻黄素得率的影响 由图2可知,当乙醇浓度在50%至90%之间时,岩藻黄素得率随着乙醇浓度的增大呈现出先增大后减小的过程,当乙醇浓度达到80%时,岩藻黄素得率达到了最大值。这可能是因为当乙醇浓度为80%时,岩藻黄素的极性与溶剂的极性相近,所以岩藻黄素得率较高。因此选择 80%的乙醇作为实验较佳的乙醇体积分数。
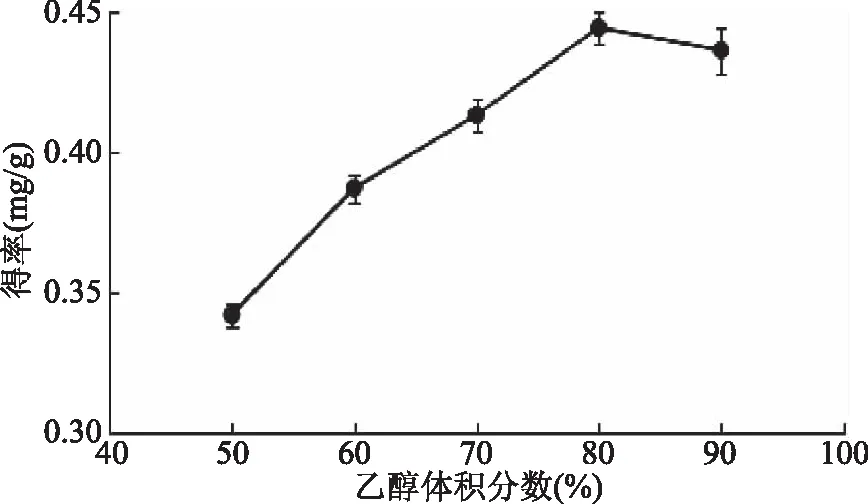
图2 乙醇体积分数对岩藻黄素得率的影响Fig.2 Effect of ethanol concentration on extraction yield of fucoxanthin
2.1.2 超声时间对岩藻黄素得率的影响 由图3可知,超声时间在10~30 min内,岩藻黄素得率随着超声时间的延长逐渐增大,当提取时间超过30 min 时得率开始逐渐下降。这可能是由于在短时间内,超声作用促进了细胞的破裂,岩藻黄素分子不断扩散与提取溶剂发生作用,提取效果显著提高,但是超过一定的时间后,一些如热效应、化学效应对岩藻黄素的破坏,导致岩藻黄素的得率下降[11]。因此选择30 min作为实验较佳提取时间。

图3 超声时间对岩藻黄素得率的影响Fig.3 Effect of ultrasound treatment time on extraction yield of fucoxanthin
2.1.3 超声起始温度对岩藻黄素得率的影响 由图4可知,岩藻黄素得率随着超声起始温度的升高先增大后减小,在达到50 ℃时,岩藻黄素得率达到最大值;在50~70 ℃时,岩藻黄素得率有所下降,这可能是刚开始随着温度的升高溶剂体系内的分子运动加剧,提高了岩藻黄素得率,但温度超过50 ℃时,由于受到超声波的机械效应和热效应,使岩藻黄素的稳定性发生改变,导致岩藻黄素得率下降[14]。因此选择50 ℃作为实验较佳温度。
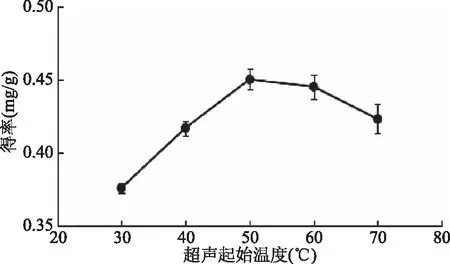
图4 超声起始温度对岩藻黄素得率的影响Fig.4 Effect of ultrasound temperature on extraction yield of fucoxanthin
2.1.4 液料比对岩藻黄素得率的影响 由图5可知,在液料比为10 mL/g之前,岩藻黄素得率随溶剂用量的增大而增大,并在10 mL/g时达到最大值,之后继续增加溶剂用量,得率上升趋势缓慢。这主要是由于料液比的增大使得岩藻黄素与有机溶剂的接触更加的充分,从而使得岩藻黄素得率升高,但是这种扩散所带来的升高是有限度的。考虑到提取成本,选择液料比为10 mL/g作为实验的较佳液料比。

图5 液料比对岩藻黄素得率的影响Fig.5 Effect of liquid/material ratio on extraction yield of fucoxanthin
2.1.5 L-抗坏血酸添加量对岩藻黄素得率的影响 由图6可知,提取的过程中加入L-抗坏血酸可以有效提高岩藻黄素得率,这主要是由于抗坏血酸的抗氧化作用可以有效保护岩藻黄素在提取过程中不被氧化,使得岩藻黄素得率得到明显地提高。综合考虑后,选择L-抗坏血酸的添加量为0.8%作为实验的较佳提取条件。
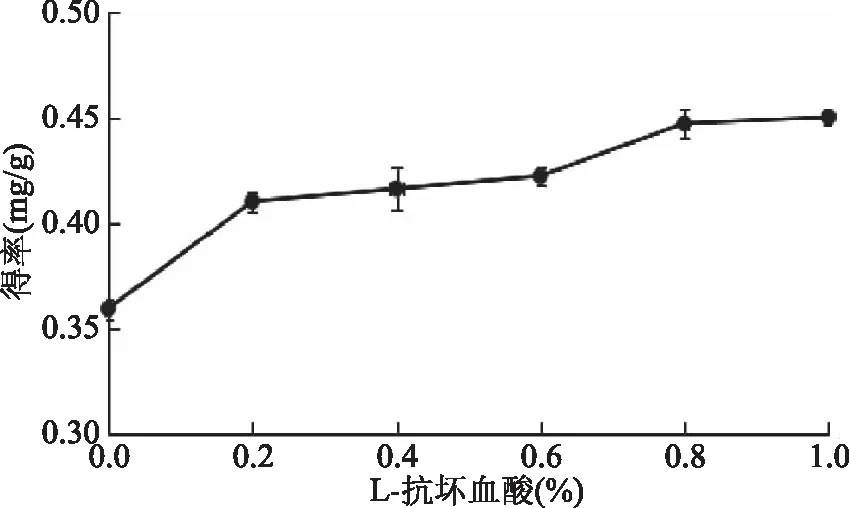
图6 L-抗坏血酸添加量对岩藻黄素得率的影响Fig.6 Effect of L-ascorbic acid concentration on extraction yield of fucoxanthin
2.1.6 提取次数对岩藻黄素得率的影响 由图7可知,经过两次提取后,已经提取出绝大部分的岩藻黄素,综合考虑成本,以及长时间提取对岩藻黄素稳定性的破坏等因素,最终选取提取2次为较佳提取次数。

图7 提取次数对岩藻黄素得率的影响Fig.7 Effect of extraction times on extraction yield of fucoxanthin
2.2 响应曲面优化实验
2.2.1 Box-Behnken实验设计与结果 在单因素实验基础上,固定液料比为10 mL/g、L-抗坏血酸0.8%,提取2次,以鼠尾藻中岩藻黄素得率为响应值,选择超声时间、超声起始温度和乙醇体积分数3个因素,做三因素三水平响应面设计,实验方案及结果见表2。

表2 响应面实验设计与结果Table 2 Response surface experimental design and results
2.2.2 模型的建立与显著性检验 应用Design Expert进行回归拟合分析,可得鼠尾藻中岩藻黄素得率的回归模型为:
岩藻黄素得率(mg/g)=0.46+0.011A+8.000×10-3B+8.750×10-4C-1.750×10-3AB-8.000×10-3AC-5.750×10-3BC-0.028A2-0.025B2-0.040C2。


表3 回归方程系数显著性检验表Table 3 Test of significance for regression equation coefficients
响应面法可以优化因素间的相互作用,并得到相应的响应曲面图进而对各因素进行分析,当图中等高线呈圆形时表示两因素交互作用不显著,而呈椭圆形或马鞍形时则表示两因素交互作用显著[15]。
图8A表示超声时间一定时,超声时间与乙醇体积分数的交互作用。由图可知,当乙醇体积分数一定时,随着超声时间的延长,岩藻黄素的得率呈现先增大后下降的趋势;当超声时间一定时,随着乙醇体积分数的增大,岩藻黄素得率呈现先增大后减小的趋势。由响应曲面图可知其曲面较陡,两者交互作用较显著。
图8B表示超声时间一定时,乙醇体积分数和超声温度的交互作用。可知,当乙醇体积分数一定时,随着超声起始温度的升高,岩藻黄素得率呈先增大后减小的趋势。当超声温度一定时,乙醇体积分数对岩藻黄素得率的影响趋势相同。由其响应曲面图中的曲面情况可知乙醇体积分数和超声温度对岩藻黄素得率的交互效应影响显著。

图8 不同交互作用对岩藻黄素提取率的影响Fig.8 Effects of different interactions on extraction yield of fucoxanthin
图8C表示乙醇体积分数一定时,超声时间和超声温度之间的交互作用。当超声温度一定时,随着超声时间的延长,岩藻黄素的得率增大,超声时间超过30 min后,其得率有所下降;当超声时间一定时,随着超声温度的提高,岩藻黄素得率呈现先增大后减小的趋势。响应曲面图中相应表现为曲线较为平滑,表明超声时间和超声温度对岩藻黄素得率的交互效应影响不显著。
2.2.3 最佳条件的确定和回归模型的验证 通过响应面法得到超声波辅助提取鼠尾藻岩藻黄素最佳工艺条件为超声温度51.96 ℃,超声时间为31.52 min,乙醇体积分数79.80%,此时岩藻黄素最大理论得率为0.462 mg/g。实际操作中确定的最佳工艺条件为超声时间32 min、乙醇体积分数80%、超声起始温度52 ℃,在此条件下进行5次平行验证实验,得到的多酚平均得率为(0.455±0.046) mg/g,与理论值0.462 mg/g非常接近,证实了该模型的有效性。
2.3 岩藻黄素高效液相色谱法分析
分别选取岩藻黄素粗提液和经过硅胶柱纯化后的岩藻黄素纯化物进行HPLC分析,结果如图9所示,可以看出粗提液色谱图中,出现了很多吸收峰,且峰型非常复杂,在7.497 min 出现的吸收峰与标准品吸收峰(7.950 min)对比,较为接近。而经过硅胶柱纯化后岩藻黄素样品液相图谱,如图9(B),与岩藻黄素标品出峰保留时间基本一致,因此可判定该物质为岩藻黄素,由此推之,粗提液中峰值保留时间为7.497 min的物质亦为岩藻黄素。按照1.2.4所述方法,通过公式计算得纯化后岩藻黄素得率为(0.048±0.002) mg/g,纯度为86.88%±1.34%(峰面积所占百分比),而纯化前的粗提液中岩藻黄素纯度仅为23.16%±2.19%(峰面积所占百分比),可知样品中岩藻黄素纯度得到显著提高,说明硅胶柱层析法适用于纯化岩藻黄素,适合于工业化大规模生产。

图9 岩藻黄素纯化前(A),纯化后(B)以及标准品(C)的HPLC图谱Fig.9 HPLC analyses of fucoxanthin before purification(A), after purification(B)and standard(C)
2.4 岩藻黄素质谱分析
图10所示为纯化后的岩藻黄素在ESI正离子模式下的质谱图。图中出现较强的离子峰697.4[M+K]+、681.4[M+Na]+和准分子离子峰659.4[M+H]+,同时还出现了相对较弱的m/z 581.4[M+H-78]+、360.3、334.3、312.4、177.1、131.1。这些均符合岩藻黄素的特征碎片离子峰,与Britton G[16]报道一致。
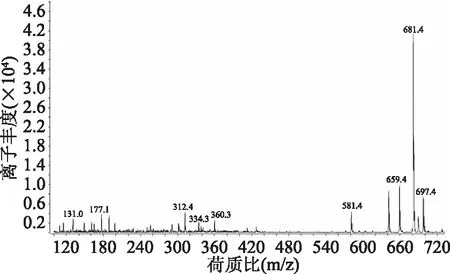
图10 纯化后岩藻黄素质谱图Fig.10 MS chromatogram of fucoxanthin after purification
3 结论
本研究首先利用超声波辅助提取鼠尾藻中的岩藻黄素,在单因素实验的基础上,通过响应曲面法优化了鼠尾藻岩藻黄素的提取工艺,建立岩藻黄素的二次多项回归模型,且拟合情况良好。实验结果表明,最佳工艺条件为:乙醇体积分数为80%(V/V),液料比为10 mL/g,L-抗坏血酸的添加量为0.8%,超声起始温度为52 ℃,超声时间为32 min,在此条件下提取2次,岩藻黄素粗品得率为(0.455±0.046) mg/g。其次,本研究利用硅胶层析柱对提取的岩藻黄素粗品进行了纯化,经HPLC和MS鉴定,纯化后岩藻黄素得率为(0.048±0.002) mg/g,纯度高达86.88%±1.34%。而目前市场上高纯度的岩藻黄素需求大、前景广阔,此工艺提取时间短、效率高、有机试剂消耗少,适合于岩藻黄素大规模工业化生产,为制备高纯度的岩藻黄素提供了新的参考依据。
[1]汪曙晖,薛长湖. 岩藻黄素的结构、性质和功能[J]. 食品工业科技,2010,31(6):408-410.
[2]徐戎,张悦,王倩,等. 昆布有效成分岩藻黄质对人体7种肿瘤细胞增殖与凋亡的影响[J]. 中药药理与临床,2009,25(4):21-24.
[3]Kenji S,Kazuhiro O,Iliyana I,et al. Effects of fucoxanthin on lipopolysaccharide-induced inflammationinvitroandinvivo[J]. Experimental Eye Research,2005,81:422-428.
[4]Hayato M,Masashi H,Tokutake S,et al. Fucoxanthin from edible seaweed,Undaria pinnatifida,shows antiobesity effect through UCP1 expression in white adipose tissues[J]. Biochemical and Biophysical Research Communications,2005,332:392-397.
[5]Matsumoto M,Hosokawa M,Matsukawa N,et al. Suppressive effects of the marine carotenoids,fucoxanthin and fucoxanthinol on triglyceride absorption in lymph duct-cannulated rats[J]. European Journal of Nutrition,2010,49:243-249.
[6]Yan X J,Chuda Y,Suzuki M,et al. Fucoxanthin as the major antioxidant in Hijikia fusiformis,a common edible seaweed[J]. Bioscience,Biotechnology and Biochemistry,1999,63(3):605-607.
[7]江茜,刘东,杨加波,等. 鼠尾藻的化学成分研究[J]. 中国药学杂志,2012,47(12):948-952.
[8]赵鹏. 海带中岩藻黄素的提取与纯化工艺研究[D]. 北京:北京化工大学,2010.
[9]秦云,孟丽媛,王凤舞. 复合酶法提取海带岩藻黄素及其抗氧化活性分析[J]. 食品科学,2013,34(16):279-283.
[10]闫相勇,刘翼翔,吴永沛,等. 海带岩藻黄素的提取及纯化工艺研究[J]. 中国食品学报,2014,14(3):115-121.
[11]惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京﹕中国轻工业出版社,2005﹕68-322.
[12]尹尚军,徐涛,刘丽平,等. 羊栖菜岩藻黄质的提取工艺研究[J]. 食品工业科技,2011,32(4)﹕272-275.
[13]费荣昌. 实验设计与数据处理第四版[M]. 上海:华东师范大学出版社,2001:59-63.
[14]王银羽. 鼠尾藻中岩藻黄质的提取工艺优化及降血脂作用的研究[D]. 杭州:浙江工业大学,2015.
[15]Box G E P,Hunter W G. Statistics for experiments:an introduction to design,data analysis and model building[M]. New York:Wiley,1990.
[16]Britton G,Liaaen-Jensen S,Pfander H,et al. Carotenoids[M]. Basel:Birkllauser Verlag,1995.
