羊肉部分下脚料发酵工艺条件的优化
2018-05-01秦选吉梁肖娜穆易君
秦选吉,梁肖娜,穆易君,陈 洋,刘 崑,*
(1.锦州医科大学食品科学与工程学院,辽宁锦州 121001;2.沈阳农业大学食品学院,辽宁沈阳 110866)
羊肉是绿色蛋白的重要来源,倍受消费者的喜爱[1]。我国是羊肉消费大国[2],羊肉加工过程中可产生大量的羊肉下脚料如羊血、羊骨、羊皮、羊内脏等[3]。经研究,羊肉下脚料中含有人类所需要的营养物质,如羊骨中含有丰富的钾、钙、钠、铁等微量矿物质元素以及大量的胶原蛋白、氨基酸、多糖等生物活性物质[4],羊血中含有18%左右的蛋白质等[5]。
羊下脚料的应用主要在饲料、林化工业,而对于肥料等方面的研究较少。现今我国对羊肉下脚料的认识与利用还不完善,大量资源被浪费,并且造成环境污染。
本实验以羊肉下脚料为原料,利用优势菌株X3枯草芽孢杆菌(Bacillussubtilis)、X17蜡样芽孢杆菌(Bacilluscereus)、M5为青霉菌属(Penicilliumcitreonigrum)、M9米曲霉(Aspergillusoryzae)发酵羊肉部分下脚料,并应用响应面法优化发酵条件,为羊肉下脚料的发酵应用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
羊肉部分下脚料(血、肠,肺,剔骨碎肉) 沈阳市二台子屠宰场提供;X3枯草芽孢杆菌、X17蜡样芽孢杆菌、M5青霉菌属 锦州医科大学实验室从羊肉部分下脚料中分离筛选;M9米曲霉(商用菌种) 山东长泰生物科技有限公司;定氮合金 天津盛鑫源化工公司;浓盐酸、浓硫酸 沈阳一化玻试剂有限公司。
TDL-5-A型离心机 上海安亭科学仪器厂;ZHJH-1112型垂直流超净工作台 上海智城仪器有限公司;HZQ-F160A型恒温振荡培养箱 上海一恒科技有限公司;A800绞肉机 杭州九阳股份有限公司;ATN-500全自动凯氏定氮仪 上海庚庚仪器设备有限公司。
1.2 实验方法
1.2.1 羊肉部分下脚料单株发酵效果测定 取新鲜羊肉部分下脚料,洗净,用绞肉机搅成泥状。称5 g样品按1∶10料水比,加入到250 mL锥形瓶中,121 ℃下灭菌20 min,无菌条件下将四株菌株种子液按10%的接种量分别接入四份样品中,在温度30 ℃、pH=7、转速160 r/min培养7 d,结束后将发酵液在5000 r/min离心15 min,测发酵液中的总氮含量,每组实验重复三次。以不接菌株为空白对照组(CK)。
1.2.2 羊肉部分下脚料混合菌株发酵效果测定 无菌条件将四株菌株种子液按等比混合,菌株混合组合如表1所示[6],操作方法同上述1.2.1。

表1 菌株等比混合组合Table 1 Strain combination
1.2.3 羊肉部分下脚料单因素发酵实验 称5 g样品按1∶10料水比,加入到250 mL锥形瓶中,于121 ℃下灭菌20 min,灭菌后在无菌条件下分别将以上优化的混合菌株接种到羊肉下脚料中,以温度32 ℃、pH=6、接种量10%、转速160 r/min为固定水平,考察各因素对下脚料中总氮含量的影响。各因素水平为温度28、30、32、34、36 ℃,pH=4、5、6、7、8,接种量1%、5%、10%、15%、20%,转速100、120、140、160、180 r/min,培养7 d后取出,发酵结束后将发酵液在5000 r/min离心15 min,测下脚料中总氮含量,每组实验重复三次[7]。
1.2.4 响应面法优化发酵羊肉部分下脚料实验 对发酵影响较大的温度、pH、接种量、转速进行优化,采用中心组合设计法,研究四个因素对发酵效果的影响,因素水平编码见表2。
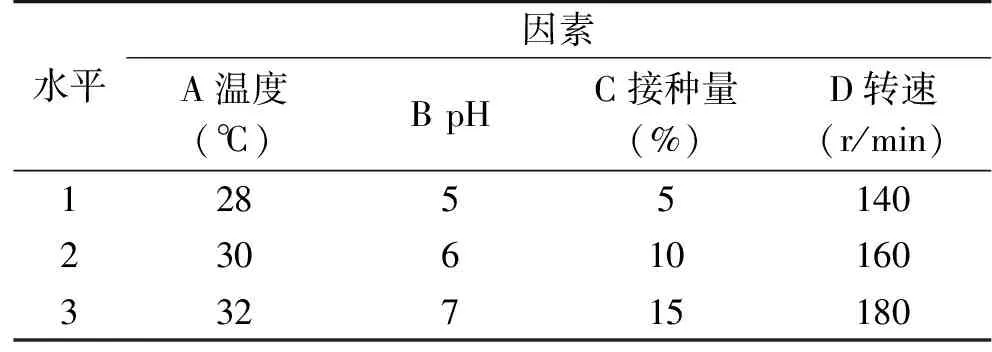
表2 Box Behnken实验设计因素水平表Table 2 Factors and levels table of Box Behnken test
1.2.5 发酵后羊肉部分下脚料中总氮、磷、钾含量测定 称样品0.1000~0.2000 g至250 mL蒸馏管中,加35 mL的蒸馏水使样品溶解,再加1.0 g定氮合金、7 mL浓盐酸到消化装置中,加热至150 ℃,取下消煮管冷却到室温后,加10 mL浓硫酸,继续加热到480 ℃消化,待消煮管中呈现蓝色时,取下消煮管冷却至室温,测氮含量[8]。磷、钾含量测定参照章和珍等[9]、王治泽等[10]文献中测定方法。
1.3 数据处理
以上实验数据均进行3次平行测定,实验结果以平均值±标准偏差表示,采用Excel、SPSS 17.0和Design-expert 8.0.6软件对数据进行分析。
2 结果与分析
2.1 羊肉下部分脚料单株和混合菌株发酵效果
如图1、图2,与空白对照相比,单菌株和混合菌株发酵羊肉部分下脚料的效果均有显著提高(p<0.05),其中单菌株X3和X17产生的总氮含量约是空白的1.5倍,混合组合7的混合菌株发酵后产生的总氮含量是空白的2.5倍,极显著高于空白组(p<0.01),且产生的总氮含量均高于其他6组菌株组合且混合菌株条件下总氮含量高于单菌株,比较分析,确定组合7的混合菌株为发酵羊肉部分下脚料的最优组合,即X3、X17、M5和M9以1∶1∶1∶1比例混合的混合菌株。
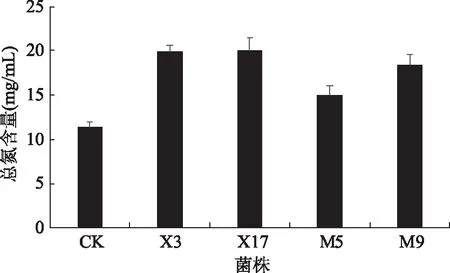
图1 单菌株发酵液总氮含量的影响Fig.1 Effect of single strain fermentation on total nitrogen content
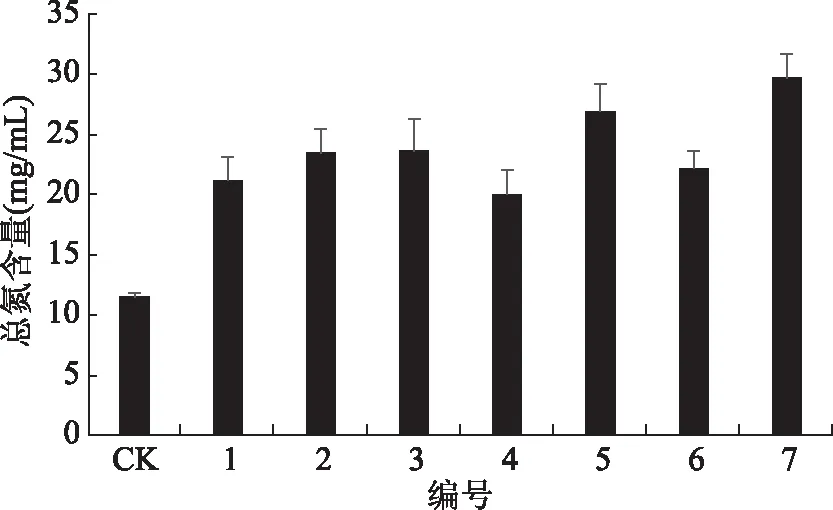
图2 混合菌株发酵液总氮含量的影响Fig.2 Effect of mixed strain fermentation on total nitrogen content
2.2 羊肉部分下脚料单因素发酵实验
2.2.1 温度对羊肉部分下脚料发酵液总氮含量的影响 温度是影响微生物发酵的重要因素,当生长温度适中时,微生物生长迅速,酶类物质代谢较快[11],如图3发酵液温度升到30 ℃时,总氮含量迅速增加至最大值,约为31.04 mg/mL,温度继续增加,总氮含量递减,可能随温度的升高,微生物活动能力下降甚至丧失,因此发酵的最佳温度为30 ℃。

图3 温度对羊肉部分下脚料发酵液总氮含量的影响Fig.3 Effect of temperature on the fermentation fluid total nitrogen content of mutton offal
2.2.2 pH对羊肉部分下脚料发酵液总氮含量的影响 微生物在适宜的pH才正常生存,促进微生物的活动,反之将阻碍代谢。如图4发酵液中总氮含量随pH增大而增大,pH为6时,总氮含量达到最高值约为27.93 mg/mL,之后随pH增大,总氮含量降低,可能pH为6时,是混合菌株的最适生长pH,代谢较旺盛,产生的总氮含量最高,因此pH=6为最佳。
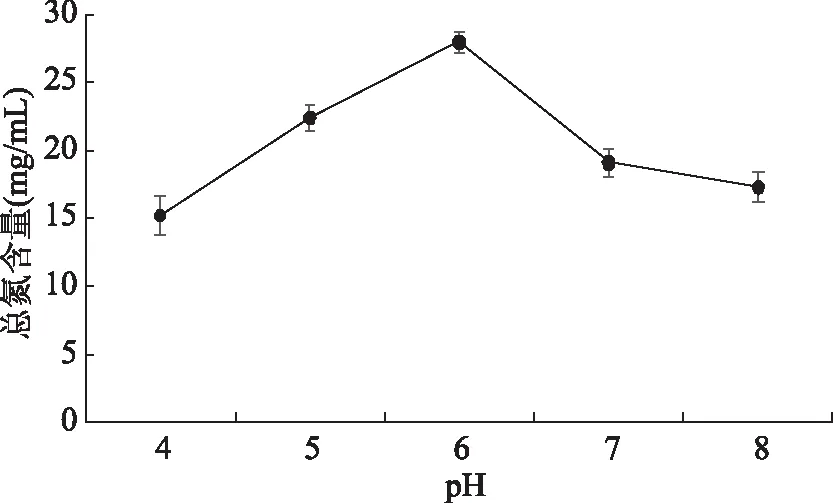
图4 pH对羊肉部分下脚料发酵液总氮含量的影响Fig.4 Effect of pH on the fermentation fluid total nitrogen content of mutton offal
2.2.3 接种量对羊肉部分下脚料发酵液总氮含量的影响 图5随接种量增加,总氮含量上升,当接种量为10%时总氮含量达到最大。随接种量继续加大,总氮含量降低。原因可能是适合的接种量可促使微生物从底料中获得营养来维持生长代谢,但接种少时,微生物的数量少发酵效果不好,相反较大时,底料中营养不能满足微生物生长代谢,因此最佳接种量为10%。
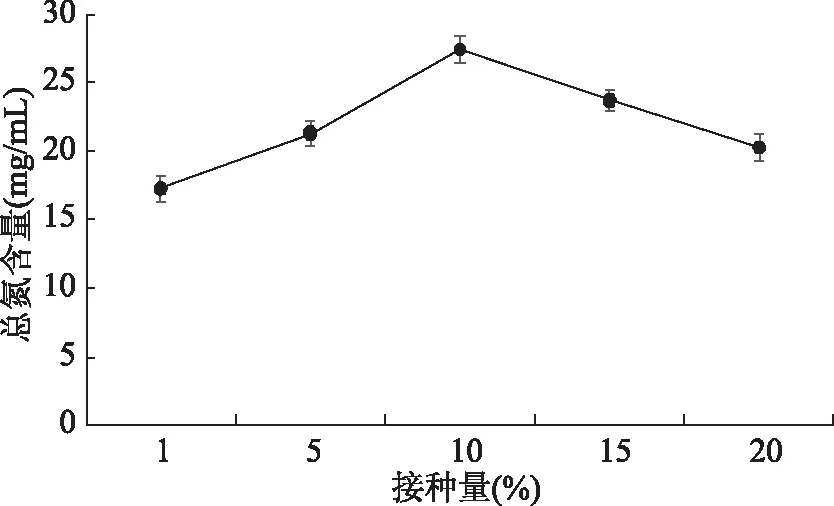
图5 接种量对羊肉部分下脚料发酵液总氮含量的影响Fig.5 Effect of inoculum on the fermentation fluid total nitrogen content of mutton offal
2.2.4 转速对羊肉下部分脚料发酵液总氮含量的影响 转速影响微生物供氧量的需求。图6中随转速的增大,总氮含量不断增加,当转速160 r/min时,含量最高约为29.27 mg/mL,可能是转速增加,发酵液流体程度加大,气相间的传质和液相间的传质过程加快,供氧量增多,微生物活动增强发酵效果较好[12],但转速继续上升,总氮含量下降,因此适合的转速为160 r/min。
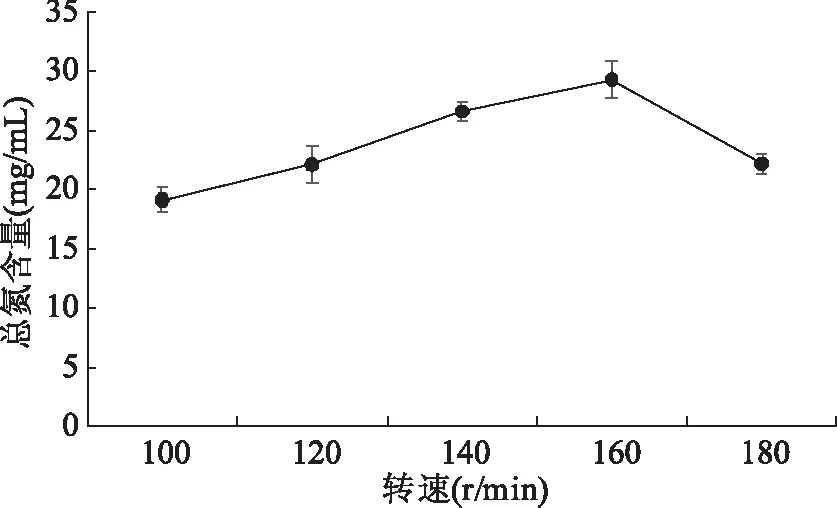
图6 转速对羊肉部分下脚料发酵液总氮含量的影响Fig.6 Effect of speed on the fermentation fluid total nitrogen content of mutton offal
2.3 响应面法优化发酵羊肉部分下脚料发酵工艺
2.3.1 响应面优化发酵羊肉部分下脚料实验设计结果及方差分析 通过单因素实验选择对羊肉部分下脚料发酵效果影响明显的因素(温度、pH、接种量、转速)进行响应面设计,响应面设计及结果表3所示。利用Design Expert 8.0.6对表3中的响应值进行回归拟合多重分析比较,考察各因素水平对发酵的效果影响,得到如下回归方程:Y=34.86+2.40A-1.80B+2.54C-0.45D-3.11AB-5.31AC-2.92AD+7.33BC+1.11BD-1.41CD-7.06A2-7.24B2-5.19C2-14.66D2。
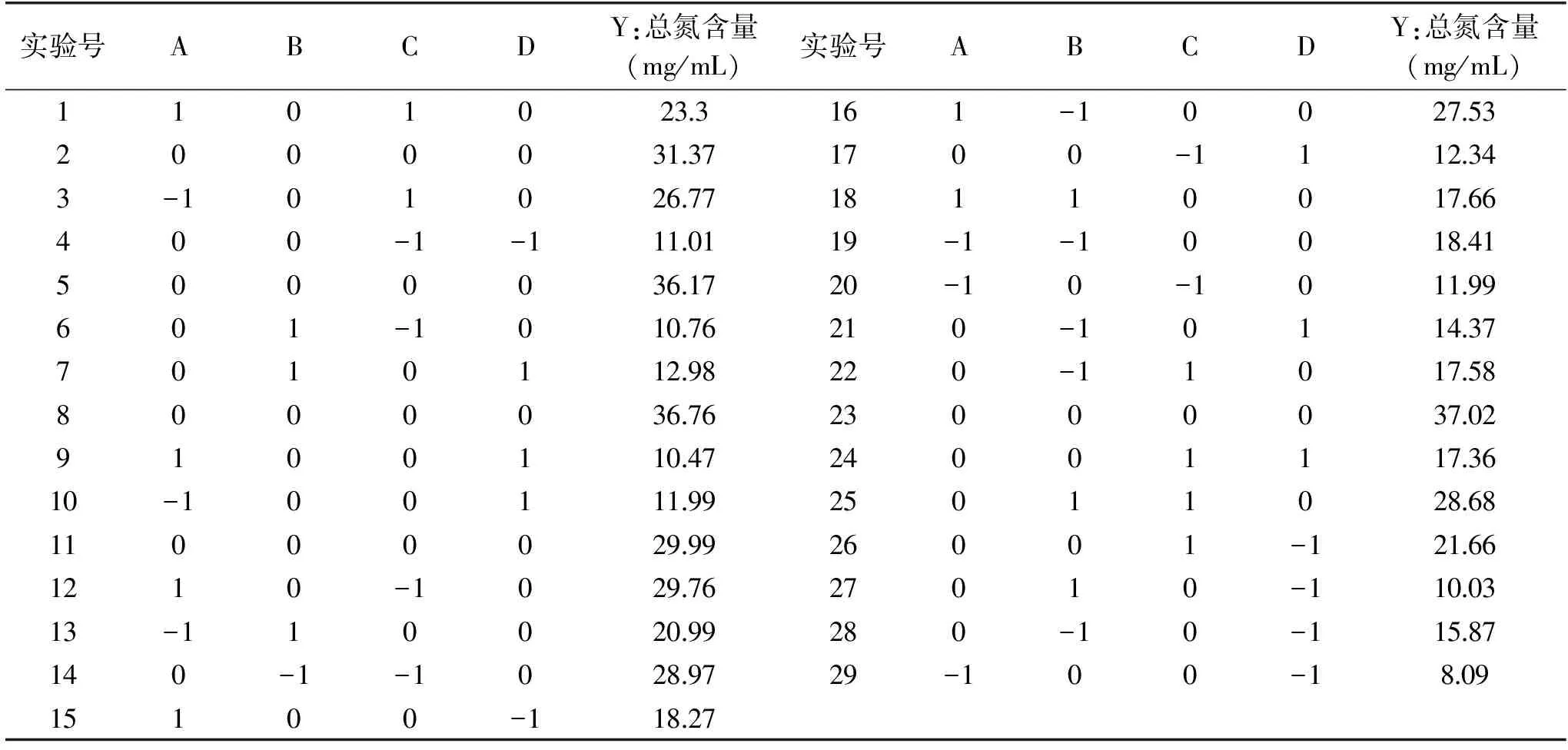
表3 响应面实验设计及结果Table 3 Design and results of response surface analysis test
由表4可知,模型p<0.0001,模型项达到极显著水平,说明模型可靠;失拟项p=0.9734>0.05,说明失拟项不显著;一次项A、C,交互项AB、BC和二次项A2、D2达到极显著水平(p<0.0001);一次项B,交互项AD达到显著水平(p<0.05);下脚料中总氮含量的影响顺序依次为:接种量>温度>pH>转速,即接种量对于总氮含量的影响较为显著。
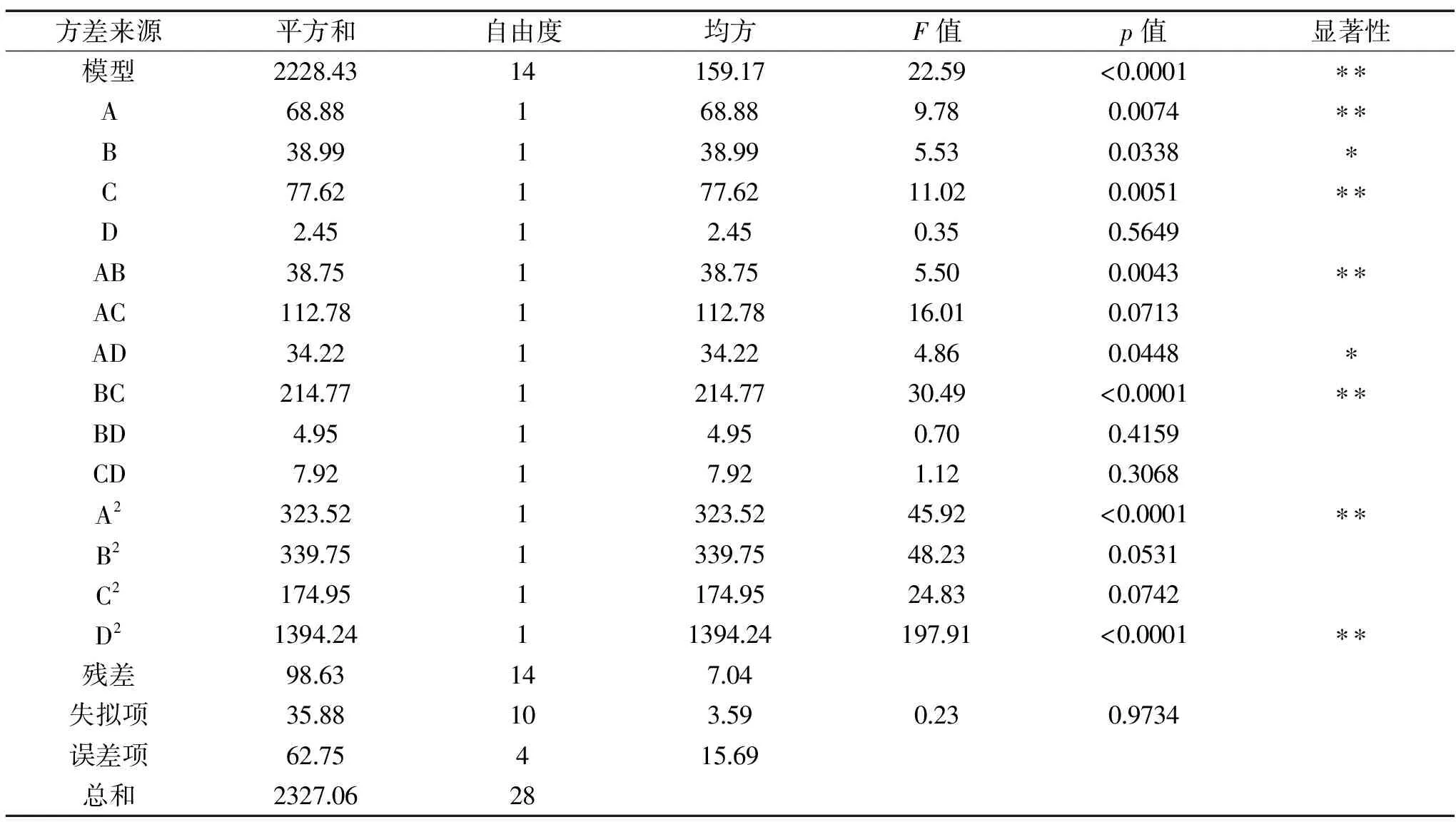
表4 方差分析表Table 4 Variance analysis of regression equation
2.3.2 响应面各因素交互作用分析 如图7所示,温度和pH之间交互作用对总氮含量影响极显著,同时响应曲面形成的最高点是等高线图中心点;而图8中,温度和接种量的曲面变化幅度小,说明两因素的交互作用对总氮含量的影响不大,与表4中回归拟合方差分析一致;图9中,曲面坡度较陡,等高线呈椭圆,温度与转速的交互作用对总氮含量影响显著;图10 中,pH和接种量的响应曲面变化幅度较大,pH和接种量对总氮含量的影响极显著(p<0.001);图11中,pH和转速曲面变化不大,对总氮含量影响小,作用不显著;图12中,接种量与转速两因素对总氮含量的交互作用不显著,但接种量对总氮含量的影响略高于转速。
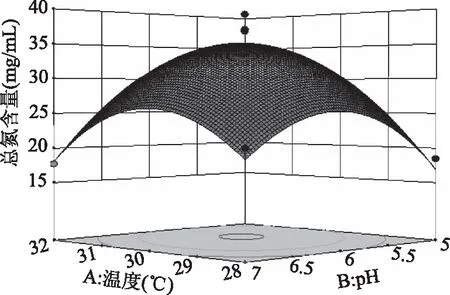
图7 温度和pH对总氮含量的响应曲面图Fig.7 Response surface of temperature and pH on total nitrogen content
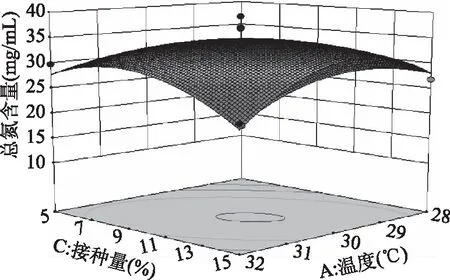
图8 温度和接种量对总氮含量的响应曲面图Fig.8 Response surface of temperature and inoculum on total nitrogen content

图9 温度和转速对总氮含量的响应曲面图Fig.9 Response surface of temperature and speed on total nitrogen content
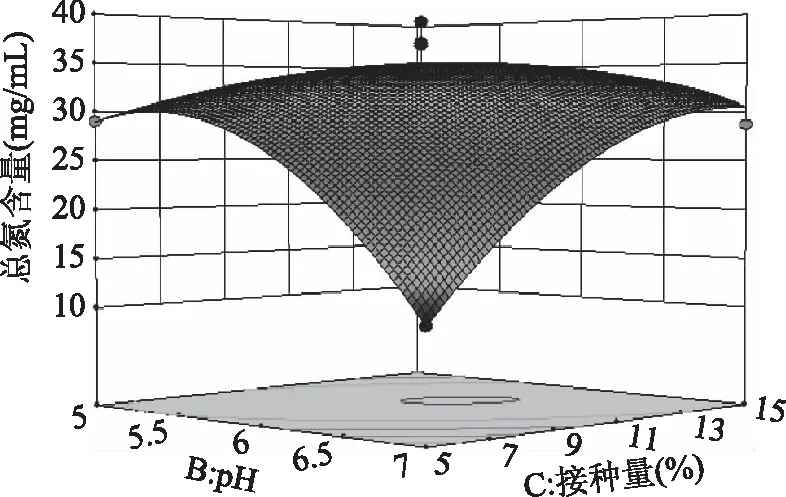
图10 pH和接种量对总氮含量的响应曲面图Fig.10 Response surface of pH and inoculum ontotal nitrogen content
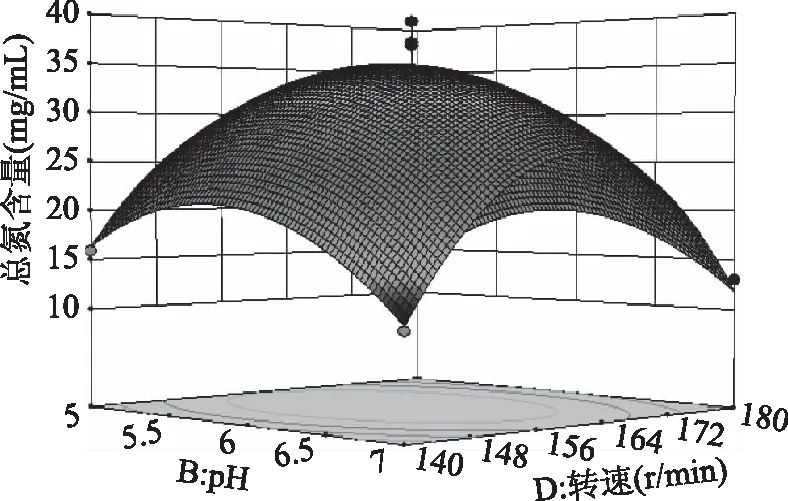
图11 pH和转速对总氮含量的响应曲面图Fig.11 Response surface of pH and speed on total nitrogen content
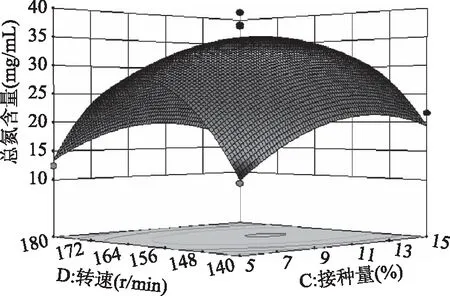
图12 接种量和转速对总氮含量的响应曲面图Fig.12 Response surface of inoculum and speed on total nitrogen content
2.3.3 模型验证 数据分析采用Design Expert 8.0.6软件,根据Box Benhnken(BBD)和二次回归方程分析,得到羊肉部分下脚料发酵工艺的最佳条件为:温度30.4 ℃,pH=5.86,接种量10.06%,转速160 r/min,此优化条件下得到理论值为37.84 mg/mL。考虑实验设备的精准性,确定最佳条件为:温度30 ℃,pH=6.0,总接种量10%,转速160 r/min。在此条件下进行三次重复实验,最终得到实际平均值为37.16 mg/mL,与理论值接近,可说明该模型下的羊肉部分下脚料发酵最佳工艺条件具有实际可操作性。
2.4 发酵羊肉部分下脚料理化指标测定
为检验发酵后羊肉部分下脚料在肥料方面的价值,测得在最佳发酵条件下的发酵羊肉中的氮、磷、钾含量分别为(37.16±1.78)、(12.4±0.06)、(11.7±0.08) mg/mL,即总养分(N+P2O5+K2O)含量为6.126%,符合国家规定的复合肥料的总养分含量(NYT 798-2015)[15]。
3 结论
本实验以羊肉部分下脚料为原料,利用优良菌株发酵,进行单菌株和混合菌株实验,得到混合菌株组合7效果最好,采用响应面法优化羊肉部分下脚料发酵条件进行优化,得到温度、pH、接种量和转速的回归模型,并对方程求解,得到羊肉部分下脚料发酵最优条件为温度30 ℃,pH=6.0,接种量10%,转速160 r/min,在优化条件下重复三次实验后得到的总氮含量约为37.16 mg/mL。其发酵的最佳条件将会对羊肉等畜产品的综合利用提供一定的理论参考。
[1]张进,王卫,郭秀兰,等. 羊肉制品加工技术研究进展[J]. 肉类研究,2011(11):50-54.
[2]王贝贝,肖海峰. 中国羊肉供需状况及展望[J]. 农业展望,2012,8(10):19-22.
[3]王百姓. 我国羊肉生产与加工利用综述[J]. 肉类研究,2005(1):39-44.
[4]王芳,徐桂花,田建文. 羊肉部分下脚料的利用与开发[J]. 食品工业科技,2009(11):347-348,352.
[5]王芳,田建文. 羊肉部分下脚料的利用[J]. 肉类工业,2010(5):5-7.
[6]张宇. 羊肝蛋白提取工艺的优化及其抗氧化性研究[D]. 呼和浩特:内蒙古农业大学,2014.
[7]郑灿龙. 羊肉的营养价值及其品质的影响因素[J]. 肉类研究,2003(1):47-48.
[8]闵良,姚文华,徐国良,等. 全自动凯氏定氮仪测定复合肥料中的总氮含量[J]. 湖北农业科学,2012,51(1):175-176,
201.
[9]章和珍,张保根,万美兰. 复混肥中氮、磷、钾的简易测定法[J]. 江西农业科技,1996(4):21-22.
[10]王治泽,魏珑. 复混(复合)肥料中氮、磷、钾含量测定标准解读[J]. 山东化工,2016,45(8):56-57,60.
[11]陈倩倩,刘波,王阶平,等. 微生物发酵床猪舍不同发酵等级垫料中大肠杆菌的分离鉴定[J]. 中国畜牧兽医,2017(1):268-274.
[12]李增胜,张庆,徐世艾. 搅拌和溶氧对黄原胶发酵的影响[J]. 食品科学,2009,30(17):253-257.
[13]Bester M,Schönfeldt H C,Pretorius B,et al. The nutrient content of selected South African lamb and mutton organ meats(offal)[J]. Food Chemistry,2018,238:3.
[14]Russell J B,O’Connor J D,Fox D G,et al. A net carbohydrate and protein system for evaluating cattle diets:I. Ruminal fermentation[J]. Journal of Animal Science,1992,70(11),3551.
[15]中华人民共和国农业部. NY/T798-2015复合微生物肥料[S].北京:中国农业出版社,2015.
