平阴玫瑰花托多糖的结构特征及抗氧化活性分析
2018-05-01马耀宏马润隆杨俊慧刘庆艾庄晓凤王业强
马耀宏,马润隆,郑 岚,*,杨 艳,杨俊慧,蔡 雷,刘庆艾,庄晓凤,王业强
(1.齐鲁工业大学(山东省科学院),山东省科学院生物研究所, 山东省生物传感器重点实验室,山东济南 250103; 2.山东师范大学附属中学,山东济南 250014)
平阴县是我国著名的“玫瑰之乡”,因花色艳丽、瓣多而厚、香气浓郁,而享誉世界[1-3]。目前,平阴玫瑰花产品不仅包括传统的玫瑰干花瓣、玫瑰茶、玫瑰花酱、玫瑰馅料、玫瑰糖等初加工产品,先后开发了玫瑰精油、玫瑰细胞液、玫瑰超微粉、玫瑰保健品、玫瑰化妆品等多种精深加工产品[4]。随着平阴玫瑰产业的发展壮大,玫瑰种植面积已达5万亩,年产鲜花8000余t[5]。由于玫瑰花瓣是制作玫瑰食品、玫瑰细胞液、玫瑰超微粉等多种玫瑰产品的原材料,所以新鲜玫瑰花采摘后首先需要进行花瓣分选环节[6],从而产生了大量玫瑰花托废弃物,造成了玫瑰花资源的极大浪费。玫瑰花是深受消费者青睐的食药用珍惜资源,如何有效的利用玫瑰花托是玫瑰产业急需解决的问题。
玫瑰花具有理气、活血、美容养颜、收敛等作用,主治月经不调、跌打损伤、肝气胃痛、乳臃肿痛等症[7-9]。多糖是食品、医学界公认的生理活性物质,具有特定的保健功效[10],玫瑰花的主要功效成分是玫瑰花多糖[11-12],近年来对于玫瑰花多糖的提取工艺及其结构、活性已经进行了初步探索,但是对于玫瑰花托的研究还未见报道。本研究分别提取纯化玫瑰花瓣及花托多糖,将其结构特征和抗氧化活性进行对比分析,从而为玫瑰花托提供新的研发角度和研发依据,这对于平阴玫瑰资源的综合利用以及玫瑰产业链的延长具有重要意义。
1 材料与方法
1.1 材料与仪器
平阴玫瑰花 由济南惠农玫瑰花精油有限公司提供;乙腈(色谱纯) 美国Fisher公司;标准单糖(葡萄糖、甘露糖、鼠李唐、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖)、1-苯基-3-甲基-5-吡唑啉酮(PMP) 美国Sigma公司;溴化钾碎晶 美国Thermo公司;DEAE-52纤维素 英国whatman公司;其余试剂 均为国产分析纯试剂。
LE204E型电子天平 特勒-托利多(Mettler Toledo)公司;JP-800C-6型中药粉碎机 永康市久品工贸有限公司;SBS型数控记滴自动部分收集器、DHL-A型电脑数显恒流泵 上海沪西仪器厂有限公司;冻干机 沈阳航天速冻设备制造有限公司;Spectra MR型酶标仪 美国Dynex公司;Agilent1260型高效液相色谱仪 安捷伦科技有限公司(Agilent Technologies);Waters Symmetry C18色谱柱(4.6 mm×250 mm,5 μm) 美国沃特斯公司;Thermo-Nicolet 6700型傅里叶变换红外光谱仪 美国赛默飞世尔科技有限公司(Thermo Scientific)。
1.2 实验方法
1.2.1 玫瑰花瓣及花托多糖的提取 将玫瑰的花瓣和花托分离,分别置于55 ℃烘箱中烘干,于中药粉碎机中进行粉碎,并过80目筛。分别取玫瑰花瓣、花托粉末,将其与去离子水以1∶20比例混合,超声波破碎(超声功率为300 W,超声时间为15 min),然后置于90 ℃水浴中2 h,离心(15000 r/min,10 min,4 ℃)取上清液[13]。按上述步骤提取3次,合并上清液。将玫瑰多糖提取液减压浓缩至合适浓度,加入两倍体积95%乙醇,静置过夜,离心(15000 r/min,10 min,4 ℃),沉淀于55 ℃烘箱中烘干,并粉碎,获得玫瑰花瓣及花托粗多糖。
1.2.2 玫瑰花瓣及花托多糖的纯化
1.2.2.1 除色素 将粗多糖溶于适量去离子水中,按1%(m/v)比例加入活性炭,搅拌60 min,离心(14000 r/min,15 min)取上清液。
1.2.2.2 除蛋白 采用Sevag法除蛋白,按4∶1的体积加入Sevag试剂(氯仿∶正丁醇=5∶1,v/v),充分振摇15 min,离心(8000 r/min,10 min),除去有机相及有机相与水相交界处的白色乳化层。如此重复10次,至乳化层消失为止,冻干待用,并分别命名为玫瑰花瓣多糖(RRP)及玫瑰花托多糖(RRR)。RRP或RRR的得率(%)=RRP或RRR的质量(g)/花瓣或花托粉末的质量(g)×100。
1.2.2.3 DEAE-52纤维素阴离子交换柱层析 将去蛋白后的RRP及RRR溶于适量去离子水中,用0.45 μm的微孔滤膜过滤,加5 mL样品溶液于DEAE-52纤维素阴离子交换柱(2.6 cm×30 cm)中,用去离子水和0.05、0.1、0.3 mol/L的NaCl溶液进行洗脱,洗脱液的流速为1 mL/min。用全自动部分收集器收集洗脱液(2 mL/管),用苯酚-硫酸法逐管检测,以管数为横坐标,吸光度(A490 nm)为纵坐标绘制洗脱曲线。并将各洗脱组分冻干待用。组分的得率(%)=组分的质量(g)/RRP或RRR的质量(g)×100。
1.2.2.4 纯度鉴定 用酶标仪对200~400 nm波段进行扫描,观察280 nm处有无吸收峰来检测蛋白是否去除干净。
1.2.3 傅立叶红外光谱(FT-IR)分析 取干燥的多糖样品与KBr一起研磨均匀,用压片模具制成透明薄片,用傅里叶变换红外光谱仪进行红外光谱测定,扫描范围:4000~400 cm-1,分辨率:4 cm-1。
1.2.4 单糖组成分析 采用柱前衍生高效液相色谱法(HPLC)分析RRP、RRR及其组分的单糖组成。
1.2.4.1 多糖的水解 准确称取待测样品0.05 g于试管中,加入10 mL H2SO4(1 mol/L),封口并置于沸水浴中水解8 h。水解结束后,将水解液离心(10000 r/min,10 min,4 ℃),取上清液4.5 mL用NaOH(2 mol/L)中和至pH为7,并定容至10 mL,离心(10000 r/min,10 min,4 ℃)后取上清液待衍生化。
1.2.4.2 多糖的衍生化 分别取50 μL待测样品及7种单糖(甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖)的混合标准品溶液(2 mmol/L)与50 μL 1-苯基-3-甲基-5-吡唑啉酮(PMP)甲醇溶液(0.5 mol/L)及50 μL NaOH(0.3 mol/L)混合均匀,将混合液置于恒温水浴锅中70 ℃反应30 min,冷却至室温后,加入50 μL HCl(0.3 mol/L)进行中和并加入100 μL高纯水进行稀释。混匀后向混合液中加入900 μL氯仿,涡旋混匀30 s随后静置5 min,吸取下层液弃去。重复操作3次,即得衍生化的样品。每个样品做3个平行实验,用0.45 μm的微孔滤膜过滤,随后进行高效液相色谱分析。
1.2.4.3 高效液相色谱条件 流动相:醋酸铵缓冲溶液(pH5.5)-乙腈(77∶23,v/v);柱温:25 ℃;流速:1 mL/min;检测波长:245 nm;进样量:20 μL。
1.2.5 体外抗氧化活性测定
1.2.5.1 羟基自由基清除能力 采用Fenton法进行羟基自由基清除能力的测定。将1 mL硫酸亚铁溶液(9 mmol/L),1 mL水杨酸乙醇溶液(9 mmol/L),1 mL多糖样品溶液和1 mL过氧化氢溶液(8.8 mmol/L)于试管中混合均匀,37 ℃水浴30 min。离心(5000 r/min,10 min)后取上清液于510 nm处测定吸光度,并用BHT作为阳性对照。按照以下公式计算羟基自由基清除率(Scavenging rate,SR),SR(%)=(A0-A)/A0×100。其中,A0是去离子水+过氧化氢的吸光度,A是样品+过氧化氢的吸光度。
1.2.5.2 DPPH自由基清除能力 取2 mL多糖样品溶液于试管中,加入2 mL DPPH乙醇溶液(0.2 mmol/L),混合均匀后避光反应30 min,然后在517 nm处测定其吸光度,用BHT作为为阳性对照。清除能力SR(%)=[1-(A-A0)/A1]×100。其中,A为2 mL样品溶液与2 mL DPPH乙醇溶液混合液的吸光度,A0为2 mL乙醇与2 mL样品溶液混合液的吸光度,A1为2 mL去离子水与2 mL DPPH乙醇溶液混合液的吸光度。
1.3 数据处理
实验数据采用Excel软件作图并进行数据统计分析,p<0.05为差异显著标准。所有实验均重复3次。
2 结果与分析
2.1 苯酚-硫酸法标准曲线
苯酚-硫酸法的标准曲线见图1。

图1 苯酚-硫酸法标准曲线Fig.1 Standard curve of phenol-sulfuric acid method
由图1可见,苯酚硫酸法标准曲线的回归方程为y=0.0085x-0.0055,R2=0.9993。玫瑰花瓣和玫瑰花托粉末中RRP和RRR的得率分别为3.22%和3.78%。RRP和RRR的多糖含量分别为94.12%和93.75%。
2.2 洗脱曲线
RRP和RRR的DEAE-52纤维素阴离子交换柱洗脱曲线见图2、图3。

图2 RRP的DEAE-52纤维素离子交换柱洗脱曲线Fig.2 Elution curve of RRP on DEAE-52 cellulose column

图3 RRR的DEAE-52纤维素离子交换柱洗脱曲线Fig.3 Elution curve of RRR on DEAE-52 cellulose column
由图2、图3可见,RRR、RRP的DEAE-52纤维素阴离子交换柱洗脱曲线较为相似,分别可以获得三个组分,这3个组分命名为RRP-1、RRP-2、RRP-3和RRR-1、RRR-2、RRR-3,由去离子水、0.05 mol/L NaCl、0.1 mol/L NaCl洗脱获得。RRP-1、RRP-2和RRP-3的得率分别为38.67%、29.03%、22.16%,RRR-1、RRR-2和RRR-3的得率分别为36.69%、24.48%、23.12%。
2.3 紫外扫描光谱
RRP及其组分(RRP-1,RRP-2和RRP-3)、RRR及其组分(RRR-1,RRR-2和RRR-3)的紫外扫描光谱见图4。

图4 紫外扫描曲线Fig.4 UV scanning spectrum注:A:RRP及其组分;B:RRR及其组分。
由图4可见,RRP及其组分(RRP-1、RRP-2和RRP-3)和RRR及其组分(RRR-1、RRR-2和RRR-3)在280 nm处没有吸收峰,说明蛋白质已经去除干净。
2.4 FT-IR测定结果
RRP及其组分(RRP-1、RRP-2、RRP-3)、RRR及其组分(RRR-1、RRR-2、RRR-3)的FT-IR光谱图见图5和图6。

图5 FT-IR光谱图Fig.5 FT-IR spectrum 注:A:RRP;B:RRP-1;C:RRP-2;D:RRP-3。

图6 FT-IR光谱图Fig.6 FT-IR spectrum注:A:RRR;B:RRR-1;C:RRR-2;D:RRR-3。
由图5和图6可见,RRP、RRR及其组分具有多糖的一般特征峰。在3500~3000 cm-1处的强宽吸收峰为O-H键伸缩振动形成。2900 cm-1附近处的吸收峰为C-H键伸缩振动峰。1735 cm-1附近出现的吸收峰是-COOH的C=O伸缩振动,可以说明糖醛酸的存在。在1616 cm-1处的吸收峰表明有C=O的伸缩振动。1400~1200 cm-1处出现的吸收峰表明有C-H边角振动。在1200~1000 cm-1处的吸收峰是由糖环振动,C-OH侧基的伸缩振动,C-O-C糖苷键振动相叠加所致。1100 cm-1处的吸收峰是C-O键伸缩振动形成的。FT-IR可以确定糖苷键的构型,糖α-和β-的端基差向异构体是由端基的C-H变角振动造成的,在吡喃糖苷键的构型中,α-型异构体C-H为平伏键,在(844±8) cm-1处有特征吸收峰,而β-型异构体C-H为直立键,在(891±7) cm-1处有特征吸收峰。另外,吡喃糖在1020~1180 cm-1处出现三个吸收峰,而呋喃糖在同一区域只出现两个吸收峰。因此,RRP的构型主要为呋喃糖;RRP-1的构型为呋喃糖;RRP-2的构型为α-糖苷键连接的吡喃糖;RRP-3的构型为α-糖苷键连接的吡喃糖;RRR的构型主要为呋喃糖;RRR-1的构型为呋喃糖;RRR-2的构型为呋喃糖;RRR-3的构型为α-糖苷键连接的吡喃糖。RRP和RRR可以观察到1735 cm-1左右的糖醛酸特征峰。
由此可见,RRR和RRP、RRR-1和RRP-1、RRR-3和RRP-3有着相同的构型,但是RRR-2和RRP-2的构型不同。
2.5 单糖组成
RRP及其组分(RRP-1,RRP-2、RRP-3)、RRR及其组分(RRR-1、RRR-2、RRR-3)的单糖组成见表1。

表1 单糖组成的摩尔比例关系Table 1 Mole ratio of monosaccharide composition
由表1可见,RRP含有7种单糖,其中葡萄糖含量最高,其次为阿拉伯糖、半乳糖、半乳糖醛酸,而鼠李糖、葡萄糖醛酸、甘露糖含量较低。RRP-1含有4种单糖,葡萄糖是RRP-1的主要组分,而阿拉伯糖、半乳糖、甘露糖的含量较低。RRP-2含有5种单糖,其中半乳糖含量最高,其次为阿拉伯糖、葡萄糖醛酸。RRP-3含有6种单糖,其中半乳糖含量最高,其次为半乳糖醛酸和阿拉伯糖。
RRR含有7种单糖,其中葡萄糖含量最高,其次为阿拉伯糖、半乳糖、半乳糖醛酸,而鼠李糖、葡萄糖醛酸、甘露糖含量较低。RRR-1含有4种单糖,葡萄糖是其主要成分。RRR-2含有6种单糖,半乳糖是其主要成分,其次为阿拉伯糖、葡萄糖。RRR-3含有6种单糖,其中半乳糖醛酸含量最高,其次为半乳糖和葡萄糖。
因此,RRR和RRP由相同种类的单糖构成,但是各种单糖之间的摩尔比例关系不同。纯化组分中RRR-1和RRP-1、RRR-3和RRP-3由相同种类的单糖构成,RRR-2和RRP-2由不同种类的单糖构成。
2.6 体外抗氧化能力分析
2.6.1 RRP及其组分的体外抗氧化能力 RRP及其组分RRP-1、RRP-2、RRP-3的羟基自由基和DPPH自由基的清除能力见图7。

图7 RRP及其组分RRP-1、RRP-2、RRP-3的抗氧化能力Fig.7 Anti-oxidant activities of RRP, RRP-1,RRP-2 and RRP-3 注:A:羟基自由基的清除能力;B:DPPH自由基的清除能力。
羟基自由基在体内的化学性质非常活泼,是一种危害性大、破坏性强的活性氧自由基。由图7A可知,RRP及其组分RRP-1、RRP-2、RRP-3的羟基自由基清除能力呈现出明显的量效关系。自由基的清除能力以EC50值表示,EC50值代表清除50%自由基的样品浓度。RRP、RRP-1、RRP-2、RRP-3以及BHT的EC50值分别为725.20、540.95、771.79、657.06、624.23 mg/L,此时羟基自由基清除能力的强弱顺序为RRP-1>BHT>RRP-3>RRP>RRP-2。而当多糖浓度达到1600 mg/L时,强弱顺序变为BHT=RRP>RRP-3>RRP-1>RRP-2。
DPPH是一种很稳定的以氮为中心的自由基,广泛应用于抗氧化物质的体外评价。由图7B可知,随着多糖样品浓度的增加,DPPH自由基的清除能力逐渐增强。RRP、RRP-1、RRP-2、RRP-3以及BHT的EC50值分别为552.82、673.61、714.62、469.06、463.87 mg/L。因此,DPPH自由基清除能力的强弱顺序为BHT>RRP-3>RRP>RRP-1>RRP-2。
2.6.2 RRR及其组分的体外抗氧化能力 RRR及其组分RRR-1、RRR-2、RRR-3的羟基自由基和DPPH自由基的清除能力见图8。
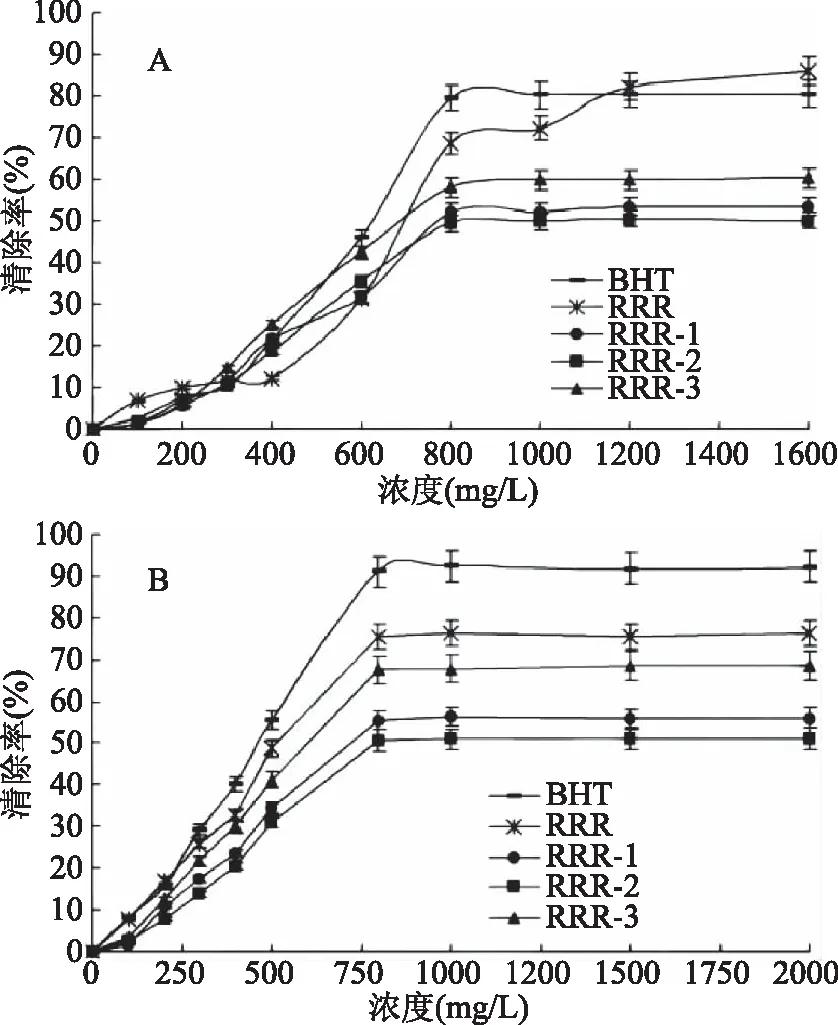
图8 RRR及其组分RRR-1、RRR-2、RRR-3的抗氧化能力Fig.8 Anti-oxidant activities of RRR, RRR-1,RRR-2 and RRR-3注:A:羟基自由基的清除能力;B:DPPH自由基的清除能力。
由图8A可知,RRR及其组分RRR-1、RRR-2、RRR-3的羟基自由基清除能力呈现出明显的量效关系。RRR、RRR-1、RRR-2、RRR-3以及BHT的EC50值分别为699.46、778.25、1017.65、695.69、624.23 mg/L,此时羟基自由基清除能力的强弱顺序为BHT>RRR-3>RRR>RRR-1>RRR-2。而当多糖浓度达到1600 mg/L时,强弱顺序变为RRR>BHT>RRR-3>RRR-1>RRR-2。
由图8B可知,随着多糖样品浓度的增加,DPPH自由基的清除能力逐渐增强。RRR、RRR-1、RRR-2、RRR-3以及BHT的EC50值分别为514.31、722.45、789.23、600.15、463.87 mg/L。因此,DPPH自由基清除能力的强弱顺序为BHT>RRR>RRR-3>RRR-1>RRR-2。
抗氧化实验结果表明,RRP及其组分(RRP-1、RRP-2、RRP-3)、RRR及其组分(RRR-1、RRR-2、RRR-3)具备良好的体外抗氧化能力。RRR的抗氧化活性稍强于RRP。
3 结论
本研究分别将平阴玫瑰花瓣多糖(RRP)和花托多糖(RRR)分离纯化为3个组分(RRP-1、RRP-2、RRP-3和RRR-1、RRR-2、RRR-3),并进行结构和抗氧化能力的对比分析。结构分析表明RRR的单糖组成为葡萄糖、阿拉伯糖、半乳糖、半乳糖醛酸、鼠李糖、葡萄糖醛酸、甘露糖(24.01∶14.57∶11.50∶9.77∶5.5∶1.09∶1),构型主要为呋喃糖。RRR和RRP由相同种类的单糖构成,但是各种单糖之间的摩尔比例关系不同。纯化组分中RRR-1和RRP-1、RRR-3和RRP-3由相同种类的单糖构成,并且构型相同。RRR-2和RRP-2的结构略有差异。抗氧化实验表明,RRR和RRP均具有较强的抗氧化活性,RRR清除羟基自由基和DPPH自由基的EC50值分别为699.46、514.31 mg/L。因此,平阴玫瑰花托多糖具有良好的抗氧化特性,可以开发成为抗衰老保健食品及玫瑰化妆品。
[1]于守超,丰震,赵兰勇.平阴玫瑰品种数量分类研究的探讨[J].园艺学报,2005,32(2):327-330.
[2]李芳霞,王新东,常芳.平阴玫瑰的特色栽培与管理[J].特种经济动植物,2010,13(7):32-33.
[3]彭兴贞,孟宪水,赵秋月.平阴县玫瑰产业发展问题研究[J].青岛农业大学学报:社会科学版,2014,26(1):34-37.
[4]连梅.平阴玫瑰:依托产地基础延长产业链条[J].中国花卉园艺,2014(19):26-27.
[5]王新悦,陆继亮.小玫瑰孕育大产业[J].中国花卉园艺,2014(5):15-17.
[6]王大龙.基于视觉的食用玫瑰花瓣-花托自动分离技术研究[D].昆明:昆明理工大学,2014.
[7]马昌豪,刘红燕,彭慧敏,等.不同品种玫瑰花多糖含量测定[J].食品与药品,2011,13(11):432-434.
[8]刘红燕,王妮.玫瑰花多糖的体外抗氧化活性研究[J].食品与药品,2014,16(4):256-257.
[9]马美范.玫瑰花多糖的提取工艺[J].食品研究与开发,2009,30(12):89-91.
[10]赵晓峰,吴荣书.玫瑰花综合利用与其开发前景[J].保鲜与加工,2004,4(3):30-31.
[11]刘红燕.玫瑰花多糖的提取纯化工艺研究[J].海峡药学,2012,24(5):14-15.
[12]刘文聪.玫瑰花多糖提取工艺的研究[J].福建轻纺,2007(10):19-22.
[13]任朝辉,冯国辉,张传博.姬松茸深层发酵多糖提取工艺优化及抗氧化活性[J].食品工业科技,2017,38(14):216-222.
