还原糖对牡蛎蛋白肽糖基化反应产物功能特性与抗氧化性的影响
2018-05-01牛改改李京丽
牛改改,游 刚,李京丽
(钦州学院,广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535000)
牡蛎(OstrearivularisGould)是我国四大养殖贝类之一,在广西北部湾沿海区域广有分布,它肉质鲜美,营养丰富,尤其是蛋白质含量较高,素有“水产品之最贵者”、“ 海中牛奶”的美称,具有较高的食用价值和保健功能[1-2]。牡蛎蛋白肽(Oyster protein hydrolysates,OP)以其优良的功能特性和抗氧化活性,作为功能食品的原料成分或添加基料,具有较好的应用前景[3-4]。然而,牡蛎在加工过程中,部分蛋白质易发生氧化损伤、降解甚至变性,致使牡蛎蛋白的溶解性、热稳定性和乳化性等功能特性也随之降低,制约了牡蛎蛋白的应用范围[5]。有研究表明食品加工过程中存在蛋白质和糖之间的复杂反应,特别是蛋白质糖基化修饰反应,对蛋白质的功能特性具有一定的改善效果。糖基化修饰是利用还原糖与蛋白质分子上的α-NH2或ε-NH2共价连接而形成糖基化蛋白的过程[6]。糖基化修饰不仅能有效地提高食品蛋白质的溶解性、热稳定性、乳化性和起泡性等功能特性,还对蛋白质的抗氧化性起到改善作用[7-10],已有不少学者主张向食品体系中加入糖基化反应产物,或促使食品成分发生糖基化反应,从而提高产品的功能特性与抗氧化活性。例如,Decourcelle等[11]的研究结果显示糖基化反应可显著改善对虾水解物的乳化性;Seo等[12]研究表明溶菌酶经糖基化反应后,其溶解性、乳化性、热稳定性均得到提高;赵谋明等[13]证明了美拉德反应可提高草鱼肽的抗氧化性。相对于其他改性方法,如酰化作用、磷酸化作用、脱氨基作用等化学方法,糖基化反应是在不需要外加化学试剂的条件下仅仅利用加热进行的自然反应[10],因此蛋白质糖基化改性在食品工业中更有应用前景。
将OP应用到食品加工中也存在糖基化反应,因此有必要研究OP经糖基化反应后产物的功能特性与抗氧化性的变化。本文选用葡萄糖(Glc)、乳糖(Lac)、半乳糖(Gal)三种还原糖对OP进行糖基化反应,制备OP糖基化反应产物(OP-Glycosylation modified products,OP-GMPs),通过比较分析,筛选出能够较好改善OP功能特性与抗氧化活性的还原糖,为其在功能食品及调味品中的应用提供参考。
1 材料与方法
1.1 材料与仪器
牡蛎 长6~9 cm,约150 g,广西壮族自治区钦州市茅尾海;胰蛋白酶(2500 U/g)、葡萄糖、乳糖、半乳糖、氯化钠、三羟甲基氨基甲烷(Tris)、HCl、考马斯亮蓝、石油醚、铁氰化钾、三氯乙酸、水杨酸、邻苯三酚、H2O2等化学试剂 分析纯,国药集团化学试剂有限公司。
FD5-3B冷冻干燥机 美国金西盟公司;V-1800PC可见分光光度计 上海美普达仪器有限公司;EL20 pH计 梅特勒-托利多仪器(上海)有限公司;BS-1E数显振荡培养箱 韶关市泰宏医疗机械有限公司;GL-G-Ⅱ立式冷冻离心机 上海安亭科学仪器厂;EL204型电子天平 常熟市双杰测试仪器厂;T18 basic型高速匀浆机 德国IKA;JYL-B061型打浆机 九阳股份有限公司;HH-4型数显恒温水浴锅 重庆阿修罗科技发展有限公司。
1.2 实验方法
1.2.1 OP的制备 参照林海生等[4]方法并稍作修改。牡蛎肉去内脏、清洗干净,沥干水后打浆,肉浆与磷酸缓冲溶液(pH=8.5)以1∶3 (w∶v)混匀,加入胰蛋白酶,45 ℃酶解2.5 h后在95 ℃下灭酶10 min,离心15 min(8000 r/min,4 ℃),取上清液置于冷冻干燥机中冻干(-50 ℃,48 h),冻干粉保存在-20 ℃备用。
1.2.2 OP-GMPs的制备 分别称取不同质量比(0.5∶1、1∶1、2∶1、3∶1、4∶1、5∶1)的还原糖(葡萄糖、乳糖、半乳糖)∶OP,溶解使其最终浓度为10 mg/mL,用0.5 mol/L NaOH或HCl调节pH至7.5,冻干成粉(-50 ℃,48 h)。称取一定量的冻干粉,放置于湿度为65%(饱和KI溶液),温度为50 ℃的培养箱中进行糖基化反应24 h后,冻干成粉(-50 ℃,48 h),放入-20 ℃冰箱保存,备用。
1.2.3 OP-GMPs的功能特性
1.2.3.1 OP-GMPs溶解度的测定 参照文献[12]的方法。称取0.3 g OP-GMPs粉末溶于30 mL 0.5 mol/L的NaCl溶液(40 mmol/L Tris-HCl,pH7.5)中,10000 r/min均质1 min,取10 mL均质溶液离心30 min(10000 r/min,4 ℃)。溶解度用上清液中所含蛋白的含量与离心前溶液蛋白质含量的比值来表示。蛋白质含量采用双缩脲法测定[14],以酪蛋白的含量为横坐标,吸光值为纵坐标绘制标准曲线:y=0.048x+0.009,R2=0.999。
1.2.3.2 OP-GMPs热稳定性的测定 参照文献[15]的方法。称取0.2 g OP-GMPs粉末溶于20 mL 0.5 mol/L的NaCl 溶液(40 mmol/L Tris-HCl,pH7.5)中,离心30 min(10000r/min,4 ℃),取上清液置于80 ℃水浴锅中加热1 h,用冰水冷却,然后再离心30 min(10000 r/min,4 ℃)。热稳定性用热处理后上清液中所含蛋白的含量与热处理前上清液中蛋白质含量的比值来表示,且蛋白质含量用双缩脲法测定[14]。
1.2.3.3 OP-GMPs乳化性的测定 参照文献[12]的方法。称取0.3 g OP-GMPs粉末,用3 mL 0.5 mol/L NaCl溶液(40 mmol/L Tris-HCl,pH=7.5)配制成蛋白质悬浊液,然后加入1 mL花生油,搅拌1 min。迅速吸取上清液加入到20 mL 0.1%的SDS溶液中,混匀,立即以0.1% SDS作为空白,在500 nm波长下测定0 min时的吸光度A0,10 min后再取样同上检测吸光度A10。按照公式:EA=A0,ESI=10A0/(A0-A10)计算样品的乳化活性(EA)和乳化稳定性指数(ESI)。式中,A0为0 min时测得的吸光度值,A10为10 min后测得的吸光度值。
1.2.4 OP-GMPs的抗氧化性测定
1.2.4.1 DPPH·清除的测定 参照文献[16]的方法。分别吸取2 mL OP-GMPs溶液(0.4 mg/mL)和0. 1 mmol/L DPPH无水乙醇溶液置于试管中,混匀,黑暗反应30 min后于517 nm处测定吸光度(Ai);分别吸取2 mL DPPH无水乙醇溶液和无水乙醇于试管中,混匀,黑暗反应30 min后于517 nm测定吸光度(Ac);分别吸取2 mL OP-GMPs溶液和无水乙醇于试管中,混匀,黑暗反应30 min,在517 nm下测定吸光度(Aj)。按照公式:清除率(%)=[1-(Ai-Aj)/Ac]×100 计算样品对DPPH·的清除率。
1.2.4.2 ·OH清除的测定 采用水杨酸法[17]测定。向试管中依次加入4.5 mmol/L FeSO4、4.5 mmol/L水杨酸-乙醇溶液和0.4 mg/mL OP-GMPs溶液各1 mL,混匀后加入1 mL 4.4 mmol/L H2O2于37 ℃反应30 min;以去离子水调零,在510 nm测定样品的吸光度,按照公式:清除率(%)=[1-(Ai-Aj)/A0]×100 计算样品对·OH的清除率。式中,A0为空白对照液的吸光度(去离子水代替待测液),Ai为加入样品后的吸光度,Aj为样品溶液的吸光度(不加显色剂H2O2)。
1.2.4.3 还原能力的测定 采用铁氰化钾还原法[18]测定。向1.5 mL 0.4 mg/mL OP-GMPs溶液中依次加入1.5 mL 0.2 mol/L磷酸缓冲液(pH=7.0)和1.5 mL 1%(w/v)铁氰化钾溶液,混匀后于50 ℃水浴20 min,再加入1.5 mL 10%(v/v)的三氯乙酸,振荡混匀,以4000 r/min离心10 min;取上清液3 mL,加3 mL去离子水和0.25 mL 0.1%(w/v)三氯化铁,混匀后于700 nm测吸光度(A1);以1.5 mL去离子水代替1%铁氰化钾溶液,其它同上,测吸光度(A0);还原力=A1-A0,吸光度越大,表示还原力越强。
1.3 数据处理

2 结果与分析
2.1 OP-GMPs溶解性的测定
蛋白质的溶解性与乳化性、凝胶性、起泡性等特性有密切关系,是其它功能特性的先决条件。3种还原糖与牡蛎蛋白在不同混合比条件下制备OP-GMPs的溶解度变化如图1所示,OP的溶解度为30.12%,3种还原糖(Glc、Lac、Gal)分别与OP热反应后,OP-GMPs的溶解度随质量比(糖∶OP)的增大均呈现先升高后降低的趋势,且均大于OP的溶解度。OP-GMPs溶解度升高主要是由于存在的还原糖与OP发生了反应进而减缓了蛋白质热变性[15],推论与OP-GMPs的热稳定性结果一致(见图2)。另外,还原糖含有多个亲水羟基,蛋白质与还原糖发生糖基化反应后生成的OP-GMPs中引入了大量的羟基,羟基的亲水性使得整个分子的溶解度得到提高[19]。Sanmartin等[20]认为蛋白共价连接了碳水化合物后,其产物净电荷改变导致结构发生变化,促使亲水性基团产生,从而提高其溶解度。然而,随着质量比(糖∶OP)的增加,可与蛋白质发生反应的还原糖相对含量增加,使糖基化反应程度增大,进而生成的低溶解度的类黑精增多,导致其溶解度降低[21]。此外,OP相对含量逐渐减少,过量还原糖自身发生焦糖化反应形成低溶解度物质,导致反应产物溶解度降低。

图1 OP与不同还原糖在不同质量比(糖∶OP)条件下糖基化反应产物OP-GMPs的溶解性Fig.1 Solubility of OP-GMPs prepared at different sugar to OP ratios
Gal对OP-GMPs溶解性改善效果好于Glc和Lac。在糖∶OP=2∶1时,3种糖与OP形成的OP-GMPs溶解度均达到最大值,且Gal(83%)>Glc(76%)>Lac(72%),这与Nishimura等[15]和Achouri等[22]的研究结果类似,即在一定条件下糖基化反应可显著改善蛋白质的溶解性。不同还原糖及质量比(糖∶OP)影响糖基化反应程度,进而影响蛋白质溶解性改善效果[12]。当糖∶Op<2∶1时,OP-GMPs溶解度改善效果:Gal>Glc>Lac,结果表明单糖对OP-GMPs溶解度改善效果优于双糖。当糖∶OP>2∶1时,OP-GMPs溶解度改善效果:Gal>Lac>Glc,结果表明Gal与OP 糖基化反应强度高于Glc。同时,Lac是由Gal和Glc组成,因此Lac改善效果优于Glc可能与其结构中存在Gal结构有关,且Gal对OP-GMPs的溶解度改善效果好于Glc。Katayama等[23]进一步阐明了Glc改善肌动蛋白和肌球蛋白的溶解性机理,发现Glc主要阻止蛋白质亚片段结构上的结合位点形成,同时,减少了蛋白质-NH2残基数,进而减弱了单纤维形成能力。由此,可以推测,与Glc相比,Gal与OP发生糖基化反应,更大程度上抑制OP的亚片段结构上的结合位点形成,且与蛋白质-NH2残基结合位点增加,进而改变OP表面疏水性,同时,蛋白质结构中引入了亲水性基团(-OH,-COOH)改善了OP-GMPs的溶解性。
2.2 OP-GMPs热稳定性的测定
与植物蛋白及脊椎动物蛋白相比,水产蛋白的热稳定性较差[5],相关研究表明糖基化反应可以有效改善鱼肉蛋白的热稳定性[24-25],但糖基化反应对牡蛎蛋白的影响鲜见报道,因此,有必要探讨牡蛎蛋白进行糖基化反应对其热稳定性的影响。3种还原糖分别与OP形成OP-GMPs的热稳定性变化如图2所示。随着质量比(糖∶OP)的增加,3种还原糖对OP-GMPs的热稳定性影响均呈现先增加后减小趋势,且均显著大于OP的热稳定性(p<0.05),结果表明3种还原糖均能阻止蛋白质分子聚集,抑制其热变性和形成凝聚沉淀物;Nishimura等[15]报道了鸡肉肌纤维蛋白与麦芽糖反应后显著提升了蛋白质的热稳定性;Seo等[12]研究发现经Gla糖基化修饰,溶菌酶(LZM)的疏水作用力减小、热稳定性显著提升,表明糖基化反应能改善蛋白稳定性、抑制其热变性,支持了本实验的结果。此外,长链多糖也能显著改善蛋白质的热稳定性,例如,Aminlari等[26]研究发现LZM与葡聚糖、甘露聚糖糖基化反应后能够提升蛋白质热稳定性,主要是由于较长链的多糖能在空间上防止蛋白质链折叠、聚集。当3种还原糖均在糖∶OP=3∶1时,其产物均达到最大热稳定性,其中经Glc糖基化修饰后的产物稳定性最高(p<0.05),结果表明,与Gal和Lac相比,Glc能较好地抑制OP-OP相互作用,改善OP热稳定性。然而,当糖∶OP>3∶1时,3种还原糖形成的OP-GMPs的热稳定性下降,可能是由于高含量的糖引起OP的构象变化,减少了蛋白质的α螺旋[12],导致OP间的疏水作用、折叠及聚集作用增强,进而热稳定性降低。

图2 OP与不同还原糖在不同质量比(糖∶OP)条件下糖基化反应产物OP-GMPs的热稳定性Fig.2 Thermal stability of OP-GMPs prepared at different sugar to OP ratios
2.3 OP-GMPs乳化性的测定
蛋白质乳化性是指蛋白样品与油水结合在一起,经相转变(从O/W乳状液转变成W/O乳状液)形成乳状液;乳化稳定性是指油水乳状液保持稳定的能力[27]。蛋白质-糖共聚物的亲水亲油平衡性对其乳化性起重要作用,在乳化过程中,蛋白质上的亲油基结合到油滴上,多糖上的亲水基与油滴周围的水分子结合,形成一层厚的空间稳定层,阻止油滴合并[7]。因此,起始质量比影响共聚物亲水亲油平衡性,进而影响其乳化性[7]。质量比(糖∶OP)对OP-GMPs乳化性的影响如图3所示。随着质量比的增加,除Gal外(先增加后平稳),其他2种还原糖与OP形成的OP-GMPs的乳化性与乳化稳定性均先增加后减小,这是因为OP与还原糖发生聚合后,溶解度提高,同时聚合后的蛋白侧链残基具有一定的疏水性,使得OP-GMPs能够快速较好地吸附在油水界面,当反应体系中还原糖比例过高时,蛋白在乳化液中能够快速度吸附到O/W界面的可能性开始减少,使乳化性降低[7]。此外,三种还原糖对应形成的OP-GMPs的乳化活性均显著大于OP(p<0.05),说明糖基化反应可改善蛋白质的乳化活性,可能是由于共聚物中的糖基体可以产生较高的屈服值阻碍乳化分层和向上的浮动力[27]。进一步分析,Gal和Lac对OP的乳化活性改善贡献大于Glc,这可能与Lac结构中包含Gal成分有关,由于Gal可显著改善OP溶解性,由此推测Gal对OP乳化活性的改性起主要作用。在糖∶OP=3∶1时,3种糖基供体形成的OP-GMPs的乳化活性:Gal(0.85)>Lac(0.76)>Glc(0.43),均大于OP(0.37)。
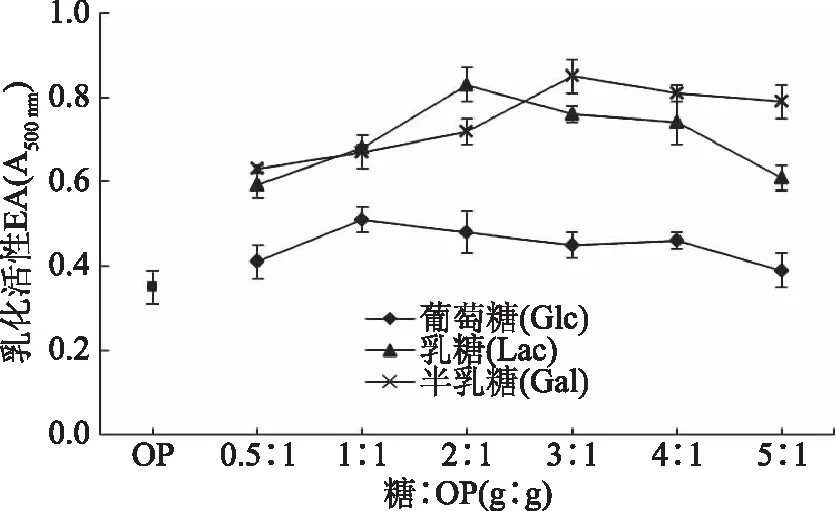
图3 OP与不同还原糖在不同质量比(糖∶OP)条件下糖基化反应产物OP-GMPs的乳化活性Fig.3 Emulsifying activity of OP-GMPs prepared at different sugar to OP ratios
质量比(糖∶OP)对OP-GMPs乳化稳定性的影响如图4所示。随着质量比的增加,OP-GMPs的乳化稳定性指数均先增加后减小,且在糖∶OP=3∶1时,3种糖基供体形成的OP-GMPs的乳化稳定性指数均达最大值:Gal(16%)>Glc(13.5%)>Lac(12%),均大于 OP(11%)。相比于Lac和Glc,Gal对OP的乳化稳定性改善效果最佳,这与Seo等[12]研究Gal-溶菌酶糖基化反应产物乳化性稳定性的结果一致,这是因为Gal具有高水合作用的长链,结合到乳化液的水分子层,形成较厚的空间位阻稳定层,阻止油滴聚集,减缓乳化液分层,进而提高乳化稳定性。同样,Li等[27]研究发现葡聚糖和麦芽糖糊精经糖基化反应能显著改善大米蛋白水解液的乳化性和乳化稳定性。在糖∶OP>3∶1时,OP-GMPs的乳化稳定性降低可能是由于高含量的糖基体减缓了共聚物的移动性,并阻碍了其在油滴界面饱和吸附[7]。

图4 OP与不同还原糖在不同质量比(糖∶OP)条件下糖基化反应产物OP-GMPs的乳化稳定性指数Fig.4 Emulsion stability index of OP-GMPs prepared at different sugar to OP ratios
比较Lac和Glc对OP的乳化活性及稳定性影响结果,发现Lac对OP的乳化活性改善效果好于Glc,但是对OP的乳化稳定性贡献小于Glc,说明Lac-OP的反应产物具有较好的乳化活性,但是其乳化稳定性较差,这是因为糖基化产物虽具有较好的乳化性,但是其形成的乳化液颗粒较大,导致其乳化稳定性较差[28]。
2.4 OP-GMPs对DPPH·清除的测定
在抗氧化性测定实验中,OP-GMPs浓度为0.4 mg/mL。OP-GMPs对DPPH·的清除作用如图5所示。OP-GMPs对DPPH·的清除率随着质量比(糖∶OP)的增加先升高后降低,且均高于OP对DPPH·的清除作用(p<0.05),结果表明OP经糖基化反应后能产生较多的H原子或自由基中间体与DPPH·形成稳定分子结构[29-30]。3种糖与OP形成的OP-GMPs对DPPH·的清除作用表现为:Gal>Glc>Lac。由于还原糖的种类影响糖基化反应速率与强度,其中五碳醛糖>己醛糖>已酮糖>二糖,Gal 和 Glc是己醛糖,Lac是二糖,因此,与Lac相比,Gal或Glc与OP糖基化反应速率较快,产物产生的清除DPPH·的中间产物亦较多[31]。Gal与OP糖基化反应产物的DPPH·的清除率高于Glc,是因为Gal-OP糖基化反应产物的溶解性更好,促进了氢原子或自由基中间体的形成,进而与DPPH·结合形成稳定分子结构。Benjakul等[32]研究表明Gal与猪血浆蛋白产生的糖基化反应产物较Glc具有更大的DPPH·清除活性,与本实验研究结果一致。此外,对于Lac,不同质量比(糖∶OP)形成的OP-GMPs对DPPH·的清除作用影响不显著(p>0.05);然而,糖∶OP>2∶1时,Gal和Glc对应的糖基化产物DPPH·的清除率均呈下降趋势,与糖基化产物的溶解性减小有关,也可能是因为蛋白质相对含量减少导致疏水区域减少,进而影响DPPH·清除能力。因此,糖∶OP=2∶1时,Gal-OP糖基化产物对DPPH·的清除作用效果最佳。

图5 OP与不同还原糖在不同质量比(糖∶OP)条件下糖基化反应产物OP-GMPs对DPPH·的清除作用Fig.5 Scavenging effect of DPPH· of OP-GMPs prepared at different sugar to OP ratios
2.5 OP-GMPs对·OH清除的测定
OP-GMPs对·OH清除率的变化如图6所示。Glc或Gal与OP形成的OP-GMPs可显著提高对·OH的清除率(p<0.05);而Lac与OP糖基化反应产物对·OH的清除率相对较差,可能与糖的组成和结构有关,该结果与对DPPH·的清除率结果一致。随着质量比(糖∶OP)的增加,OP-GMPs对·OH的清除率呈先增加后减小趋势,原因可能是糖基化反应使糖-OP分子共聚,分子量增加,螯合Fe2+能力增强,从而有效抑制Fe2+与H2O2反应,阻止羟自由基的产生,增大对·OH清除力[33];但是,当糖∶OP>4∶1时,3种糖形成的OP-GMPs 对·OH清除率均减小,可能是因为糖-OP结合饱和,过量存在的糖分子之间发生反应,导致其对·OH的清除能力减小。糖∶OP=4∶1时,Gal-OP糖基化产物对·OH的清除率最大(65.76%)高于Glc(63.58%),二者均显著高于(p<0.05)Lac(45.5%)和OP(33.6%)。

图6 OP与不同还原糖在不同质量比(糖∶OP)条件下糖基化反应产物OP-GMPs对·OH的清除作用Fig.6 Scavenging activities of ·OH of OP-GMPs prepared at different sugar to OP ratios
2.6 OP-GMPs还原能力的测定
3种还原糖对应的OP-GMPs还原能力如图7所示。OP-GMPs的还原能力随着质量比(糖∶OP)的增加先升高后降低,可能是因为随着反应体系中还原糖比例的增加,糖基化反应速率增大,形成的还原性物质增多,还原能力增强,这与Benjakul等[32]研究结果一致,即增加糖含量能够增大反应产物的还原力。但是,当糖的比例过高时,糖基化反应减慢,从而使还原能力趋于平缓、甚至降低[34]。3种糖与OP形成的OP-GMPs还原能力表现为:Glc>Gal>Lac。当糖∶OP=4∶1时,Glc与OP形成的OP-GMPs还原能力最大。
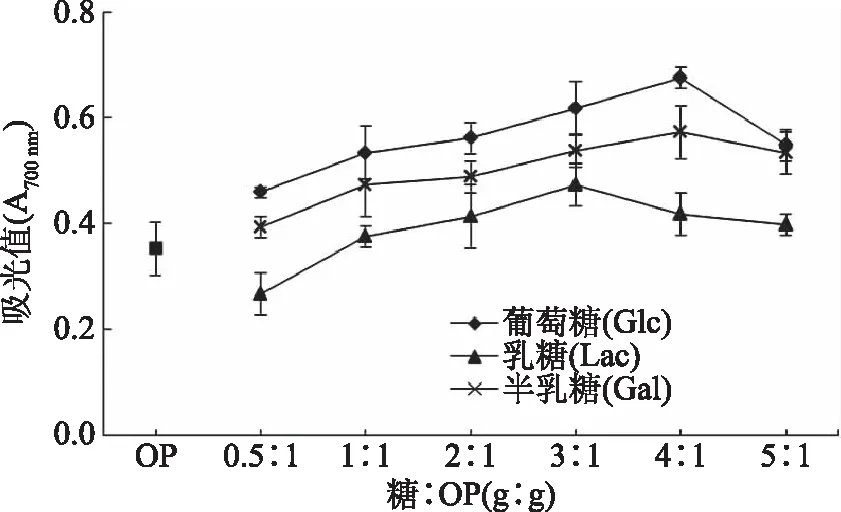
图7 OP与不同还原糖在不同质量比(糖∶OP)条件下糖基化反应产物OP-GMPs的还原能力Fig.7 Reducing ability of OP-GMPs prepared at different sugar to OP ratios
3 结论
糖基化反应可显著改善OP的功能特性(溶解性、热稳定、乳化特性)与抗氧化性(还原能力、对DPPH·和·OH清除能力),且与糖的种类和质量比(糖∶OP)相关。功能特性方面:在质量比(Gal∶OP)=2∶1和3∶1时,可分别提高OP的溶解性与乳化性(p<0.05);Glc∶OP=3∶1时,可改善OP的热稳定性(p<0.05)。抗氧化性方面:Gal∶OP=2∶1和4∶1时,OP-GMPs分别对DPPH·和·OH的清除作用最强;Glc可显著提升OP的还原力,Glc∶OP=4∶1时,OP-GMPs的还原能力最强。后续将进一步研究寡糖和多聚糖等不同类型的糖基供体及质量比(糖∶OP)对OP功能特性和抗氧化性的影响,为开发出强功能特性和抗氧化活性的OP-GMPs,并将其应用到功能食品、天然食品添加剂和调味剂等提供参考。
[1]董晓伟,姜国良,李立德,等. 牡蛎综合利用的研究进展[J]. 海洋科学,2004,28(4):62-65.
[2]汪何雅,杨瑞金,王璋. 牡蛎的营养成分及蛋白质的酶法水解[J]. 水产学报,2003,27(2):163-168.
[3]刘姝,王淑军,房耀维,等. 发酵法制备太平洋牡蛎水解液的功能特性及其抗氧化活性[J]. 水产科学,2013(11):641-645.
[4]林海生,曹文红,章超桦,等. 牡蛎蛋白酶解物的制备及其抗氧化活性研究[J]. 食品工业科技,2013,34(16):163-168.
[5]陈欣,黄和,李中权. 糖基化反应改善水产蛋白功能特性的研究进展[J]. 中国食物与营养,2010(4):35-38.
[6]李军,杜鑫,Hosseini Moghaddam S H,等. 蛋白质糖基化修饰研究进展[J]. 科技通报,2009,25(6):773-778.
[7]Oliver C M,Melton L D,Stanley R A. Creating proteins with novel functionality via the Maillard reaction:A review[J]. Critical Reviews in Food Science and Nutrition,2006,46(4):337-350.
[8]卢家成,孙泽威,李婷琳. 糖基化反应改善大豆抗原蛋白功能特性的研究进展[J]. 大豆科学,2012,31(3):483-486.
[9]Gu F L,Jinmoon K,Abbas S,et al. Structure and antioxidant activity of high molecular weight maillard reaction products from casein-glucose[J]. Food Chemistry,2010,120(2):505-511.
[10]Martins S I F S,Jongen W M F,Boekel M A J S V. A review of Maillard reaction in food and implications to kinetic modelling[J]. Trends in Food Science & Technology,2001,11(9-10):364-373.
[11]Decourcelle N,Sabourin C,Dauer G,et al. Effect of the Maillard reaction with xylose on the emulsifying properties of a shrimp hydrolysate(Pandalus borealis)[J]. Food Research International,2010,43(8):2155-2160.
[12]Seo S,Karboune S,L’Hocine L,et al. Characterization of glycated lysozyme with galactose,galactooligosaccharides and galactan:Effect of glycation on structural and functional properties of conjugates[J]. LWT-Food Science and Technology,2013,53(1):44-53.
[13]赵谋明,刘洋,张佳男,等. 木糖-草鱼肽美拉德反应产物的抗氧化性[J]. 农业工程学报,2014,30(9):279-286.
[14]杨建雄. 生物化学与分子生物学实验技术教程[M]. 北京:科学出版社,2002:33-34.
[15]Nishimura K,Murakoshi M,Katayama S,et al. Antioxidative ability of chicken myofibrillar protein developed by glycosylation and changes in the solubility and thermal stability[J]. Bioscience Biotechnology and Biochemistry,2011,75(75):247-254.
[16]Yen G,Hsieh P. Antioxidative activity and scavenging effects on active oxygen of xylose-lysine maillard reaction products[J]. Journal of the Science of Food & Agriculture,1995,67(3):415-420.
[17]Wang H,Gao X D,Zhou G C,et al.Invitroandinvivo,antioxidant activity of aqueous extract fromChoerospondiasaxillarisfruit[J]. Food Chemistry,2008,106(3):888-895.
[18]Matmaroh K,Benjakul S,Tanaka M. Effect of reactant concentrations on the Maillard reaction in a fructose-glycine model system and the inhibition of black tiger shrimp polyphenoloxidase[J]. Food Chemistry,2006,98(1):1-8.
[19]田其英,华欲飞. 大豆蛋白溶解性研究[J]. 粮食与油脂,2006(6):6-8.
[20]Sanmartín E,Arboleya J C,Villamiel M,et al. Recent advances in the recovery and improvement of functional proteins from fish processing by-products:Use of protein glycation as an alternative method[J]. Comprehensive Reviews in Food Science and Food Safety,2009,8(4):332-344.
[21]Yue L,Fang L,Luo C,et al. Functional properties of the Maillard reaction products of rice protein with sugar[J]. Food Chemistry,2009,117(1):69-74.
[22]Achouri A,Boye J I,Yaylayan V A,et al. Functional properties of glycated soy 11S glycinin[J]. Journal of Food Science,2005,70(4):269-274.
[23]Katayama S,Junji Shima A,Saeki H. Solubility improvement of shellfish muscle proteins by reaction with glucose and its soluble state in low-ionic-strength medium[J]. Journal of Agricultural and Food Chemistry,2002,50(15):4327-4332.
[24]Sato R,Swabe T,Kishimura H,et al. Preparation of neoglycoprotein from carp myofibrillar protein and alginate oligosaccharide:Improved solubility in low ionic strength medium[J]. Journal of Agricultural and Food Chemistry,2000,48(1):17-21.
[25]Ryo Sato,Shigeru Katayama,Tomoo Sawabe. Stability and emulsion-forming ability of water-soluble fish myofibrillar protein prepared by conjugation with alginate oligosaccharide[J]. Journal of Agricultural and Food Chemistry,2003,51(15):4376-4381.
[26]Aminlari M,Ramezani R,Jadidi F. Effect of Maillard-based conjugation with dextran on the functional properties of lysozyme and casein[J]. Journal of the Science of Food & Agriculture,2005,85(15):2617-2624.
[27]Li Y,Zhong F,Ji W,et al. Functional properties of Maillard reaction products of rice protein hydrolysates with mono-,oligo- and polysaccharides[J]. Food Hydrocolloids,2013,30(1):53-60.
[28]Dickinson E,Galazka V B. Emulsion stabilization by ionic and covalent complexes ofβ-lactoglobulin with polysaccharides[J]. Food Hydrocolloids,1991,5(3):281-296.
[29]章银良,张陆燕,周文权,等. 不同温度对酪蛋白-木糖模式美拉德反应产物抗氧化性的影响[J]. 现代食品科技,2014(4):211-219.
[30]于彭伟,刘登勇,周光宏. 木糖-甘氨酸美拉德反应体系光谱特性和抗氧化性能的研究[J]. 食品科学,2012,33(1):54-58.
[31]Jalbout A F,Shipar M A H,Navarro J L. Density functional computational studies on ribose and glycine Maillard reaction:Formation of the Amadori rearrangement products in aqueous solution[J]. Food Chemistry,2007,103(3):919-926.
[32]Benjakul S,Lertittikul W,Bauer F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model[J]. Food Chemistry,2005,93(2):189-196.
[33]Chen X M,Kitts D D. Antioxidant and anti-inflammatory activities of Maillard reaction products isolated from sugar-amino acid model systems[J]. Journal of Agricultural and Food Chemistry,2011,59(20):11294-11303.
[34]Sun Y,Hayakawa S,Chuamanochan M,et al. Antioxidant effects of Maillard reaction products obtained from ovalbumin and different D-aldohexoses[J]. Bioscience Biotechnology and Biochemistry,2006,70(3):598-605.
