基于人工神经网络的病人麻醉深度判断方法
2018-04-29曹祥琪李少波谢建兴张辈





摘 要:在全身麻醉手术过程中,麻醉深度监测十分重要。为了获得更精确、更简单以及非侵入式的麻醉深度方法,本文利用心跳变化相似程度来分析自主神经活性指标,以专家评估的意识程度指标建立类神经网络回归模型。针对人工神经网络初始权重不稳定的问题,研究了人工神经网络集成法,接着通过灵敏度和特异度分析方法判断自主神经活性指标回归前与回归后的精准度差别。最后使用T检测进行统计分析,实验结果表明基于人工神经网络获得病人麻醉深度模型方法具有较好的鲁棒性。
关键词:自主神经活性指标;心电图;心率变异程度;专家评估的意识程度指标;人工神经网络
中图分类号:TP391
文献标识码:A
文章编号"1000-5269(2018)04-0078-07
目前,在麻醉手术中,麻醉深度的监测系统是不可或缺的环节之一,由于在进行全身麻醉时,会同时使用多种麻醉药剂,而麻醉药剂与人的神经系统之间有着复杂的关联关系,因此麻醉深度监测是当前国内外研究的热点和难点[1]。麻醉深度的判断不只是为了让麻醉医师知道病人当下的麻醉情况,更是为了控制病人当下的麻醉剂量。市面上有很多的麻醉监测系统,而在这些麻醉监测系统中,BIS(Bispectral Index)是麻醉深度监测系统的指针之一,其监测系统将病人的麻醉深度范围限定在[0,100],BIS是透过脑电波的电生理讯号分析演算而获得的结果[2]。同时,由于脑电波的取得需要特殊的模块以及昂贵的电击贴片,而在心率变异度分析上只要通过心电图就能取得。心电图和脑电波不一样,在仪器方面以及电击贴片的技术上已经非常纯熟[3],这些将为后面的研究提供理论和方法上的支持 。
麻醉深度监测系统目前还在不断的发展中,如何获得更精确、更简单以及非侵入式的麻醉深度监测系统,提供给麻醉医师更多的选择,让病人在接受全身麻醉的时候能有更多的安全考虑是本文研究的主要内容。主要思想是:基于传统的麻醉深度检测分析方法进行演算调整,并以心电图作为分析的生理讯号计算出自主神经活性指标,接着由人工神经网络回归分析,以专家评估的意识程度指标(Expert Assessment of Conscious Level, EACL)为目标,以自主神经活性指标为输入进行回归,实现基于人工神经网络的病人麻醉深度判断。
1"基于人工神经网络的病人麻醉深度判断模型
1.1"心率变异度
心率变异度分析为连续心跳间距之差异,心率变异度分析经由动态心电图讯号中撷取每个R波之波峰,计算波峰与波峰之间的距离,从而获得每拍心跳之间的时间间距,经由时间标准化后,通过后面一个心跳时间间距减去前一个心跳时间间距计算出心率变异度数值。由于心脏的传感器会感测血液中的肾上腺素浓度并传达讯息给脑干,由自律神经系统(Autonomic Nervous System, ANS)达到自动平衡的机制,根据先前研究显示,当一般人心率变异度分析(Heart Rate Variability)的变异程度降低时与心肌衰竭有关联,心率变异度分析(HRV)不只可能与心肌衰竭有关联,也可能造成突然死亡的风险[4]。而在手术过程中,当病人从醒着的状态转换到无意识的状态时,心率变异度也会随之改变[5, 6],主要原因是心率变异度关系到自主神经的调节,而自主神经的活性又会受到全身麻醉的药物影响,所以基于以上分析才创造出自主神经活性指标[7]。值得说明的是:文中使用了台湾中央大学数据分析方法研究中心研究团队所开发的撷取R波算法[8],通过这个算法将实验中所收集到的122组数据,由心电图讯号转换成心跳间距。
1.2"自主活性神经指标
在麻醉学里,量测麻醉深度是非常重要的一环,台湾大学医疗团队在2008年开发出一款通过心律变异程度的变化而计算出的麻醉深度监测指针,其主要原理是当病人在全身麻醉的情况下,心律变异程度会深深地受到麻醉影响而降低,并在此生理条件下设计出一套自主神经活性指针的演化算法,具体流程如下:
首先取得每个案例的心跳间距,接着结合心跳间距以博格(Berger)算法[9],将采样频率设定为4 Hz做重新采样,让时间单位标准化。将心跳间距以r(1)、r(2)、r(3)、…、r(n)表示,心率变异度分析的计算方法如下:
在此步骤中将心率变异程度的计算数值全部取绝对值,并与之前实验所取的数值不同[10],主要原因是为了在麻醉监测过程中,使得清醒状态以及麻醉状态有明显的区别,故将心率变异程度取绝对值。
在第三个步骤里,将d(n)分成两个连续性的移动式窗,每个窗口以32 s为一个单位,第一个窗口为d(t-2M+1)到d(t-M),第二个窗口的范围为d(t-M+1)到d(t)(M=128, t等于任何想观察的时间 ,ngt;0),如图1所示。统计范围为0~0.5 s,每0.002 s作为一个间距,一共分成250组,统计出心率变异度数值在每个间距出现的次数,并将出现的次数以百分比统计,最后统计出的第1个窗口的250组区间命名为P1(i)(i=1,2,3,…,250),如图2(a)所示;统计出的第2个窗口之250组区间命名为P2(i)(i=1,2,3,…,250),如图2(b)所示。
由于步骤3将所有的心率变异程度取绝对值,所以在步骤4中也将统计的范围调整为[0~0.5],在先前的研究中将统计范围设定为[-0.4~0.4],但在研究的过程中发现,心率变异程度会大于0.4,因此将范围的设定为[0~0.5]。
最后将统计后的两组统计图中的250组数值带入自主神经活性指标的演算方法中,计算公式如下:
1.3"灵敏度与特异性
灵敏度(sensitivity)和特异度(specificity)是统计学中用来表征二项分类测试特征的数据。为了分析自主神经活性指标与专家所评估之意识清醒程度的准确度,将灵敏度设置为是真阳(True Positive, TP)与真阳性加假阴性(False Negative, FN)的比值,特异度设置为真阴性(True Negative, TN)与真阴性加假阳性(False Positive, FP)的比值,用以判断自主神经活性指标是否与专家所评估意识清醒程度指标相似。
灵敏度和特异度分析方法第1步是先定义阀值,传统的方法是将阀值设定为平均值加上两倍的标准偏差[11],所以本文延续使用这个方法进行阀值的定义,首先将标准数据转换成0或1的形式,当数值大于阀值时为1,当数值小于阀值时为0,接着进行真阳性、伪阳性、真阴性以及伪阴性的分析,其代表意义如表1所示,并通过公式(3)、公式(4)和公式(5)计算出灵敏度、特异度以及准确度(Accuracy, ACC)。
1.4"基于人工神经网络的病人麻醉深度判断模型
人工神经网络是一种模仿人类大脑神经元结构进行处理与分析问题的模型。网络模式的应用依照问题领域的不同而作选择,以应用范围最广、成果率高的监督式倒传递网络作为建立模型的方法。需要说明的是:倒传递是将误差反馈给前面的隐藏层,经整理后将误差逐层传回,此种现象主要是因为传统的倒传递网络是采用最陡坡降法(Steepest Descent Method)为学习法则[10]。
建立人工神经网络模型前必须先将所有分析完成的105组数据以及专家评估的意识清醒程度正规化,完成之后接着将数据分为两大类,主要思路是:将105组数据中的85组数据当作建立模型的训练样本,而剩下的20组当作测试样本,由于20组样本不需经过人工神经网络的学习过程,因此先将20组数据分离出来,接着将剩余的85组数据以随机取样的方式切割出训练样本70%、验证样本20%以及10%的测试样本,并将隐藏层设定为2,而隐藏层当中的节点数分别设定为17与10,而17与10刚好是第一个周期,最符合时间成本,所以本文中的节点数设定为17与10,而在数据正规化方面,采用非线性正切双弯曲转移函数(Hyperbolic Tangent Sigmoid of transfer function)进行正规化,此方法使得输入数据数值介于[1~-1],将数据正规化后紧接着开始进行人工神经网络计算分析。
为了提高模型的泛化能力,解决初始权重分配不均的问题,本文同时使用集成神经网络方法进行建模,集成神经网络模型架构如图3,一共生成了100组神经网络模型,然后选取其中表现最好的10组模型组合成集成模型。集成模型的输出是由这10个最好的网络结果平均得到的。
2"测试结果与分析
2.1"数据集
本文中生理讯号的数据来源主要包括在台大医院(NTUH)、台大儿童医院(NTUCH)以及台大云林分院(NTUH Yun-Lin Branch),收集案例的年龄层设定于二十至八十岁范围之内。由研究人员详细的记录手术中病患的生理反应以及病患相关数据,药剂使用情况等,以及每五分钟写下MAC(Minimum Alveolar Concentration)值,以达到手术过程中的事件纪录完整性。
手术房中收集生理讯号时所使用的设备包含了生理讯号监测器IntelliVue MP60,以及PC端用数据收集软件对生理讯号进行收集,收集的讯号里包含了脑电波、心电图、血氧浓度、血压、主动脉血压以及当下时间。
共收集了122组由IntelliVue MP60病人监测器输出的心电图案例当作实验对象,IntelliVue MP60中的心电图取样频率为512 Hz,值得说明的是:IntelliVue MP60设备采集器可以收集基本的生理讯号、血氧浓度、心电图、血压、呼吸频率等生理讯号,也可以随时安装可拆式讯号模块,通过可拆式讯号模块监测不同的讯号,例如:脑电波BIS模块。
2.2"自主神经活性指标实验结果分析
自主神经活性指标主要目的是用来监测病人在全身麻醉时的麻醉深度,图4(a)为实验中的一种自主神经活性指针数据,从图4(a)中可以清楚看到病人在清醒与麻醉之间的状态转换。
在专家评估的意识清醒程度分析方面,当收到专家评估的意识清醒程度的扫描图文件时,将专家评估的意识清醒程度数字化,并将5位麻醉医师所画的专家评估意识清醒程度进行平均,其结果如图4(b)所示,图中所示的自主神经活性指标与专家评估的意识清醒程度指标为同一组数据。
需要指出的是:在案例收集方面,本研究于2016年共收集了122组案例,在收案过程中会有过多的噪声干扰以及存盘有问题的案例,导致无法分析,扣除上述所说的案例后共分析了110组的案例数据,并将110组自主神经活性指标与专家评估的意识程度指标进行相关系数比对,如图5所示,同时也统计了110组案例的相关系数分布情况以及平均值。
2.3"灵敏度与特异度分析结果
利用灵敏度和特异度进行实验发现,自主神经活性指标在临床上是否具有麻醉深度的监测效果,以专家评估的意识清醒程度指标作为判断标准,并利用20组经由人工神经网络集成法回归前与回归后得自主神经活性指标进行灵敏度(Sensitivity)、特异度(Specificity)及准确度(Accuracy)的分析,实验结果如表2所示。
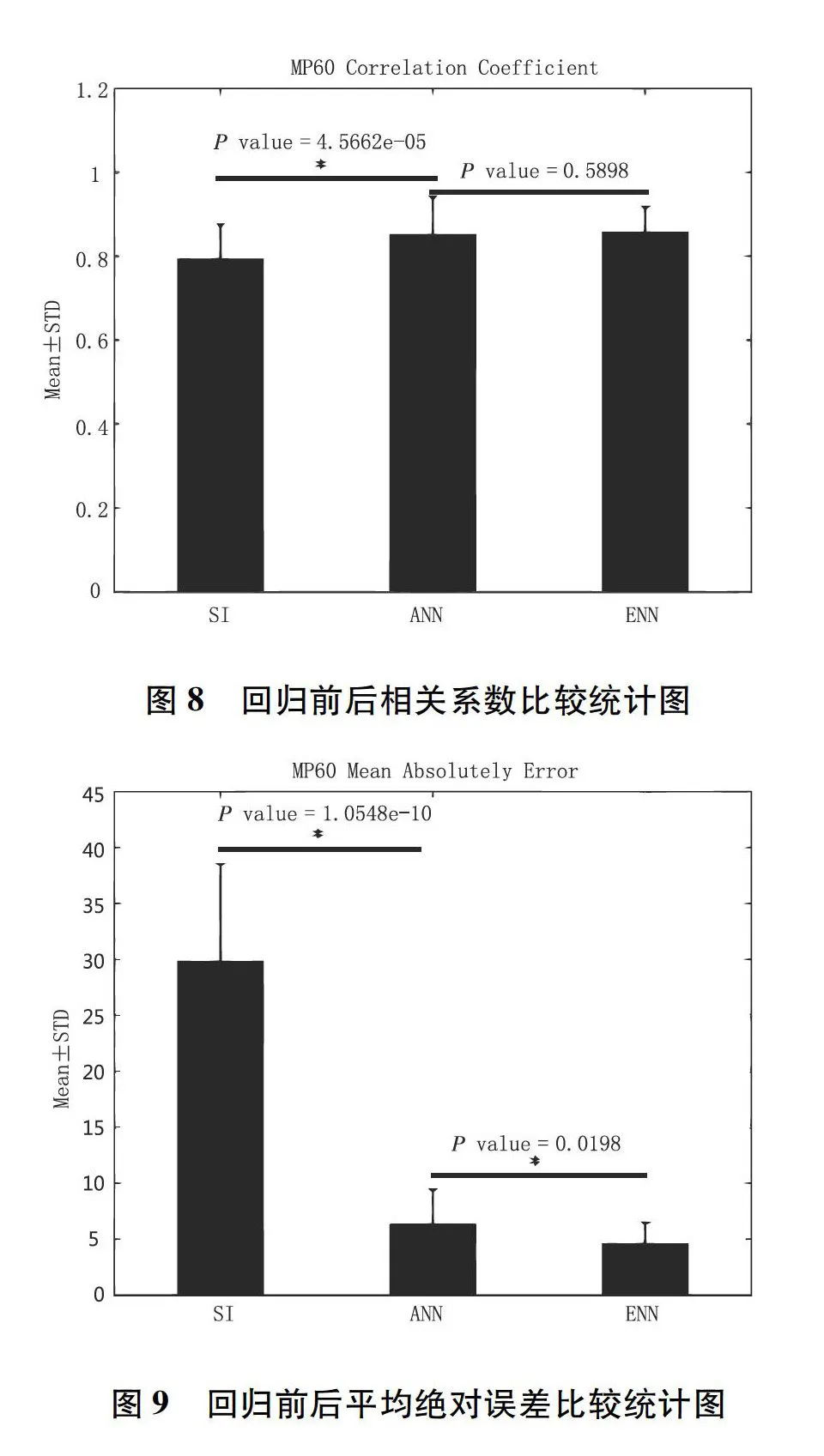
使用统计分析方法发现,对分析出的自主神经活性指针经由人工神经网络集成法回归前与回归后结果暨专家所评估的意识清醒程度进行比较,比较结果如图6、7所示(*代表该群组与上个群组比较后的显著差异)。
2.4"人工神经网络分析结果
此次的人工神经网络训练方法在110组数据当中挑选出自主神经活性指标与专家评估意识清醒程度的相关系数高于0.3的案例,统计后共105组,将这105组案例分成了两个部分进行分析,其中的85组数据通过人工神经网络分析建立模型样本,而剩下的20组数据则拿来做额外测试。
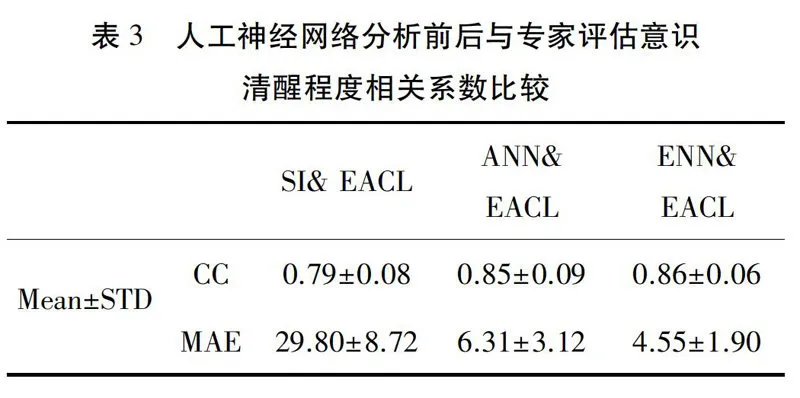
在人工网络神经中以专家评估意识清醒程度作为训练目标,接着以自主神经活性指标作为输入数值,进行权重值模型建立,图5为自主神经活性指标暨自主神经活性指针经由人工神经网络分析后的数值与专家评估之意识清醒程度比较,在图5中我们可以看到,当自主神经活性指针通过人工神经网络分析后数值更接近专家评估之意识清醒程度指标,效果相当显著,同时我们也将剩下的20组自主神经活性指针数据通过人工神经网络计算后的数值,与专家评估之意识清醒程度指针进行相关系数与平均绝对误差的计算(见表3)。
在进行人工神经网络建立模型时,采用了85组数据当中的70%当作训练数据、20%当作验证数据以及10%当作测试数据,而这些数据将由Matlab内部程序随机挑选,将重复10遍同样的人工神经网络训练方法建立出10组模型,并将额外20组数据进行人工神经网络回归,并将10组所得到的结果进行平均得到结果,如表3所示。
由表3实验结果显示,当自主神经活性指针经由人工神经网络分析后的相关系数平均值正负标准偏差从原本的0.79±0.08上升至0.85±0.09,而平均绝对误差的平均值正负标准偏差更从29.80±8.72下降至6.31±3.12,结果显示自主神经活性指针经由类神经网络分析后与专家评估意识清醒程度指标相似度提高。同时,在经由人工神经网络集成法回归后的数值之相关系数结果与人工神经网络的相关系数结果非常接近,平均绝对误差由原来的6.31±3.12下降至4.55±1.91。比较经由人工神经网络回归前后的数据是否具有显著差异,如图8,9(图中*号代表两组之间具有显著差异, Plt;0.05),在分析结果自主神经活性指标暨专家所评估意识清醒度的相关系数与透过ANN回归后的相关系数有显著差异,但ANN回归后之数据以及ENN回归后之数据结果皆不具显著差异,而在平均绝对误差中分析的数据与透过ANN回归后之数据有显著差异,在ANN回归后及ENN回归后之平均绝对误差中,同样有显著差异。
3"结论
麻醉深度一直是临床医学上麻醉医师关注的议题,然而麻醉深度以及麻醉状态的定义是随着麻醉学与神经学不断发展而变化的,由于先前的麻醉深度都以脑电波为主,但价格昂贵,所以本文进行了心电图的麻醉深度分析。
本文利用85组案例进行模型的建立,并利用额外20组案例进行测试,测试经由人工神经网络回归前与回归后的结果比较,分析结果显示自主神经活性指针经由人工神经网络回归后结果有显著提高,证明本文所提方法的有效性。此外,本文也使用人工神经网络集成法与人工神经网络进行比较,证明人工神经网络集成法可有效地解决人工神经网络初始权重不稳定的问题。在灵敏度和特异度分析结果显示回归后之自主神经活性指针比回归前的数据要更接近专家所评估之意识清醒程度指标,经由以上验证方法证明人工神经网络是有效的。在灵敏度和特异度分析结果中我们可以发现,SEN的准确度远低于SPE及ACC准确度,意味着此指标目前在判断麻醉医师施予病人麻醉药时的状态以及恢复清醒状态时,准确率远低于手术过程中的稳定麻醉状态,未来可以继续朝该方向进行自主神经活性指标的调整。
参考文献:
[1]Thornton C, Jones J G. Evaluating depth of anesthesia:review of methods.[J]. International Anesthesiology Clinics, 1993, 31(4):67-88.
[2]Rosow C, Manberg P J. Bispectral index monitoring[J]. Anesthesiol Clin North America, 2001, 19(4):947-966.
[3]Huang H H, Lee Y H, Chan H L, et al. Using a short-term parameter of heart rate variability to distinguish awake from isoflurane anesthetic states.[J]. Medical amp; Biological Engineering amp; Computing, 2008, 46(10):977-984.
[4]Malik M, Bigger J T, Camm A J, et al. Heart rate variability[J]. Clinical Cardiology, 2010, 13(8):570-576.
[5]Fleisher L A, Pincus S M, Rosenbaum S H. Approximate entropy of heart rate as a correlate of postoperative ventricular dysfunction[J]. Anesthesiology, 1993, 78(4):683-692.
[6]Kamath M V, Fallen E L. Power spectral analysis of heart rate variability:a noninvasive signature of cardiac autonomic function[J]. Critical Reviews in Biomedical Engineering, 1993, 21(3):245.
[7]Akselrod S, Gordon D, Ubel F A, et al. Power Spectrum Analysis of Heart Rate Fluctuation:A Quantitative Probe of Beat-To-Beat Cardiovascular Control[J]. Science, 1981, 213(4504):220-222.
[8]Berger R D, Akselrod S, Gordon D, et al. An efficient algorithm for spectral analysis of heart rate variability[J]. IEEE transactions on bio-medical engineering, 1986, 33(9):900-904.
[9]Iliev I, Krasteva V, Tabakov S. Real-time detection of pathological cardiac events in the electrocardiogram[J]. Physiological Measurement, 2007, 28(3):259.
[10]Huang H H, Lee Y H, Chan H L, et al. Using a short-term parameter of heart rate variability to distinguish awake from isoflurane anesthetic states.[J]. Medical amp; Biological Engineering amp; Computing, 2008, 46(10):977-984.
[11]Sadrawi M, Fan S Z, Abbod M F, et al. Computational Depth of Anesthesia via Multiple Vital Signs Based on Artificial Neural Networks.[J]. Biomed Res Int, 2015(1):536863.
(责任编辑:曾"晶)
