全垂体功能减退合并肝硬化3例及文献综述*
2018-04-28袁仙仙阳洪波王林杰朱惠娟
袁仙仙 陈 适,2 阳洪波,2 王林杰 潘 慧,2 朱惠娟,2△
(1中国医学科学院,北京协和医学院,北京协和医院内分泌科,国家卫生健康委员会内分泌重点实验室,协和转化医学中心,北京 100730;2中国生长发育行为医学研究中心,济宁 272029)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指排除酒精和其他明确损伤肝脏因素所致的,以肝细胞脂肪变性为主要特征的临床病理综合征,其疾病谱从非酒精性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)到肝纤维化,严重者可发展为肝硬化[1]。回顾性研究显示下丘脑-垂体疾病患者NAFLD发病率较普通人群显著升高[2-5],垂体功能减退患者腹部超声脂肪肝检出率为77%,明显高于对照人群的12%[5]。大部分研究认为生长激素缺乏(growth hormone deficiency,GHD)在NAFLD的发生发展中发挥重要作用[5-7],但这部分患者GHD的原因多为垂体发育不良、鞍区肿瘤、手术或放疗等,多合并多种垂体激素缺乏。本文总结北京协和医院内分泌科收治的3例全垂体功能减退合并肝硬化患者临床特点,并复习国内外相关文献,探讨全垂体功能减退对NAFLD的影响。
1 病例资料
病例1,女,24岁。患者2001年春(7岁)开始出现多尿多饮,2002年12月(9岁1月)临床诊断为颅内生殖细胞肿瘤,予以放射治疗,同时存在全垂体功能减退。但患者一直未规律随诊及激素替代治疗。2014年开始出现鼻衄,逐渐出现牙龈出血、皮肤黏膜出血,伴纳差、乏力。2016年11月就诊于北京协和医院内分泌科。查体:BMI 24.6kg/m2,可见巩膜黄染,右球结膜出血。辅助检查:1)全垂体功能减退(表1)。2)血常规示白细胞减少、血小板减少;凝血功能异常;肝功能异常(图1);肝纤维化指标升高:HA 403.8ng/ml,PⅢP 17ng/ml,CⅣ412ng/ml;腹部超声:肝实质回声增粗,脂肪肝、脾大;腹部常规MRI:肝硬化改变、脾大。3)代谢方面存在血脂异常(表1)。暂无病毒性肝炎、自身免疫性肝炎、遗传性代谢性肝病等证据,考虑肝脏病变与垂体功能减退相关,开始予强的松龙、L-T4、弥凝规律替代治疗。食欲、体力较前改善,无鼻衄等出血倾向。半年后复查肝功能较前稍有改善(图1),肝纤维化指标较前明显下降:HA 197.8ng/ml、PIIIP 13.8ng/ml、CIV276.3ng/ml;腹部超声:轻度脂肪肝、脾大。
病例2,男,25岁。2012年3月(20岁)开始出现多尿、多饮,逐渐出现双眼视野缺损。2012年6月诊断为颅咽管瘤,行鞍区占位病变切除术;2015年1月因肿瘤复发行放射治疗。术后出现全垂体功能减退,开始不规律糖皮质激素、甲状腺激素替代治疗。2016年10月开始出现腹胀伴颜面部及下肢水肿,外院骨穿提示脾功能亢进;腹部CT示肝硬化、脾大、腹水。2017年5月就诊于北京协和医院内分泌科。查体见肥胖体型,BMI 30.9kg/m2。辅助检查:1)全垂体功能减退(表1)。2)血常规示三系减少;凝血功能异常;肝功能异常(图1);肝纤维化指标升高:HA 236.9ng/ml、PIIIP 11.2ng/ml、CIV 90.6ng/ml、LN 76ng/ml;腹部增强CT+门静脉三维重建:考虑肝硬化、脾大、门脉高压。3)代谢方面:GLU 4.6mmol/L,空腹胰岛素 42.84μIU/mL,HbA1C 9%,同时有血脂异常、高尿酸血症(表1)。诊断为肝硬化(Child-Pugh B级),除外其他病因导致的肝脏病变,考虑与垂体功能减退相关。开始规律氢化可的松、L-T4、弥凝替代治疗,复查肝功能较前稍有改善(图1)。
病例3,男,27岁。1996年(5岁)左右开始出现多尿、烦渴、多饮。2003年(12岁)左右出现视力下降、视野缺损,外院临床诊断为颅内生殖细胞肿瘤,予以放射治疗,同时有全垂体功能减退,但患者一直未规律随诊及激素替代治疗。2009年开始出现鼻衄,2013年12月因进食硬食后出现呕血就诊于外院,诊断为“上消化道出血”,肝脏穿刺活检为“活动性肝硬化,活动期”。2014年3月就诊于北京协和医院内分泌科。查体:BMI 27.7kg/m2,贫血貌,可见肝掌、蜘蛛痣。辅助检查:1)全垂体功能减退(表1)。2)血常规示三系减少;肝功能异常(图1);腹部CT平扫+增强:肝硬化可能,脾大,食管-胃底静脉曲张,腹腔积液。3)代谢方面存在血脂异常(表1)。诊断为肝硬化,除外其他病因,考虑肝脏病变与全垂体功能减退有关,开始规律氢化可的松、L-T4、弥凝替代治疗,2015年11月加用雄激素。复查肝功能无明显进展。见图1。

表1 北京协和医院3例患者垂体功能及代谢指标
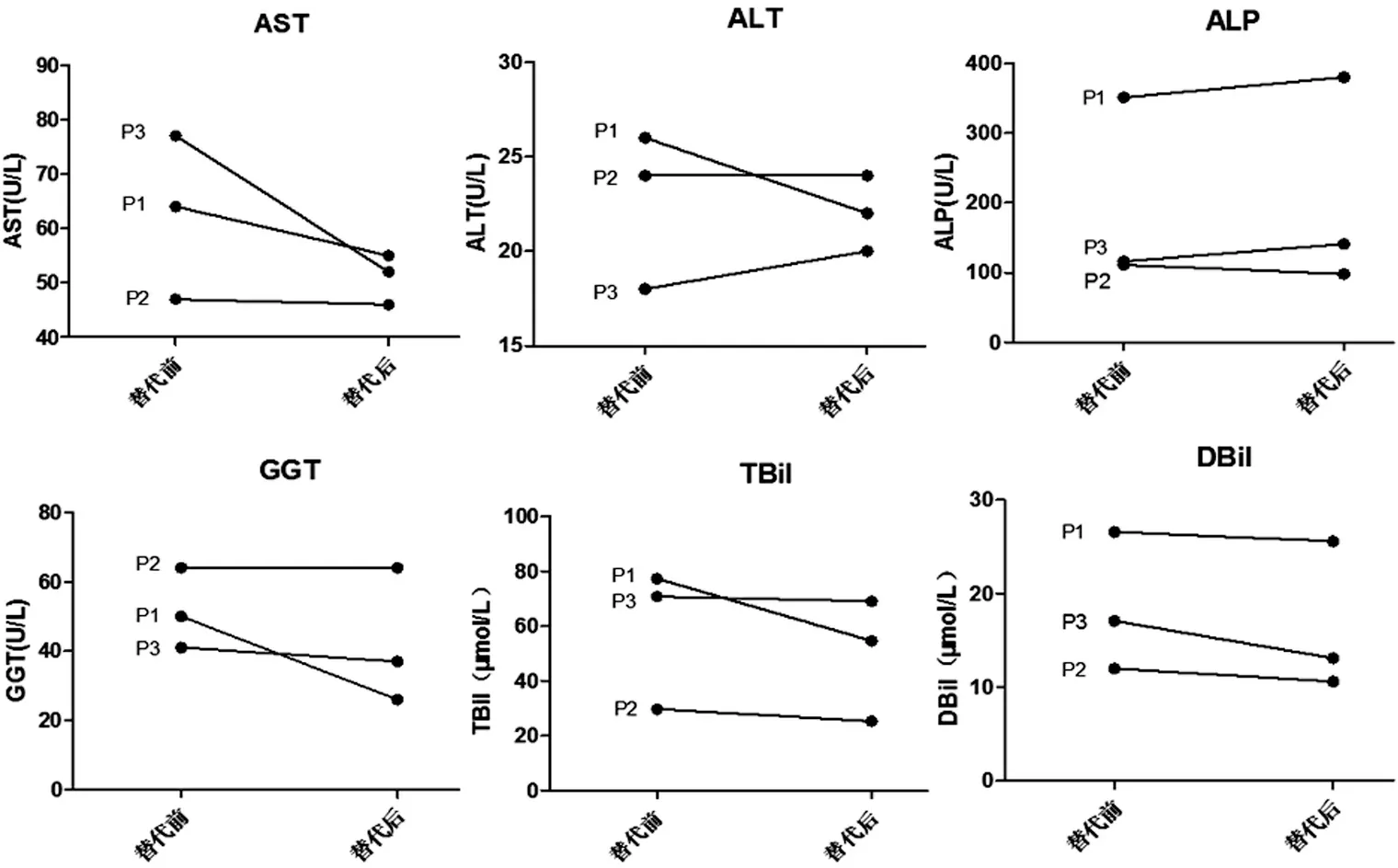
注:P1为病例1,P2为病例2,P3为病例3
图1 3例患者规律激素替代治疗前后肝功能指标变化
2 文献复习
以“垂体功能减退”或“垂体前叶功能减退”或“全垂体功能减退”和“非酒精性脂肪肝”或“NAFLD”或“肝硬化”作为关键词,通过万方数据库和中国知网数据库对2017年7月前发表的中文文献进行检索;以“hypopituitarism” OR “panhypopituitarism” AND “nonalcoholic fatty liver disease” OR “NAFLD” OR “nonalcoholic steatohepatitis ” OR “NASH” OR “cirrhosis”作为关键词,通过PubMed数据库检索2017年7月前发表的所有英文文献。共检索到中文文献0篇,英文全文文献24篇,阅读文献排除肝脏病变继发出现垂体功能减退、全身系统性疾病累及垂体和肝脏、新生儿及儿童的相关报道,最终保留文献17篇,其中病例报告10篇、论著4篇(见表2)、综述2篇、Letter1篇。10篇病例报告中11例患者,其中男性10例,女性1例,平均(24.4±9.5)岁。其中5例患者为垂体前叶功能减退,6例为全垂体功能减退。11例患者中接受GH、糖皮质激素、甲状腺激素、性激素替代的人数分别为1例、3例、4例和2例。诊断为肝硬化7例(64%),其中6例为肝脏组织活检病理证实,另外1例依据临床诊断。4篇论著报道的垂体功能减退患者NAFLD的患病率为2.4%~77.3%[27],Adams[2]及Nyenwe等[4]的研究均为回顾性研究,并未对所有垂体功能减退患者进行NAFLD相关筛查,此外,Hong等[3]和Nishizawa等[5]的研究纳入的人群平均年龄偏大,可能是前两篇文章垂体功能减退患者NAFLD的患病率较另外两篇文章低的原因。Nishizawa等[5]的研究中16例患者行肝脏穿刺活检,仅1例证实为肝硬化(6%),远低于10篇病例报道中肝硬化患者的比例(64%)。分析两组人群病例特点,Nishizawa等[5]的研究纳入的患者均接受了除GH外的其他激素替代治疗,而病例报道的11例患者绝大部分未接受激素替代。另外,Nishizawa H将垂体功能减退患者分为伴有和不伴有NAFLD两组,伴有NAFLD组BMI、内脏脂肪面积、空腹胰岛素水平及HOMA-IR均显著高于不伴有NAFLD组,而HDL-C水平显著低于不伴有NAFLD组。但Hong等[3]的研究中BMI、腰围、HOMA-IR及HDL-C两组之间均无显著性差异。

表2 垂体功能减退合并NAFLD的相关论著
*为诊断NAFLD时的年龄。
3 讨论
非酒精性脂肪肝(NAFLD)目前已成为慢性肝脏疾病最常见的病因,多重打击假说认为饮食和环境等因素导致肝脏脂肪沉积,通过诱发线粒体功能障碍、内质网应激、细胞因子失调等,引起肝脏炎症反应,进而导致肝星形细胞活化、纤维化,胰岛素抵抗、促炎细胞因子、细胞凋亡在NAFLD进程中发挥重要的作用[8]。代谢综合征、肥胖、2型糖尿病、高脂血症等代谢性疾病是NAFLD的常见危险因素。垂体功能减退患者常伴有代谢综合征样的症状及体征,包括中心性肥胖、胰岛素抵抗和血脂异常等,NAFLD的发病率也显著高于普通人群[2-5]。
目前大部分研究重点关注GH对NAFLD的作用,动物研究显示,特异性敲除小鼠肝脏GH受体可导致胰岛素抵抗、糖耐量异常以及严重的肝脏脂肪变[9]。应用IGF-1和GH治疗可改善GHD小鼠脂肪性肝炎[10],GHD患者GH替代治疗也可降低肝酶水平,改善肝脏病变[5-6]。大部分研究纳入的患者单纯GHD少见,多合并其他垂体前叶激素缺乏。本文3例患者以及病例报道的11例患者肝脏病变较重,肝硬化的发生率高且发生年龄相对较早。总结发现这14例患者均为垂体多种激素缺乏伴或不伴有中枢性尿崩症,且未规律激素替代。本文3例患者,经过除GH之外的其他激素替代后,肝脏功能有不同程度的好转。提示垂体多种激素缺乏较单纯GHD更易出现NAFLD,且更快进展为肝硬化。
甲状腺激素及性激素均参与糖脂及能量代谢,与NAFLD相关[11]。另外,糖皮质激素可以直接促进肝脏脂肪从头合成和游离脂肪酸的利用,并且可以促进网膜脂肪组织的分解,进而增加门脉运输至肝脏的游离脂肪酸含量,最终促进肝脏脂肪变。Adeeba等[12]提出NAFLD不同阶段肝脏局部11β羟类固醇脱氢酶及5α还原酶活性不同,在NAFLD早期,肝脏局部糖皮质激素生成减少,清除占优势,以减少肝脏脂肪沉积。随着疾病的进展,肝脏损伤以及炎症状态的恶化,肝脏局部糖皮质激素水平增加,以最大化糖皮质激素抗炎作用对肝脏的保护。本文3例患者以及个案报道中的大部分患者均未接受规律的糖皮质激素替代治疗。NAFLD早期糖皮质激素缺乏可能是一种保护,但进展到较严重的NASH阶段,由于糖皮质激素缺乏,肝脏局部糖皮质激素水平不能相应的增加,抗炎作用降低,从而导致肝脏病变的进一步恶化,甚至进展为肝硬化。
此外,本文3例患者均有中枢性尿崩症,其中1例还存在渴感中枢受损。中枢性尿崩症患者血渗透压通常位于正常偏高水平,若同时合并渴感受损,造成严重的高钠血症及高渗状态。血浆渗透压稳态是维持细胞正常功能所必需的,渗透压改变引起细胞体积的变化可激活调节代谢和基因表达的信号通路[13]。胰岛素信号通路中的某些组分例如蛋白激酶B对渗透压敏感,血浆高渗可抑制3T3-L1脂肪细胞胰岛素诱导的葡萄糖摄取、糖原合成和脂肪合成,引起胰岛素抵抗;并且血浆高渗时细胞皱缩可诱发细胞自噬[13]。因此,中枢性尿崩症引起的渗透压改变也促进了NAFLD的进展。
综上所述,垂体功能减退患者由于GH、甲状腺激素、性腺激素缺乏,易发生中心性肥胖、胰岛素抵抗、高脂血症等代谢异常,肝脏脂肪沉积增加,随着疾病的进展,肝脏病变由脂肪变发展为NASH,由于糖皮质激素缺乏,肝脏局部抗炎作用降低,肝脏保护作用下降,易进展为更加严重的肝纤维化甚至肝硬化。若合并中枢性尿崩症,血浆渗透压的变化更加重了NAFLD的进展。因此,垂体功能减退患者更加强调规律激素替代及随诊[14],随访过程中不仅要进行生化检查监测肝功能,还需要对NAFLD进行相关影像学筛查。
参考文献:
[1] Harker M,Carvile S,Floros L,et al.Non-alcoholic fatty liver cisease:assessment and management[M].London:National Institute for Health and Care Excellence(UK),2016.
[2] Adams LA,Feldstein A,Lindor KD,et al.Nonalcoholic fatty liver disease among patients with hypothalamic and pituitary dysfunction[J].Hepatology,2004,39(4):909-914.DOI:10.1002/hep.20140.
[3] Hong JW,Kim JY,Kim YE,et al.Metabolic parameters and nonalcoholic fatty liver disease in hypopituitary men[J].Horm Metab Res,2011,43(1):48-54.DOI:10.1055/s-0030-1265217.
[4] Nyenwe EA,Williamson-Baddorf S,Waters B,et al.Nonalcoholic Fatty liver disease and metabolic syndrome in hypopituitary patients[J].Am J Med Sci,2009,338(3):190-195.DOI:10.1097/MAJ.0b013e3181a84bde.
[5] Nishizawa H,Iguchi G,Murawaki A,et al.Nonalcoholic fatty liver disease in adult hypopituitary patients with GH deficiency and the impact of GH replacement therapy[J].Eur J Endocrinol,2012,167(1):67-74.DOI:10.1530/EJE-12-0252.
[6] Matsumoto R,Fukuoka H,Iguchi G,et al.Long-term effects of growth hormone replacement therapy on liver function in adult patients with growth hormone deficiency[J].Growth Horm IGF Res,2014,24(5):174-179.DOI:10.1016/j.ghir.2014.07.002.
[7] Zhang ZX,Liu YK,Pan H,et al.The effect of polyethylene glycol recombinant human growth hormone on growth and glucose metabolism in hypophysectomized rats[J].Growth Horm IGF Res,2012,22(1):30-35.DOI:10.1016/j.ghir.2011.12.002.
[8] Buzzetti E,Pinzani M,Tsochatzis EA.The multiple-hit pathogenesis of non-alcoholic fatty liver disease(NAFLD)[J].Metabolism,2016,65(8):1038-1048.DOI:10.1016/j.metabol.2015.12.012.
[9] Fan Y,Menon RK,Cohen P,et al.Liver-specific deletion of the growth hormone receptor reveals essential role of growth hormone signaling in hepatic lipid metabolism[J].J Biol Chem,2009,284(30):19937-19944.DOI:10.1074/jbc.M109.014308.
[10] Nishizawa H,Takahashi M,Fukuoka H,et al.GH-independent IGF-I action is essential to prevent the development of nonalcoholic steatohepatitis in a GH-deficient rat model[J].Biochem Biophys Res Commun,2012,423(2):295-300.DOI:10.1016/j.bbrc.2012.05.115.
[11] Hoffmann A,Müller HL.Novel perspectives on hypothalamic-pituitary dysfunction as a risk factor for non-alcoholic fatty liver disease[J].Minerva Endocrinol,2017,42(2):132-144.DOI:10.23736/S0391-1977.16.02500-1.
[12] Ahmed A,Rabbitt E,Brady T,et al.A switch in hepatic cortisol metabolism across the spectrum of non alcoholic fatty liver disease[J].PLoS One,2012,7(2):e29531.DOI:10.1371/journal.pone.0029531.
[13] Schliess F,Hussinger D.Osmosensing and signaling in the regulation of liver function[J].Contrib Nephrol,2006,152:198-209.DOI:10.1159/000096324.
[14] Yang HB,Zhang MQ,Pan H,et al.Management of adult growth hormone deficiency at Peking Union Medical College Hospital:a survey among physicians[J].Chin Med Sci J,2016,31(3):168-172.
