鲁西南地区矮小症儿童染色体核型分析*
2018-04-28孙海玲汲宝兰张艳红
孙海玲 张 梅 潘 慧 汲宝兰 张艳红 班 博△
(1济宁医学院附属医院内分泌科,2中国生长发育行为医学研究中心,济宁 272029;3北京协和医院内分泌科,北京 100730)
矮小症是指生活在相似环境下,与同种族、同性别和同年龄健康儿童比较,身高低于正常平均身高2个标准差(-2SD),或低于生长曲线第3百分位[1]。有研究显示,染色体异常与儿童的生长发育存在重要相关性[2]。因此,本研究回顾分析195例矮小症儿童的染色体检查结果,从遗传学角度探索矮小症的病因,明确染色体核型分析在儿童矮小症诊断中的应用价值,为临床诊疗提供科学依据。
1 对象与方法
1.1 对象
选择2013年2月至2018年1月在济宁医学院附属医院内分泌科生长发育门诊及病房收治,来自鲁西南地区以矮小为主诉并符合矮小症诊断标准[1]的儿童195例,同时存在发育迟缓、性器官发育异常、女性青春期无月经来潮或不同程度的智力发育低下,均行染色体检查。年龄3~16岁,平均10.1岁,其中女童111例,男童84例。
1.2 方法
取得所有患儿及家长的知情同意,抽取患儿静脉血3ml,采用常规外周血淋巴细胞培养,应用G显带核型分析,油镜下计数40个分裂相,分析5个核型,若出现异常核型,加数至100个分裂相。
2 结果
在195例矮小症患儿染色体核型分析中,检出异常染色体核型 25例,检出率为12.8%(25/195),其中男性5例,女性20例。染色体多态性核型8例,占异常核型的 32.0%(8/25),包括染色体缢痕1例、随体增加1例、异染色质区增加3例、臂间倒位2例及平衡易位1例。性染色体异常16例,占异常核型的64.0%(16/25),其中Turner综合征14例,占异常核型56.0%(14/25),包括单体型45,X 6例,嵌合型45X/46XX 1例,染色体结构异常46,X,del(X)(p10)1例、46,X,i(X)(q10)3例,染色体数目与结构异常45,X/46,X,+mar 1例、45,X/46,X,i(X)(q10)1例、45,X/46,X,del(X)(p10)1例;45,X/46,X,del(Y)核型1例,占异常核型4.0%(1/25);Y染色体长度变异46,XY,Y≤21 1例,占异常核型4.0%(1/25)。性反转1例(46,XY女性),占异常核型4.0%(1/25)。见表1。
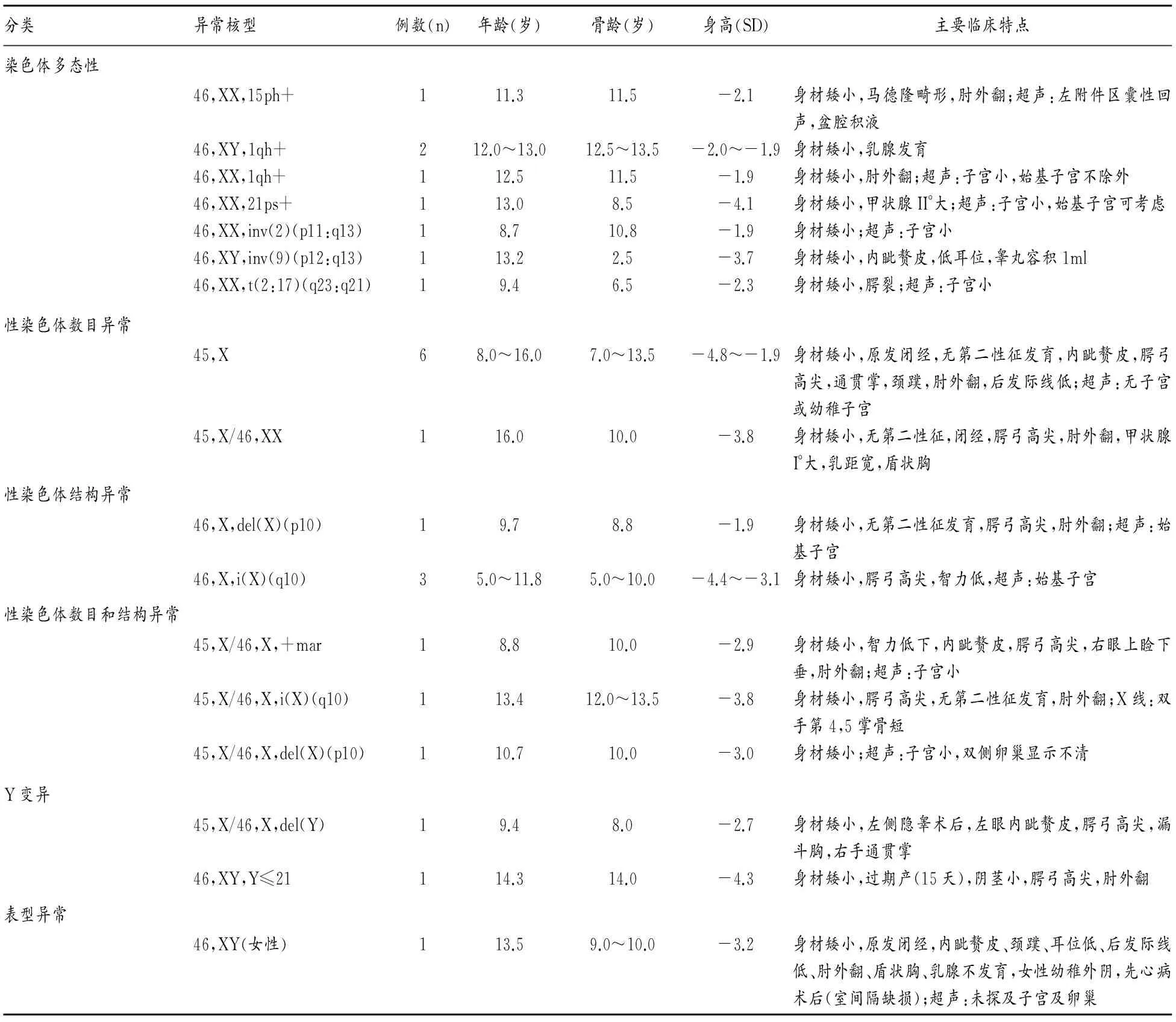
表1 矮小症异常染色体核型及临床特点
3 讨论
身材矮小与遗传因素、内分泌疾病、代谢性疾病、染色体畸变、精神心理因素、营养因素等多种原因密切相关[3]。本文对195例矮小症患儿进行染色体核型分析,发现异常核型25例,检出率为12.8%,与文献报道相似[4]。下面就异常染色体与身材矮小之间的关系进行探讨。
3.1 染色体的多态性
染色体的多态性是指生物种内个体之间各种染色体形态恒定的微小变异,表现为同源染色体结构和带纹强度的差异,包括染色体的异染色质区、缢痕、随体的增加或减少、染色体相互易位或臂间倒位[5]。本文共检出染色体多态性核型8例,占异常核型的32.0%(8/25),与文献报道相似[4]。
3.2 性染色体异常
3.2.1X染色体异常 矮小症最常见染色体疾病为Turner 综合征,即先天性卵巢发育不全,由于体细胞中一条X染色体完全或部分缺失所致,在新生女婴中的发病率约为1/2500[9]。90%以上的Turner综合征女童表现为身材矮小和卵巢功能不全(无第二性征和青春期无月经来潮),身高一般低于150cm,其他包括骨骼发育不良(如肘外翻和第四或第五掌骨短),心脏缺陷,面部特征异常(包括低发际线和低位耳),乳头间距宽,智力发育程度不一[10]。Turner 综合征染色体核型种类复杂,个体间临床表现差异大,这主要与核型异常的程度及异常核型与正常核型细胞系的比例有关[11]。正常核型占的比例越大,其临床异常表型越轻,因此对身高高于正常身高-2SD的嵌合型女童可能会存在漏诊。本文共检出Turner综合征14例,占异常核型的56%(14/25),其中包括单体型、嵌合型、染色体结构异常及染色体数目与结构异常。
单体型Turner综合征单一的X染色体通常来自母亲,失去的X染色体由于父亲的精母细胞性染色体不分离造成,在受精卵早期有丝分裂中,X染色体丢失也可以造成X单体型[12-13]。单体型由于X染色体上的多个基因单倍剂量不足,导致临床症状最典型,超声可见子宫发育小或始基子宫,卵巢发育差,无卵泡生成[12]。本文中6例单体型患儿,除表现为身材矮小外,无子宫或幼稚子宫、原发闭经、颈蹼、肘外翻及后发际线低等症状典型。
嵌合型是受精卵在某次有丝分裂中X染色体发生不分离,形成异常细胞,继续分裂后导致异常细胞系与正常细胞并存,由双亲之一为嵌合体直接传递给下一代导致嵌合型可能性较小[12]。嵌合型Turner综合征临床表现因嵌合比例不同而异。正常性染色体占多数,异常表型则较少;相反,若异常染色体占多数,典型的异常表型则较多。本文中发现45,X[18]/46,XX[42]1例,16岁患儿表现为身材矮小、原发闭经、无第二性征发育、腭弓高尖、肘外翻、乳距宽、盾状胸,但无明显异常面容、智力障碍等,与患者正常细胞系比例高有关。
X染色体结构异常也可以导致Turner 综合征的发生,常见的异常有缺失、倒位、等臂染色体等[14]。本研究发现3例46,X,i(X)(q10),为X染色体长臂等臂i(Xq),因长臂重复而短臂缺失,短臂上决定体征与性腺发育的基因缺失,导致患者既有Turner综合征表现,又有性腺发育不全、智力低下。本文发现1例46,X,del(X)(p10),为X染色体两臂的部分缺失,造成其相关基因的缺失,导致Turner 综合征症状出现。
X染色体数目伴结构异常多见于以45,X为主的嵌合型Turner 综合征患者。X染色体不同片段的缺失所造成的症状有所不同,身材矮小主要是由 X 短臂单体决定。本文中1例45,X/46,X,i(Xq)的患儿缺失 X 染色体短臂,另一例45,X/46,X,del(X)(p10)患儿缺失X染色体两臂的部分基因,所以均表现为典型的身材矮小、原发闭经及第二性征无发育,前者还表现为双手第4,5掌骨短。
综上所述,不论是X染色体数目还是结构异常都是导致女童身材矮小和性分化异常的重要病因。
3.2.2Y染色体异常 Y染色体数目减少在临床病例中相对少见,本文发现1例45,X/46,X,del(Y)男性患儿,除身材矮小外还表现为隐睾,因其部分染色体核型为 45,XO,缺少了Y染色体,且部分染色体核型为46,X,del(Y)致Y部分缺失,会影响睾丸发育和精子产生。本文还发现1例46,XY,Y≤21,为小Y,Y染色体长度变异是否会引起遗传异常一直存在争议,但越来越多的资料显示,Y染色体异常以及长度多态与某些遗传效应具有相关性,如小睾丸、隐睾、无精子、智力低下及配偶流产等。本例患者性发育异常仅表现为阴茎小,对将来生育情况也应加强随访。
本文中的2例Y染色体异常患儿均表现为身材矮小伴性发育异常,目前国内外文献中未见Y染色体异常与身材矮小相关的报道,需进一步行矮小相关基因检测明确矮小病因。
文山州东南部为短时强降水和雷电的高发区域,东部短时强降水活跃,是雷电低发但高强区;西部雷电和短时强降水均不突出;北部特别是西北部雷电高发但总体强度不大。
3.3 性反转
性反转为染色体性别和性腺性别不相符的疾病。本文发现1例 46,XY 的13岁女性。临床表现为身材矮小、内眦赘皮、颈蹼、耳位低、后发际线低、肘外翻、盾状胸、乳腺不发育、女性幼稚外阴,超声未见子宫和卵巢组织,双侧腹股沟区可见低回声结节,行腹股沟探查术,病理不支持睾丸组织,SRY基因检测阳性。SRY基因是决定男性性别的关键基因,是睾丸决定因子的最佳候选基因,SRY基因缺失、易位、基因突变均可引起染色体性别、性腺性别与表型性别的不一致,造成性分化异常[15]。本例女性患者SRY基因为阳性,但无睾丸、无子宫、无卵巢、乳房不发育、原发性闭经,需进一步做FISH检测或全外显子二代基因测序明确有无基因缺失、易位或突变等。
综上所述,矮小症病因较复杂,染色体异常是儿童身材矮小、性腺发育异常及异常体征的重要原因之一,所以对本地区矮小伴/或发育异常的儿童应常规进行细胞遗传学检查,早诊断、早治疗,改善其终身高及发育状况,提高其生活质量。
参考文献:
[1] 中华医学会儿科学分会内分泌遗传代谢学组.矮身材儿童诊治指南[J].中华儿科杂志,2008,46(6):20-21.
[2] Paramayuda C,Kartapradja H,Ambarwati DD,et al.Chromosome abnormalities in Indonesian patients with short stature[J].Mol Cytogenet,2012,5(1):35.DOI:10.1186/1755-8166-5-35.
[3] Sultan M,Afzal M,Qureshi SM,et al.Etiology of short stature in children[J].J Coll Physicians Surg Pak,2008,18(8):493-497.DOI:08.2008/JCPSP.493497.
[4] 罗小金,郭岩芸,朱自然,等.深圳地区身材矮小儿童染色体核型分析[J].中国优生与遗传杂志,2016,24(02):68-69,73.
[5] Wang H,Wang T,Yang N,et al.The clinical analysis of small supernumerary marker chromosomes in 17 children with mos 45,X/46,X,+mar karyotype[J].Oncol Lett,2017,13(6):4385-4389.DOI:10.3892/ol.2017.5965.
[6] Caglayan AO,Ozyazgan I,Demiryilmaz F,et al.Are heterochromatin polymorphisms associated with recurrent miscarriage[J].J Obstet Gynaecol Res,2010,36(4):774-776.DOI:10.1111/j.1447-0756.2010.01207.x.
[7] 罗小金,胡亮,杨艳,等.615例产前诊断羊水染色体异常与多态性核型分析[J].中国优生与遗传杂志,2015,(5):37-39.DOI:10.13404/j.cnki.cjbhh.2015.05.016.
[8] Naftalovich R,Pantin EJ,Denny JT.Intraoperative aortic dissection in a Turner syndrome patient[J].Heart Lung Vessel,2015,7(3):266-267.
[9] 李光玲,阳洪波,陈适,等.特纳综合征患者肝功能异常的高发生率及其影响因素[J].基础医学与临床,2016,(5):698-701.
[10] 吕翠君,阳洪波,陈适,等.特纳综合征患者早期雌激素替代治疗改善骨密度[J].基础医学与临床,2016,(5):694-697.
[11] Li N,Zhao L,Li J,et al.Turner syndrome caused by rare complex structural abnormalities involving chromosome X[J].Exp Ther Med,2017,14(3):2265-2270.DOI:10.3892/etm.2017.4756.
[12] Hook EB,Warburton D.Turner syndrome revisited:review of new data supports the hypothesis that all viable 45,X cases are cryptic mosaics with a rescue cell line,implying an origin by mitotic loss[J].Hum Genet,2014,133(4):417-424.DOI:10.1007/s00439-014-1420-x.
[13] Fragouli E,Alfarawati S,Spath K,et al.The origin and impact of embryonic aneuploidy[J].Hum Genet,2013,132(9):1001-1013.DOI:10.1007 /s 00439-013-1309-0.
[14] Chen X,Wang X,Dong G,et al.Clinical features of girls with short stature among inv(9),Turner(45,X)and control individuals[J].J Pediatr Endocrinol Metab,2017,30(4):431-436.DOI:10.1515/jpem-2016-0341.
[15] Shojaei A,Ebrahimzadeh-Vesal R,Ahani A,et al.Genetic screening of Iranian patients with 46,XY disorders of sex development[J].Rep Biochem Mol Biol,2017,6(1):59-65.
