利用ISSR和SRAP分子标记技术构建红优甜瓜指纹图谱*
2018-04-27张永平范红伟张文献顾海峰陈幼源
张永平范红伟张文献顾海峰陈幼源**
(1.上海市农业科学院园艺研究所,上海市设施园艺技术重点实验室,上海奉贤201403;2.上海市农业技术推广服务中心,上海闵行201103;3.上海市嘉定区农业技术推广服务中心,上海嘉定201800)
甜瓜(Cucumis melo L.)为葫芦科甜瓜属中的1个栽培种,是重要的经济作物,国内外广泛栽培。甜瓜在人工杂交制种过程中,因去雄不及时或不彻底,常混有母本自交系种子,同时甜瓜品种较为繁杂,且品种之间的植物形态非常接近,品种间的种子很难鉴别。传统的甜瓜种子鉴别方法是通过表型特征来判断,该方法耗时耗力;通过同工酶和种子蛋白电泳技术进行鉴别也受环境或甜瓜发育阶段等影响,存在较大的缺点。而分子标记技术检测的是在基因组DNA水平上的差异,不受外界环境的影响,因此检测结果非常稳定[1]。在已建立的分子标记技术中,ISSR(简单序列重复区间)标记是1种基于微卫星序列发展起来的十分有效的分子标记,具有模版需要量少、无需试剂盒、结果记录方便、试验成本低、操作简单、试验稳定性较高等优点[2]。Zhao等[3]利用ISSR标记构建了24个桑树品种的指纹图谱。SRAP(序列相关扩增多态性)是1种新型的基于PCR的标记系统,具有简便、稳定、中等产率、可产生共显性标记及便于克隆测序目标片段等特点,且扩增结果的多态性丰富[4],已被应用于图谱构建[5~6]。本研究采用ISSR和SRAP分子标记技术构建甜瓜杂交种红优及其亲本的DNA指纹图谱,同时进行了与红优相同类型的5个厚皮甜瓜品种的分子鉴别,旨在为保护研究者知识产权和消费者利益提供简便快捷的手段。
1 材料与方法
1.1 试验材料
甜瓜品种红优及其亲本种子,由上海市农业科学院园艺所提供;世农M103、精选红妃、雪红蜜和雪里红种子(与红优同为白皮红肉类型的厚皮甜瓜品种),于种子市场购得。试验所用的提取DNA、PCR试剂和琼脂糖均购自上海生工生物工程有限公司,其中SRAP和ISSR引物序列详见表1。
1.2 试验方法
1.2.1 DNA的提取及检测
采用改良过的CTAB法提取基因组DNA[7]。
1.2.2 PCR扩增及产物检测
SRAP扩增反应采用20 μL的反应体系,其中25 mmoL/L MgCl22.0 μL,10×PCR Buffer 2.0 μL,10 mmoL/L dNTP 0.4 μL,5 U/μL Taq DNA聚合酶0.2 μL,0.1 μmoL/L引物各3.0 μL,10ng/μL模板DNA 3.0 μL,灭菌双蒸水6.4 μL。反应程序:94℃预变性5 min;94℃变性1 min,35℃退火1 min,72℃延伸1.5 min,5个循环;94℃变性1 min,50℃退火1 min,72℃延伸1.5 min,35个循环;72℃延伸10 min后4℃保存[8]。
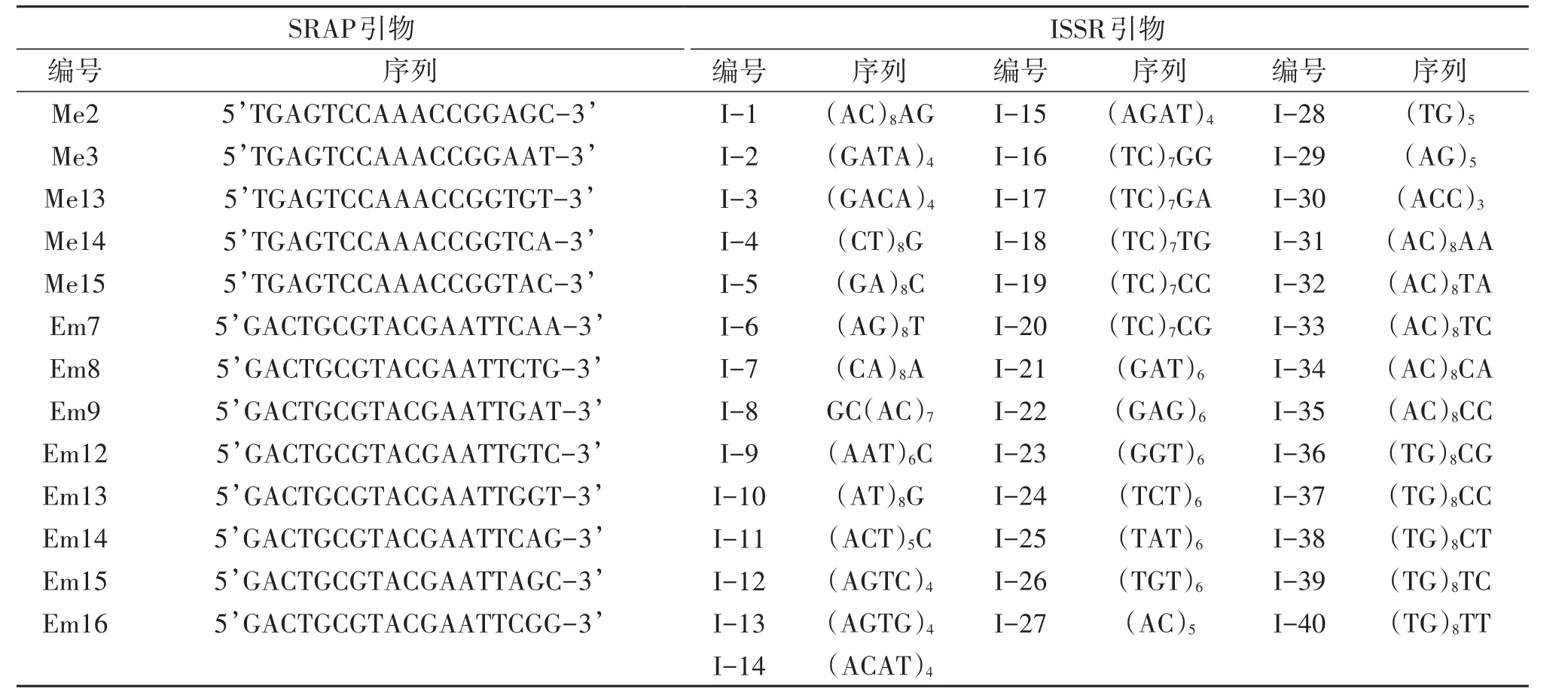
表1 SRAP和ISSR引物序列
ISSR扩增反应采用20 μL的反应体系,其中包含25 mmoL/L MgCl22 μL,10×PCR Buffer 2.0 μL,10 mmoL/L dNTP0.4 μL,5 U/μL Taq E 0.2 μL,10 ng/L模板DNA 3 μL,0.1 μmoL/L Primer 3 μL,灭菌双蒸水9.4 μL。扩增程序:94℃预变性5 min;94℃变性1 min,52℃退火1 min,72℃延伸1.5 min,35个循环,72℃延伸10 min后4℃保存[8]。
PCR扩增产物在2.0%琼脂糖凝胶(含EB)电泳分离,电压120 v,时间约1.5 h,Gel DocTMEQ 170-8060凝胶成像仪进行观察并拍照分析。
2 结果与分析
2.1 引物筛选
用40对SRAP和40个ISSR引物对供试材料进行PCR扩增,其中40对SRAP引物和15个ISSR引物均能得到较为稳定的扩增图谱,但大多数引物的扩增结果在双亲及杂种之间是一致的,不能起到鉴别作用。最终筛选出1对SRAP特异引物(Me15-Em8)和2个ISSR引物(I-8和I-19)可将杂交种与其父母本分开;同时筛选出1个ISSR引物(I-19)可以将5个厚皮甜瓜品种一次性区分开,且重复性好。
2.2 扩增结果分析

图1 不同引物对各参试厚皮甜瓜材料的扩增结果

表2 红优甜瓜及其父母本SRAP和ISSR扩增特异谱带
由图1和表2可知,两种标记共3个(对)引物(Me15-Em8、I-8和I-19)能在材料间表现出多态。SRAP引物Me15-Em8在约250 bp和280 bp处扩增出2条双亲的特异带,在F1中2条特异带也被扩增出来,表现出双亲间互补特征带;ISSR引物I-8在约500 bp和550 bp处扩增出2条双亲的特异带,在F1中2条特异带也均存在;ISSR引物I-19在约480 bp和700 bp处扩增出2条双亲的特异带,在F1中两条带均存在,而在F1中又扩增出1条约550 bp的特异带区别于父母本。由此可见,3个(对)引物均能对供试材料的双亲和F1进行有效鉴别。
通过ISSR引物I-19对5个相同类型的甜瓜品种进行扩增,扩增结果如图2和表3。在引物I-19指纹图谱中,红优比其他品种多1条约480 bp带,即特异性标记为I-19-480 bp;世农M103比其他品种多1条约700 bp带,即特异性标记为I-19-700 bp;雪里红比其他品种多1条约280 bp带,即特异性标记为I-19-280 bp;精选红妃、红优和雪里红比雪红蜜和世农M103两个品种多1条约650 bp带,而红优、雪里红和世农M103分别有特异标记I-19-480 bp、I-19~280 bp和I-19-700 bp。因此,可用I-19-650 p、I-19-480 bp和I-19-280 bp鉴别精选红妃,可用I-19-650 p和I-19-700 bp鉴别雪红蜜。
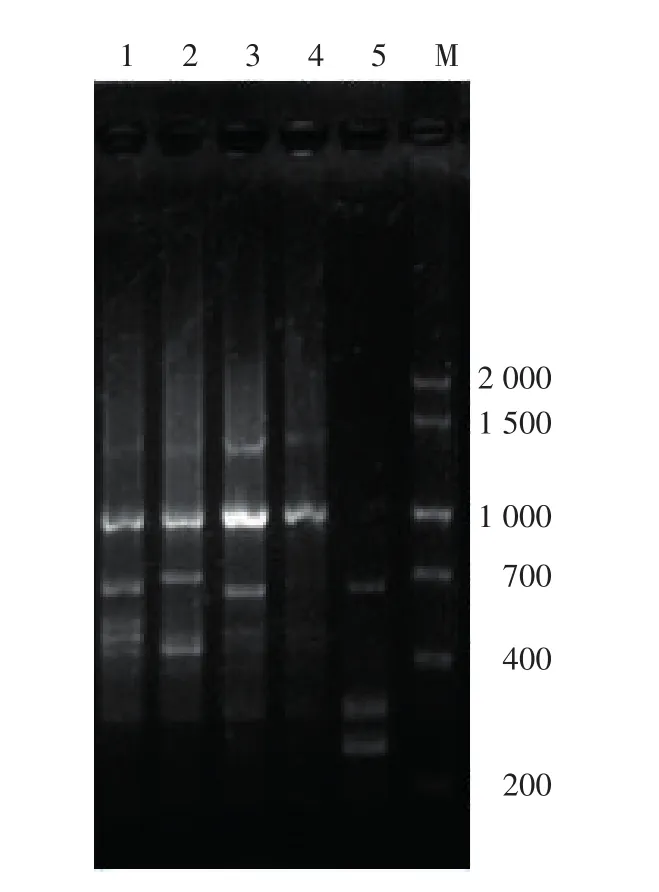
图2 ISSR引物I-19对5个甜瓜品种的扩增结果
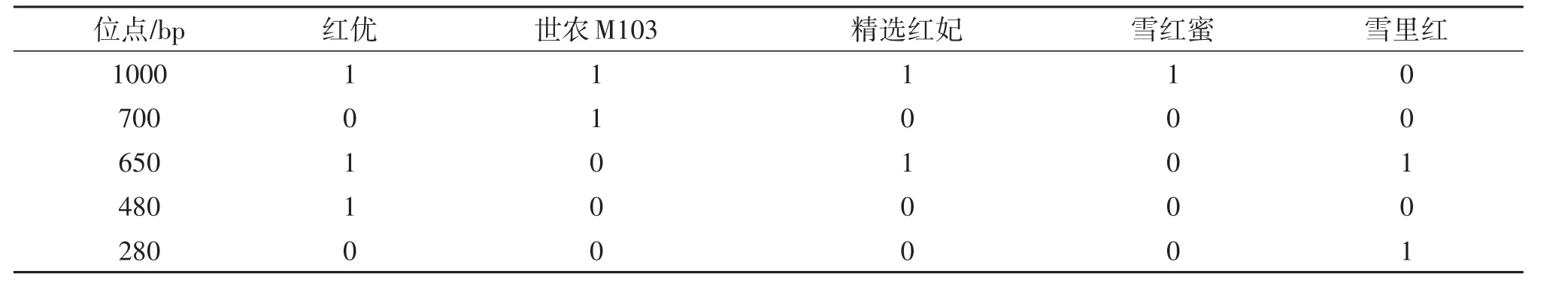
表3 引物I-19对5个甜瓜品种ISSR扩增特异谱带
3 讨论
当前农业生产中,品种混杂退化现象普遍,如假种混入种子市场,育种专家的权益和农民的利益则会受到严重损害。目前许多园艺植物育种所使用的材料越来越集中于少数优良品种或品系,使得选育出的新品种在更多的性状上更加相似,难以区分。现代分子生物学的发展为建立快速、准确、实用的种子质量鉴定体系提供了技术支撑,基因分子标记的作物DNA指纹图谱分析技术应运而生,并取得了快速发展。在已建立的分子标记技术中,ISSR和SRAP分子标记技术通常都是显性或共显性标记[9],所以父母本具有的特征带在杂种F1代中通常也能表现出来。通过检测F1代是否出现双亲的特异带进行杂种鉴定,目前已被广泛应用于多种作物的种子纯度鉴定[10~12]。本试验成功筛选出1对SRAP引物和2个ISSR引物,可扩增出红优甜瓜双亲的互补特征带。因此,两种标记技术均适用于甜瓜的指纹图谱构建,都能有效鉴别甜瓜品种双亲及其杂种F1,可用于杂种纯度鉴定。同时,在本研究中仅用1个ISSR引物即可鉴别出与红优相同类型的5个甜瓜品种,充分体现了ISSR技术的高效性,为红优甜瓜品种鉴别提供了有效、可靠的方法,在分子水平上为该品种的知识产权提供了技术保障。
[1]贾继增.分子标记种质资源鉴定和分子标记育种[J].中国农业科学,1999,29(4):1~10.
[2]丁明忠,潘光堂,张中华,等.用ISSR分析四川苎麻品种(系)间的遗传关系及雄性不育分子标记的建立[J].核农学报,2008,22(2):183~187.
[3]Zhao W G,Miao X X,Zang B,et al.Construction of fingerprinting and genetic diversity of mulberry cultivars in China by ISSR markers[J].Acta Genetica Sinica,2006,33(9):851~860.
[4]Li G,Quiros C F.Sequence related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103:455~461.
[5]王刚,潘俊松,李效尊,等.黄瓜SRAP遗传连锁图的构建及侧枝基因定位[J].中国科学C辑,2004,4(6):510~516.
[6]张平湖,刘冠明.粤东地区果梅主栽品种的SRAP标记多态性分析及指纹图谱构建[J].贵州农业科学,2010,38(6):27~29.
[7]张永平,朱为民,崔辉梅.上海地区番茄烟粉虱传双生病毒PCR检测[J].上海农业学报,2007,23(4):100~101.
[8]马金骏.不结球白菜种质资源遗传多样性的初步研究[D].2008:27.
[9]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
[10]刘冲,葛才林,任云英,等.SRAP、ISSR技术的优化及在甘蓝类植物种子鉴别中的应用[J].生物工程学报,2006,22(4):657~661.
[11]刘泽发,孙小武,董亚静.SRAP标记鉴定西瓜种子纯度方法研究[J].中国瓜菜,2009(1):5~8.
[12]胡汉娇,邢姗姗,郭建夫,等.利用RAPD和ISSR引物对三系杂交水稻及其父母本的鉴定[J].湛江海洋大学学报,2006,26(3):86~90.
