近距离照射联合最大限度雄激素阻断治疗前列腺癌的疗效分析
2018-04-27赵福广陈明杰周建芳阳东荣
赵福广,陈明杰,李 明,周建芳,阳东荣,沈 华
(1.苏州大学附属第二医院泌尿外科,江苏苏州 215004;2.苏州市立医院东区泌尿外科,江苏苏州 215001)
前列腺癌是目前男性泌尿系肿瘤中最常见的肿瘤。对于早期前列腺癌,根治性手术或根治性放疗是标准的治疗方法。但是对有手术禁忌证的局部中晚期或晚期前列腺癌,常需采用最大限度雄激素阻断(maximum androgen blockade,MAB)为主的内分泌治疗或者联合局部放疗。在MAB治疗的基础上,联合针对前列腺局部病灶的三维适形调强外放疗,具有延长患者生存的优势[1]。但是,125I粒子近距离照射联合MAB治疗是否能取得相似疗效,目前尚无明确结论。本文回顾性总结了125I粒子近距离照射治疗联合MAB治疗的前列腺癌患者资料,并与同期单纯接受MAB的同类患者进行比较,报道如下。
1 资料与方法
1.1一般资料收集2012年9月至2016年9月经我院和苏州市立医院东区收治的前列腺癌患者资料,根据下述纳入标准选择:①经前列腺穿刺活检明确为前列腺癌,无前列腺癌手术史。②行胸部X线片或电子计算机断层扫描(computed tomography,CT)、腹盆腔CT或磁共振成像(magnetic resonance imaging,MRI)及骨扫描排除转移病灶; 临床分期T2~T3N0M0;③不愿行前列腺根治手术或者具有手术禁忌证;④资料完整且随访时间不低于6个月;⑤行125I粒子近距离照射治疗联合MAB,或者仅MAB治疗。
1.2手术方法
1.2.1仪器设备 放射性粒子三维治疗计划系统:放射治疗计划系统(treatment planning system,TPS)设备、前列腺穿刺固定器、模板、推进器、粒子植入枪和辅助设备(北京航空航天研究院生产),配有直肠探头的超声诊断仪(丹麦B-K公司产品),放射性125I粒子(天津塞德生物制药有限公司生产),放射性活度为0.35~0.4 mGi(1 mCi=3.7×107Bq)。
1.1.2125I粒子近距离照射治疗 患者硬膜外或者全麻。截石位,气囊导尿管保留导尿,将穿刺固定器与手术台连接,并消毒铺巾。行经直肠超声扫描前列腺,牵拉导尿管确认膀胱颈、前列腺基底部位置。由前列腺基底部开始,每隔0.5 cm采集一副前列腺横切面图像直至前列腺尖部,将采集的图像输入计算机工作站进行图像重建。画出前列腺靶区,计算出拟给予的放射治疗总剂量,使达120~160 Gy。根据剂量调整拟放置粒子的位置。在超声监视下,避开直肠与膀胱,用mick枪将125I粒子经穿刺针置入前列腺组织相应位置。术毕超声检查粒子位置,留置导尿管。前列腺植入125I粒子78~147粒,平均107.5粒。
1.1.3内分泌治疗 采用MAB治疗。患者诊断明确后或术后开始予抗雄药物比卡鲁胺及药物去势(醋酸戈舍瑞林、醋酸亮丙瑞林)或者手术去势(双侧睾丸切除)。
1.3疗效观察内分泌治疗后或术后第1年每3个月复查血前列腺特异性抗原(prostate specific antigen,PSA)水平,了解排尿及排便情况;此后每3~6个月复查PSA,了解排尿及排便情况。每6~12个月行胸部X片、盆腔MRI、全身核素骨扫描及前列腺B超检查。生化无进展生存期定义:PSA水平持续下降或小于最低点+0.4 ng/mL。PSA复发的定义参照美国放射治疗及肿瘤协会(American Society for Therapeutic Radiology and Oncology,ASTRO)和美国放射治疗协作组(Radiation Therapy Oncology Group,RTOG)制定的标准[2]:大于PSA水平最低点+2 ng/mL。

2 结 果
统计时间段内125I粒子近距离照射联合MAB治疗的患者共98例,单纯MAB治疗159例,其中符合本研究纳入标准共109例。109例中48例接受125I粒子近距离照射治疗联合MAB(观察组),61例单纯MAB 治疗(对照组)。
109例患者的年龄50~89岁,前列腺体积11.73~122.10 mL;治疗前:血PSA 4.16~189.10 ng/mL,Gleason评分6~10分。TNM临床分期为T2~T3N0M0。危险等级分级按照美国国立癌症综合网络(National Comprehensive Cancer Network,NCCN)分级系统[3],其中局限性低危7例、中危20例、高危62例、局部晚期20例(T3b)。两组患者一般资料无统计学差异(P>0.05,表1)。
表1两组前列腺癌患者治疗前一般资料比较
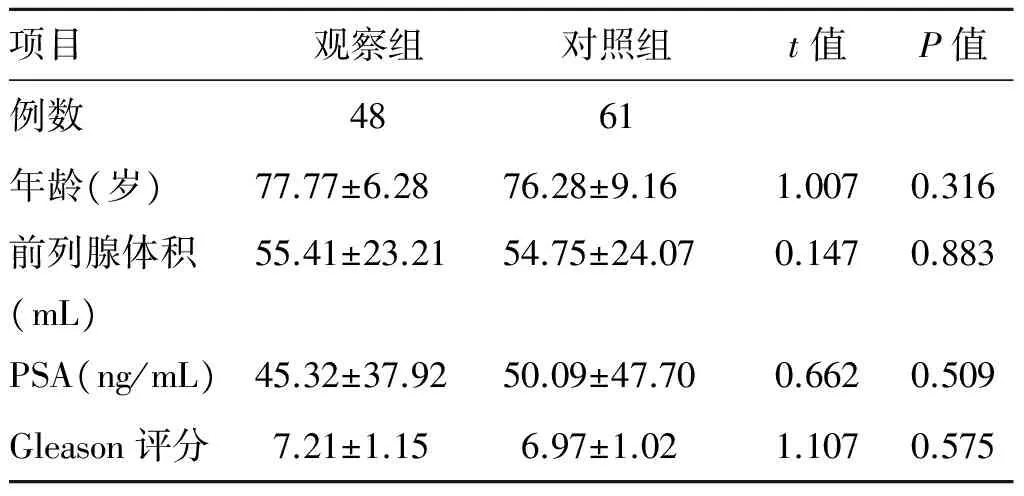
项目观察组对照组t值P值例数4861年龄(岁)77.77±6.2876.28±9.161.0070.316前列腺体积(mL)55.41±23.2154.75±24.070.1470.883PSA(ng/mL)45.32±37.9250.09±47.700.6620.509Gleason评分7.21±1.156.97±1.021.1070.575
2.1两组患者治疗后的血PSA水平变化两组患者随访时间6~53月,观察组平均(21.19±10.79)月,对照组平均(19.97±12.02)月。两组患者治疗后血PSA水平较治疗前明显降低(P<0.001)。治疗后6个月,两组患者血PSA水平差异不明显;治疗后9个月,两组血PSA水平差异有统计学意义;对照组治疗9个月后血PSA水平缓慢上升;而观察组治疗12个月后血PSA水平缓慢上升,提示观察组疗效更持久(表2、图1)。观察组治疗后(10.81±6.51)个月,血PSA水平至最低值(0.052±1.25)ng/mL;而对照组治疗后(9.90±6.12)个月,血PSA至最低值(0.19±0.34)ng/mL,两组血PSA最低值相比差异有统计学意义(P=0.007)。
表2不同随访时间血PSA水平的变化(ng/mL)
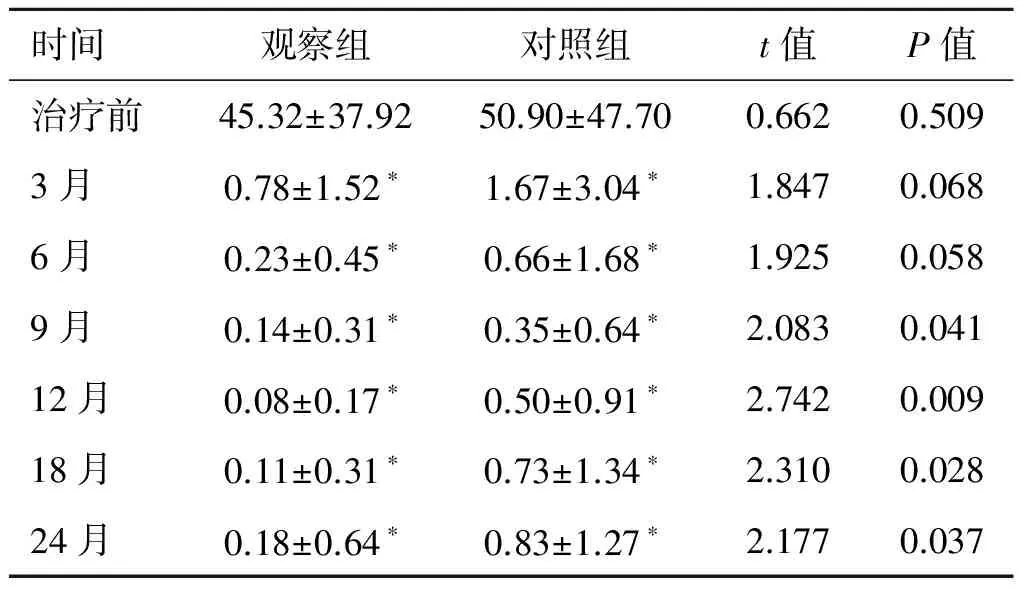
*P<0.001,与本组治疗前比较。
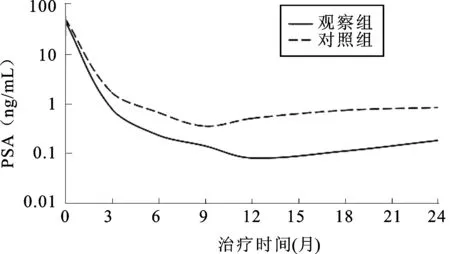
图1 两组血PSA水平的变化
2.2并发症两组均未出现严重并发症。观察组无粒子逸出至膀胱及前列腺周围组织。短期内有轻至中度下尿路刺激症状(22例,45.83%),急性尿潴留(2例,4.17%),直肠刺激症状(2例,4.17%),轻度便血(1例,2.08%),无尿道狭窄、肠瘘及尿失禁等严重并发症,对症治疗后均好转。其中下尿路刺激症状5例持续1~2年,2例持续≥2年,呈加重趋势,需用药物缓解症状。术后因尿潴留行经尿道前列腺切除术(transurethral resection of the prostate,TURP)2例;有射精功能障碍1例。对照组尿路刺激症状者17例(27.87%),与观察组相比有统计学差异(P=0.041),有1例发生急性尿潴留(1.64%),经药物治疗后可自行排尿。
2.3随访生存结果观察组:有2例随访分别至13、38月死亡,1例死于多器官功能衰竭,另1例死因不详;有1例在术后24月血PSA 水平升高超过PSA最低值2 ng/mL,经证实为生化复发。对照组:有1例随访至34月死于心血管疾病;有6例随访9月后相继出现血PSA水平升高超过PSA最低值2 ng/mL,均证实为生化复发。上述生化复发患者均行二线内分泌治疗联合外放射治疗或化疗。观察组生化无进展生存期为(20.79±10.60)个月,而对照组的生化无进展生存期为(16.10±10.87)个月,两组有统计学差异(P=0.026)。
3 讨 论
新型放射性核素125I、计算机三维治疗计划系统和经直肠超声引导的固定精确定位系统,使放射性125I前列腺组织植入(近距离照射)治疗前列腺癌得到进一步发展。对部分患者,近距离照射治疗可以达到与根治性前列腺切除术和根治性外放疗类似的效果[4],而且在生活质量方面,近距离照射治疗较其他治疗方式具有优势[5]。
单纯近距离照射治疗的适应证:美国近距离照射治疗协会(American Brachytherapy Society,ABS)推荐局限性低危前列腺癌患者单纯近距离照射治疗;美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)推荐局限性低中危前列腺癌(Gleason 7,PSA<10 ng/mL或Gleason 6,PSA10~20 ng/mL)患者行单纯近距离照射治疗[6]。近距离照射治疗联合外放射治疗或内分泌治疗适应证:ABS推荐部分局限性中危和局限性高危前列腺癌患者近距离照射治疗联合外放射或(和)内分泌治疗;对于前列腺体积>60 mL,可联合新辅助内分泌治疗使前列腺缩小,再行近距离照射治疗。2012年ABS指南已将T3a期局部进展期前列腺癌纳入高危组,并推荐联合使用近距离照射治疗、外放射治疗及内分泌治疗[7]。绝对禁忌证包括预期生存期小于5年,TURP后缺损较大或预后不佳,患者一般情况差或有远处转移等。相对禁忌证包括前列腺腺体大于60 mL、既往有TURP史、多次盆腔放疗及手术史等。
单纯使用近距离照射治疗局限性低危和部分中危前列腺癌患者,已取得了良好效果。一项包括了2 237例接受近距离照射治疗的局限性低、中危前列腺癌患者,随访5年、7年的疾病特异性生存率、总生存率和生化无失败生存率分别为99%和98%、94%和89%、92%和88%[8]。OHASHI等[9]报道了663例局限性低危、低中危(PSA<10 ng/mL,Gleason 3+4,穿刺活检阳性率<33%)前列腺癌患者,单纯使用近距离照射治疗足以实现最佳的生化控制,而联合雄激素剥夺治疗并没有获益。因此,对于局限性低危、低中危前列腺癌不建议联用内分泌治疗。本研究联合治疗组中有局限性低危患者4例,因前列腺体积大于60 mL,有排尿刺激及梗阻症状,且文献报道根治性前列腺切除术术后病理分期往往高于术前[10],因此,我们联合采用MAB治疗。对于中高危前列腺癌患者,近距离照射治疗联合内分泌治疗也取得满意效[11-12]。我国学者周毅等[13]研究分析经近距离照射治疗联合MAB治疗的98例中危前列腺癌患者,随访5年生化无复发率为80.6%,总生存率92.9%,肿瘤特异性生存率98.9%,生化无复发生存率79.3%,表明对于中高危前列腺癌,联合治疗效果优于单纯内分泌治疗。但是ABS一项研究发现,对于部分中危和高危患者,近距离照射治疗联合ADT可改善bPFS,但是对病因特异性生存率的影响不确定和对总生存率有潜在的不利影响,应谨慎考虑联用内分泌治疗,特别对那些患有心血管疾病的患者[14]。本研究采用125I粒子近距离照射联合MAB治疗,初步表明对于局部中晚期前列腺癌患者联合治疗比MAB更有效地控制了PSA水平,延长了生化无进展生存时间,与上述研究相似。因此,对局部中、晚期前列腺癌患者可考虑采取联合治疗,可有效控制前列腺癌的进展。
近距离照射治疗术后出现下尿路刺激症状较多,一项对接受近距离放射治疗的680例前列腺癌患者术后随访研究,国际前列腺症状评分和膀胱过度活动症评分在术后1月达到高峰,后逐渐下降,约术后1年可回归到基线水平[15],说明近距离照射治疗术后下尿路刺激症状发生率虽然较高,但大多数症状不严重,且术后6~12月可显著改善。本组患者中,短期内有轻至中度下尿路刺激症状,直肠刺激症状以及轻度便血,无尿道狭窄、肠瘘及尿失禁等严重并发症发生。对于前列腺体积较大的患者,近距离照射治疗前给予辅助内分泌治疗,可有效缩小前列腺体积并且可减少患者术后尿路刺激症状。
总之,125I粒子近距离照射联合最大限度雄激素阻断治疗对未能手术或者不愿手术的T2~T3前列腺癌患者,无进展生存时间长,无严重并发症。但鉴于本文属于回顾性研究,样本量较小且随访时间较短,仍需大样本前瞻性随机对照试验的有力论证。
参考文献:
[1] MASON MD,PARULEKAR WR,SYDES MR,et al.Final report of the intergroup randomized study of combined androgen-deprivation therapy plus radiotherapy versus androgen-deprivation therapy alone in locally advanced prostate cancer[J].J Clin Oncol,2015,33(19):2143-2150.
[2] BEUZEBOC P.Re:defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer:recommendations of the rtog-astro phoenix consensus conference[J].Eur Urol,2006,50(5):1121-1122.
[3] CARROLL PR,PARSONS JK,ANDRIOLE G,et al.Prostate cancer early detection,Version 2.2016:featured updates to the NCCN guidelines [J].J Natl Compr Cancer Netw,2016,12(9):1211.
[4] NEPPLE KG,STEPHENSON AJ,KALLOGJERI D,et al.Mortality after prostate cancer treatment with radical prostatectomy,external-beam radiation therapy,or brachytherapy in men without comorbidity[J].Eur Urol,2013,64(3):372-378.
[6] CHIN J,RUMBLE RB,LOBLAW DA.Brachytherapy for patients with prostate cancer:american society of clinical oncology/cancer care ontario joint guideline update summary[J].J Clin Oncol,2017,35(15):1737-1743.
[7] DAVIS BJ,HORWITZ EM,LEE WR,et al.American brachytherapy society consensus guidelines for transrectal ultrasound-guided permanent prostate brachytherapy[J].Brachytherapy,2012,11(1):6-19.
[8] FELLIN G,MIRRI MA,SANTORO L,et al.Low Dose Rate Brachytherapy (LDR-BT) as monotherapy for early stage prostate cancer in Italy:practice and outcome analysis in a series of 2237 patients from 11 Institutions.[J].Br J Radio,2016,89(1065):20150981.
[9] OHASHI T,YOROZU A,SAITO S,et al.Outcomes following iodine-125 prostate brachytherapy with or without neoadjuvant androgen deprivation[J].Radiother Oncol,2013,109(2):241-245.
[10] MOSCHINI M,CARROLL PR,EGGENER SE,et al.Low-risk prostate cancer:identification,management,and outcomes[J].Eur Urol,2017,72(2):238-249.
[11] SCHIFFMANN J,LESMANA H,TENNSTEDT P,et al.Additional androgen deprivation makes the difference: biochemical recurrence-free survival in prostate cancer patients after HDR brachytherapy and external beam radiotherapy[J].Strahlenther Onkol,2015,191(4):330-337.
[12] YOSHIDA K,YAMAZAKI H,TAKENAKA T,et al.High-dose-rate interstitial brachytherapy in combination with androgen deprivation therapy for prostate cancer:are high-risk patients good candidates?[J].Strahlenther Onkol,2014,190(11):1015-1020.
[13] 周毅,李汉忠,严维刚,等.局部中危前列腺癌近距离照射治疗联合MAB疗效分析[J].中华外科杂志,2015,53(4):257-260.
[14] KEYES M,MERRICK G,FRANK SJ,et al.American brachytherapy society task group report:use of androgen deprivation therapy with prostate brachytherapy-a systematic literature review[J].Brachytherapy,2017,16(2):245-265.
[15] SAKAYORI M,OHASHI T,MOMMA T,et al.Quantitative analysis of genitourinary toxicity after iodine-125 brachytherapy for localized prostate cancer:followup of the international prostate symptom score and overactive bladder symptom score[J].Brachytherapy,2017,16(4):806-814.
