海洋链霉菌IMB3-202产生的吲哚咔唑生物碱
2018-04-27王冕郝晓萌李娇胡媛媛关艳王以光甘茂罗肖春玲
王冕,郝晓萌,李娇,胡媛媛,关艳,王以光,甘茂罗,肖春玲
吲哚咔唑(indolocarbazole)生物碱是一类具有吲哚[2,3-α]-吡咯并[3,4-c]咔唑母核结构的天然产物,具有良好的抗肿瘤、抗细菌、抗真菌、抗病毒和神经保护等生物活性[1-2]。该类化合物作用于拓扑异构酶以及与细胞周期有关的激酶,如酪氨酸蛋白激酶(PTKs)、蛋白激酶 A(PKA)、蛋白激酶 C(PKC)等多个作用靶点,其抗肿瘤活性引起广泛的关注。自 1977 年第一个吲哚咔唑生物碱——星形孢菌素(staurosporine)发现以来,从多个属的放线菌、黏细菌、蓝细菌以及海洋无脊椎动物中,分离得到 130 多个吲哚咔唑天然产物[2]。多个吲哚咔唑衍生物作为抗肿瘤药物进入临床研究[2-3]。2017年 4 月,美国食品药品管理局批准了第一个吲哚咔唑类药物——米哚妥林(midostaurin,PKC412)上市,用于治疗 FLT3 突变阳性的急性骨髓性白血病[4],表明该类化合物具有良好的临床应用开发前景。
在从海洋放线菌筛选新抗生素的过程中,我们对黄海分离的放线菌发酵产物进行抗肿瘤细胞活性筛选[5-8]。为了解菌株的次级代谢潜能,对部分阳性菌株进行了基因组测序。利用 AntiSMASH 4.0对菌株基因组次级代谢基因进行分析,发现海洋链霉菌Streptomycessp. IMB3-202 基因组中一条基因簇与吲哚咔唑类化合物的生物合成基因非常相似,提示该菌株具有产生吲哚咔唑的次级代谢潜能。为获得该类化合物,通过优化发酵条件和系统分离纯化,分离得到 4 个吲哚咔唑衍生物,包括星形孢菌素(1)[9-10]、3'-O-去甲基星形孢菌素(2)[11]、holyrine A(3)[12]和 K252c(4)[13]。本文主要介绍菌株的基因组序列分析、分离纯化、结构鉴定以及活性评价等结果。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株 菌株 IMB3-202 分离自中国大连黄海黑石礁海湾(38°49'N,121°34'E)深度约为 40 m的海洋沉积物。通过 16S rRNA 基因(GenBank No. HM467146)序列 Blast 比对分析,该菌株与新霉素链霉菌 Streptomyces fradiae(GenBank AB184776)相似度达 98.17%,确定该菌株为链霉菌属放线菌。菌株 IMB3-202 中的星形孢菌素生物合成基因簇部分序列数据提交 GenBank 保存(No.MG489830)。
1.1.2 培养基 斜面培养基(R-ISP4 培养基):淀粉 10 g、磷酸二氢钾 1 g、硫酸镁 1 g、氯化钠1 g、硫酸铵 2 g、碳酸钙 2 g、麦麸 30 g、海盐30 g,ddH2O 至 1 L,pH 7.0。发酵培养基 1:酪蛋白胨 5 g、丙三醇 5 ml、酵母浸膏 1 g,ddH2O 至1 L,pH 7.0。发酵培养基 2:蔗糖 40 g、NH4Cl 2 g、Na2SO42 g、K2HPO41 g、MgCl2·6H2O 1 g、NaCl 1 g、CaCO32 g、ddH2O 至 1 L,pH 7.0 ~ 7.2。发酵培养基 3:淀粉 10 g、酵母膏 4 g、蛋白胨 2 g、KBr 10 mg、FeSO4·7H2O 4 mg,ddH2O 至 1 L,pH 7.0 ~ 7.2。发酵培养基 4:酵母膏 2 g、麦芽糖10 g、葡萄糖 4 g、ddH2O 至 1L,pH 7.0 ~ 7.2。发酵培养基 5:胰蛋白胨 10 g、酵母膏 5 g、甘氨酸0.5 g,ddH2O 至 1 L,pH 7.0 ~ 7.2。发酵培养基 6:淀粉 25 g、葡萄糖 5 g、蛋白胨 3 g、牛肉膏 3 g、CaCO32.5 g、FeSO41 mg、MnCl21 mg、ZnSO41 mg、CuSO41 mg、CoCl21 mg,ddH2O 至 1 L,pH 7.0 ~7.2。发酵培养基 7:淀粉 10 g、葡萄糖 25 g、棉籽饼粉 10 g、蛋白胨 3 g、KH2PO40.1 g、MgSO40.1 g、NaCl 5 g、CaCO35 g,ddH2O 至 1 L,pH 7.0。发酵培养基 8:胰蛋白胨 3 g、酪蛋白 4 g、葡萄糖 5 g,ddH2O 至 1 L,pH 7.0 ~ 7.2。
1.1.3 仪器与试剂1H 和13C-NMR 谱用Bruker 600 MHz 核磁共振仪测定(溶剂峰为内标);LC-MS 分析用安捷伦 LC-MSD-Trap/SL 液相色谱-质谱联用仪(1200 系列);化合物 HPLC 制备用岛津 LC-20AD 液相色谱仪(SPD-M20A 型紫外检测器)。Amberlite XAD7HP 大孔树脂为美国罗门哈斯公司产品;Sephadex LH-20 凝胶为美国 GE Biosciences 公司产品;Cosmosil C-18 色谱柱为日本 Nacalai 公司产品;薄层色谱硅胶购自青岛海洋化工厂分厂;人工海盐购自天津中盐海洋生物公司。基因组扫描图测序由上海美吉生物医药科技有限公司完成。
1.2 方法
1.2.1 发酵条件优化与产物分析 将保存的菌株 IMB3-202 孢子悬液涂布于 R-ISP4 培养基,28 ℃ 静置培养 10 d。将活化的菌株接种到每瓶含100 ml 的发酵培养基 1 ~ 8 的 500 ml 三角瓶中,每种培养基分别采用添加 3% 人工海盐(1A ~ 8A)和不加海盐(1B ~ 8B)两种组成形式。于 28 ℃、200 r/min 条件下振荡培养 5 d,获得发酵培养物。发酵液离心获得上清液,上清液上 XAD7HP 树脂柱层析,分别用水和丙酮洗脱。收集丙酮洗脱馏分,减压蒸馏后得到提取物浸膏,将浸膏溶解于 5 ml甲醇中,10 000 r/min 离心 10 min,取上清液 5 μl进行 LC-MS 分析。色谱柱:Capcell MG II C18,3 μmol/L,3.0 mm × 150 mm;柱温:30 ℃;流动相:A 相为 5 mmol/L 醋酸铵水溶液,B 相为乙腈;梯度:0 ~ 30 min,10% ~ 90% B。流速:0.5 ml/min;检测波长:280 nm。
1.2.2 发酵产物的分离纯化 将活化的 IMB3-202菌种接种于含 100 ml 7A 培养基的 500 ml 三角瓶中,28 ℃、200 r/min 振摇培养 120 h,获得发酵培养物,共 25 L。将发酵培养物离心得到菌丝体与上清液两部分。上清液经 XAD7HP 大孔树脂柱色谱(5 L),依次用水、50%、100% 丙酮洗脱,收集 50% 和 100% 丙酮洗脱馏分,减压浓缩得到相应的提取物浸膏;菌丝体经丙酮超声提取 3 次,合并提取液,减压浓缩得到菌丝体提取物。活性检测表明,50%、100% 丙酮洗脱馏分和菌丝体提取物均具有抗菌活性。将上述活性部分合并,得到活性组分浸膏共 32.2 g。将该浸膏上硅胶柱层析(600 g),二氯甲烷-甲醇梯度(100:1、50:1、20:1、9:1、4:1、2:1、0:100,V/V)洗脱,经 TLC 板和活性检测,合并相似馏分得到 7 个组分(F1~F7)。组分 F3(600 mg)经 Sephadex LH-20 柱色谱,二氯甲烷-甲醇 1:1 洗脱,得到 3 个混合组分(F3-1~ F3-3)。组分 F3-1(200 mg)经 HPLC 制备[25% 乙腈(含 0.1% 甲酸)溶液为流动相,流速5 ml/min]纯化得到化合物 1(100 mg)。组分 F3-2(50 mg)经 HPLC 半制备[30% 乙腈(含 0.1%甲酸)溶液为流动相,流速 5 ml/min]纯化得到化合物 3(3 mg)。F3-3(26 mg)经 HPLC 半制备[40%乙腈(含 0.1% 甲酸)溶液为流动相,流速 5 ml/min]纯化得到化合物 4(2 mg)。组分 F4(500 mg)经Sephadex LH-20 柱色谱,二氯甲烷-甲醇 1:1 洗脱得到 4 个混合组分(F4-1~ F4-4),组分 F4-3经 HPLC半制备[23% 乙腈(含 0.1% 甲酸)溶液为流动相,流速 5 ml/min]纯化得到化合物 2(2 mg)。
1.2.3 抗菌活性测定 活性检定菌株包括铜绿假单胞菌(ATCC27853)、铜绿假单胞菌11(敏感株)、肺炎克雷伯菌(ATCC700603)、摩氏摩根菌(ATCC 25830)、摩氏摩根菌 KL-225(多重耐药菌)、金黄色葡萄球菌(ATCC29213)、金黄色葡萄球菌 R6101(甲氧西林耐药)、枯草芽孢杆菌(ATCC6633)、白色念珠菌(ATCC93025)购自 ATCC 或临床收集,由本课题组保存。活性跟踪,以摩氏摩根菌作为检定菌采用纸片扩散法进行[14]。化合物的最低抑制浓度(MIC)采用文献[15]报道的 96 孔板微量肉汤稀释法进行。
1.2.4 细胞毒活性测定 细胞毒活性采用 MTT比色法测定[16]。用胰酶消化对数生长期的细胞,以200 μl/孔、含 4000 个细胞的密度接种到 96 孔板中,置于培养箱中培养。24 h 后按照实验需要加入不同浓度的药物,每个浓度设有 3 个平行复孔;药物作用 48 h 后,每孔加入 20 μl 噻唑蓝,置于培养箱中培养,4 h 后,吸出 96 孔板中所有液体,每孔加入 150 μl DMSO 溶液,置于水平摇床振荡20 ~ 30 min,在酶标仪 570 nm 下测定吸光度值(A)。细胞存活率 =(A加药组–A空白组)/(A对照组–A空白组)× 100%。根据细胞成活率计算半数抑制浓度。空白组为无细胞的完全培养基,对照组为无药细胞组。
2 结果
2.1 基因组生物信息学分析
利用 Illumina Hiseq 4000 测序平台获得的菌株3-202 基因组扫描图包含 630 个重叠群(contig),碱基总数为 6.4 Mb。利用 antiSMASH 3.0[17]对菌株 3-202 基因组进行次级代谢生物合成基因分析,提示其基因组中包含 20 个次级代谢基因簇,可能的产物类型有铁载体、非核糖体肽(NPRS)、萜、氨基糖苷、聚酮(PKS)、吲哚类等。其中位于重叠群 ctg75 中的基因簇clu7,与吲哚咔唑类化合物星形孢菌素(sta,GenBank No. AB088119)[18]、蝴蝶霉素(reb,AB071405)[19]、cladoniamide A(cla,JN165773)[20]、K252a(ink,DQ399653)[21]和reductasporine(red,KP274854)[22]等基因簇高度相似(图 1)。生物信息学分析表明,基因簇clu7含有 13 个基因,其中orf3-5和orf8分别编码L-氨基酸氧化酶、色吡咯酸合成酶、细胞色素 P450以及单氧化酶(表 1)。它们分别与来自链霉菌TP-A0274 的sta基因簇中的staO(蛋白一致性82%)、staD(蛋白一致性 72%)、staP(蛋白一致性 74%)、staC(蛋白一致性 79%)为同源基因,这些基因编码蛋白负责吲哚[2,3-α]-吡咯并[3,4-c]咔唑母核结构的合成[23];基因orf6和orf7分别编码N-甲基转移酶和O-甲基转移酶,与sta中的staMA和staMB为同源基因,分别催化星形孢菌素氨基糖单元(L-ristosamine)的 4'-NH2和 3-OH甲基化反应[24];orf1编码细胞色素 P450,orf2 编码 N-糖基转移酶,这两个基因与sta中催化吲哚咔唑母核与糖基偶联反应的两个蛋白 StaN 和StaG 具有较高的同源性(85% 和 78%)。此外,clu7中还含有转运及耐药等相关基因(orf10、11、13)。从图 1 所示吲哚咔唑类化合物的基因簇可知,cladoniamide A 基因簇cla中同时含有O-甲基和N-甲基转移酶基因(claM1 和claM3),但缺少糖基合成及连接相关基因;蝴蝶霉素(reb)和K252a(ink)基因簇中仅含有O-甲基转移酶基因(rebM和inkM),reductasporine 基因簇(red)中不存在甲基转移酶基因;只有sta中同时包含母核合成、糖基合成与连接、O-甲基、N-甲基转移酶等基因。因此,clu7的基因组成与sta相似度最高。根据以上分析,推测菌株 3-202 中clu7的产物可能是星形孢菌素类化合物。
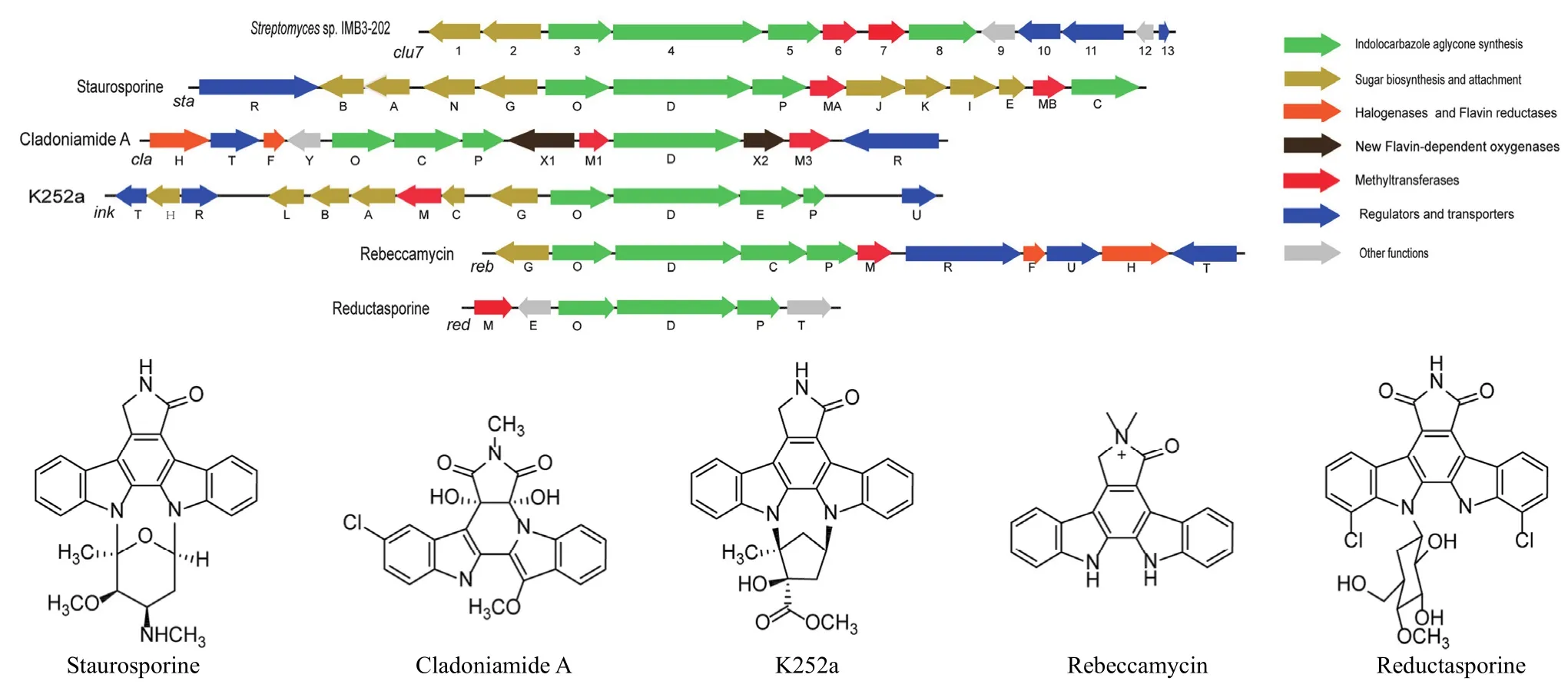
图1 clu7 与其他吲哚咔唑类化合物生物合成基因簇的比较Figure 1 Comparison of clu7 and indolocarbazole biosynthetic gene clusters
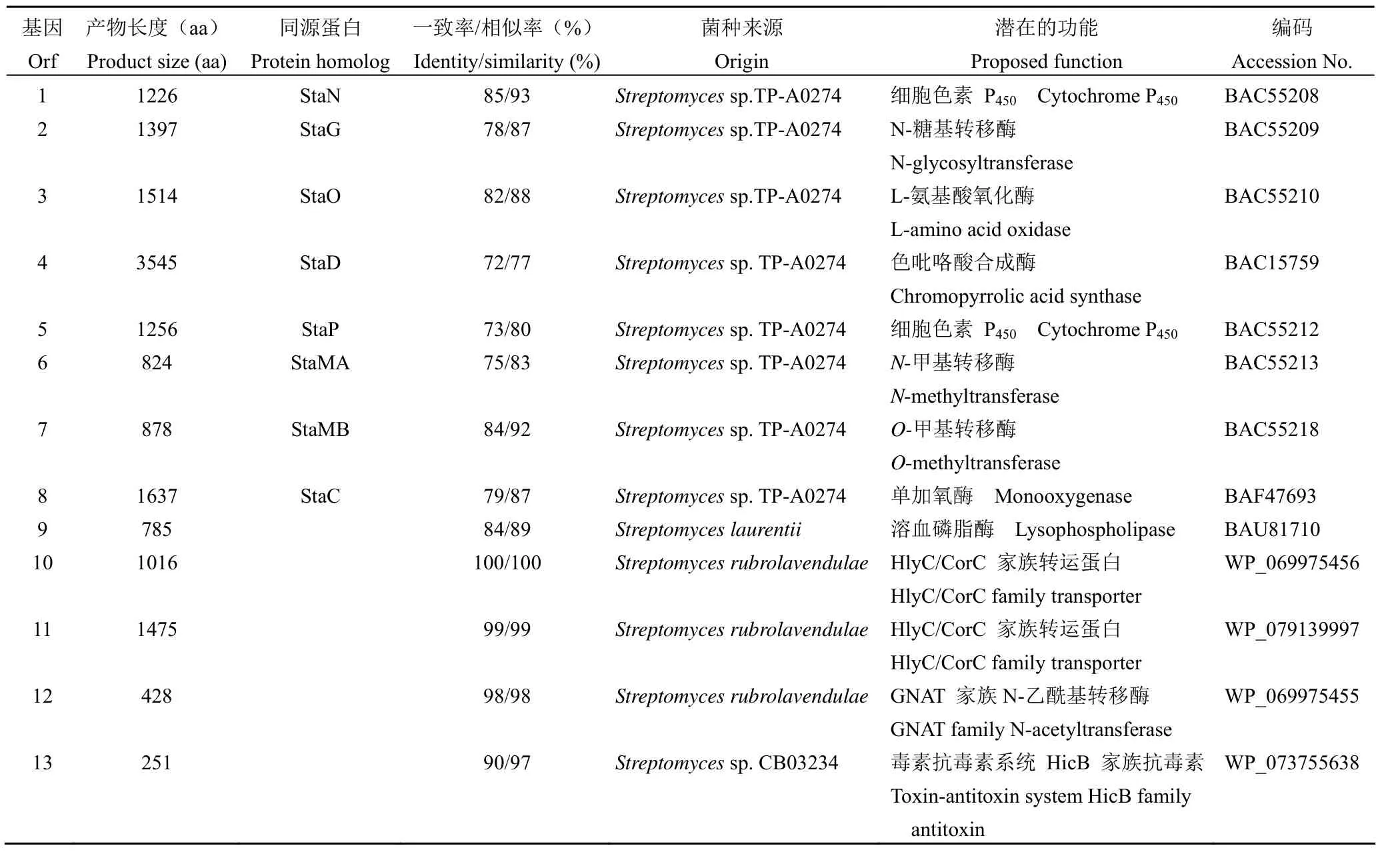
表1 海洋链霉菌 IMB3-202 clu7 中各片段的功能预测Table 1 Deduced functions of ORFs in clu7 in Streptomyces sp. IMB 3-202
2.2 发酵产物分析
为获得基因簇clu7的表达产物,我们采用8 种发酵培养基,分别添加 3% 人工海盐(1A ~8A)和不加海盐(1B ~ 8B),对菌株 IMB3-202 进行发酵。利用多重耐药摩氏摩根菌 KL-225 对发酵产物进行抗阴性菌活性测定,结果显示 5A、5B、6A、6B 和 7A 发酵液显示出显著的抗菌活性(抑菌圈 15 ~ 17 mm)。对 7A 培养基发酵产物进行进一步的 LC-MS 分析(图 2),部分发酵产物中有一些组分显示出吲哚咔唑类的特征紫外光谱,质谱显示出m/z467 [M+H]+的准分子离子,提示代谢产物中含有星形孢菌素类化合物[25]。其中,以 7A发酵液中星形孢菌素类成分含量较高,且产物多样性较丰富。因此,选用 7A 培养基对菌株进行大量发酵和分离纯化。
2.3 结构解析
化合物 1(图 3)为浅黄色粉末,电喷雾质谱(ESIMS)显示准分子离子峰m/z467 [M+H]+,结合 NMR 数据推测其分子式为 C28H26N4O3。化合物 1 的紫外(UV)光谱在 244、292、334、354、371 nm 显示出最大吸收峰;1H-NMR 在低场区显示出 2 组 1,2-二取代芳香质子信号,1 个糖端基质子;高场区显示出 2 个连氧或连氮次甲基质子,4 个亚甲基质子以及 3 个甲基质子。13C-NMR 谱显示出 28 个碳信号,DEPT 谱表明这些碳信号分别为 3 个甲基碳(包括 1 个甲氧基δC60.0 和1 个氮甲基δC32.1),2 个亚甲基碳,11 个次甲基(包括 8 个 sp2杂化碳,3 个连氧或氮取代 sp3杂化碳),12 个季碳(包括 1 个羰基碳,10 个芳香碳和 1 个 sp3杂化碳)。以上数据表明,化合物 1 具有吲哚咔唑类化合物的典型 NMR 数据特征[10]。通过与文献[9-10]报道的波谱数据比对,确定化合物 1 的结构为星形孢菌素。
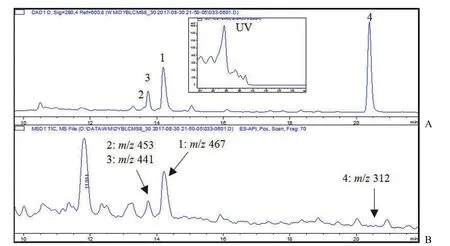
图2 菌株 IMB3-202 在 7A 培养基中的发酵产物 LC-MS 紫外 280 nm 色谱图(A)和总离子流图(B)Figure 2 LC-MS profile at 280 nm (A) and MS total ion current (B) of the extracts from Streptomyces sp. IMB3-202 cultured in 7A medium
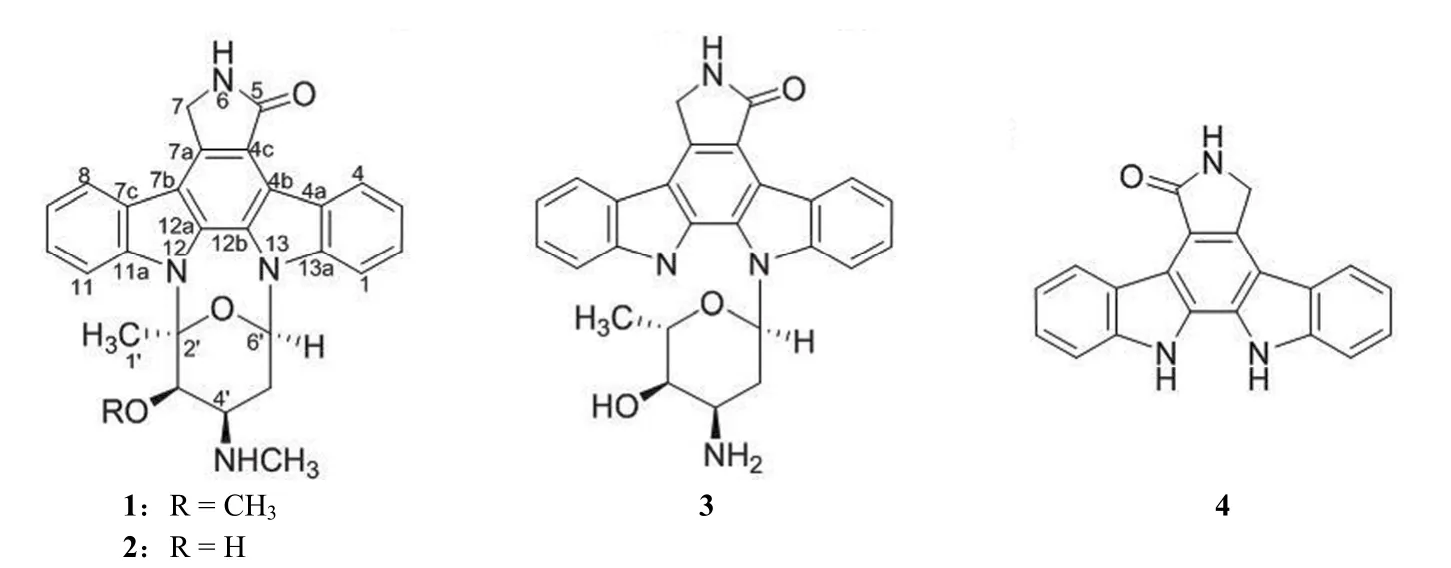
图3 化合物 1 ~ 4 的结构Figure 3 The structures of compounds 1 - 4
化合物 2(图 3)的分子式依据 ESIMS 和NMR 数据确定为 C27H24N4O3。化合物 2 的 NMR数据比化合物 1 少 1 个甲氧基信号。此外,C-3'向高场位移 –9.2 ppm,H-3' 向低场位移 0.55 ppm,提示化合物 2 为 1 的 3'-O-去甲基衍生物,结构确定为 3'-O-去甲基星形孢菌素[11]。化合物 3(图 3)的分子式确定为 C26H24N4O3,不饱和度为 17,比化合物 1 的不饱和度少 1 个。与化合物 1 比较,化合物 3 的 NMR 数据中缺失了氮甲基与甲氧基的信息,提示化合物 3 为星形孢菌素的 3'-O-去甲基-4'-N-去甲基衍生物。此外,化合物 3 中 C-2' 为次甲基信号(δH4.70,q;δC78.4),并且 C-2' 的化学位移较化合物 2 中向高场位移 –15.5 ppm,说明化合物 3 中 C-2' 与 N-13 之间的 C-N 键发生断裂。通过与文献[12]数据比较,3 的波谱数据与 holyrine A 一致,因此化合物 3 的结构确定为holyrine A。化合物 4(图 3)的 MS、NMR 波谱显示其糖单元部分的信号缺失,其结构确定为星形孢菌素的苷元 K252c[13]。
星形孢菌素(1):淡黄色粉末状;UV(MeOH,HPLC)λmax244、292、334、354、371 nm;1H-NMR(CD3OD,600 MHz)、13C-NMR(CD3OD,150 MHz)数据见表 2;ESIMSm/z:467[M+H]+,933[2M+H]+。
3'-O-去甲基星形孢菌素(2):淡黄色粉末状;UV(MeOH,HPLC)λmax241、289、334、363 nm;1H-NMR(CD3OD,600 MHz)、13C-NMR(CD3OD,150 MHz)数据见表 2;ESIMSm/z:453[M+H]+。
Holyrine A(3):淡黄色粉末状;UV(MeOH,HPLC)λmax240、288、333、360 nm;1H-NMR(CD3OD,600 MHz)、13C-NMR(CD3OD,150 MHz)数据见表 2;ESIMSm/z:441[M+H]+。
K252c(4):淡黄色粉末状;UV(MeOH,HPLC)λmax240、288、333、360 nm;1H-NMR(DMSO-d6,600 MHz)、13C-NMR(DMSO-d6,150 MHz)数据见表 2;ESIMSm/z:312[M+H]+。
2.4 生物活性
对化合物进行体外抗菌活性评价,结果表明,化合物 1 对金黄色葡萄球菌、枯草芽孢杆菌以及白色念珠菌具有较弱的抗菌活性,最低抑菌浓度(MIC)值为 128 μg/ml;对铜绿假单胞菌ATCC27853、摩氏摩根菌、肺炎克雷伯杆菌、大肠杆菌等没有明显的抑制活性,MIC 值 〉 256 μg/ml。
体外细胞毒活性结果(表 3)显示,其中用阿霉素作阳性对照,阴性对照未加化合物。化合物 1和 2 对宫颈癌 HeLa 细胞和结肠癌 HCT116 细胞均具有很强的细胞毒活性,IC50值均在纳摩尔水平(0.75 ~ 12.3 nmol/L),对乳腺癌 MCF-7 细胞的抑制活性较低,IC50约为 335 nmol/L。化合物 3对以上三种肿瘤细胞的抑制活性比 1 和 2 低约2 倍,表明 N12-C2' 键开环导致活性降低。化合物4 对以上肿瘤细胞的抑制活性比化合物 1 和 2低 25 ~ 2500 倍,表明糖基对吲哚咔唑类化合物的细胞毒活性具有重要的影响。
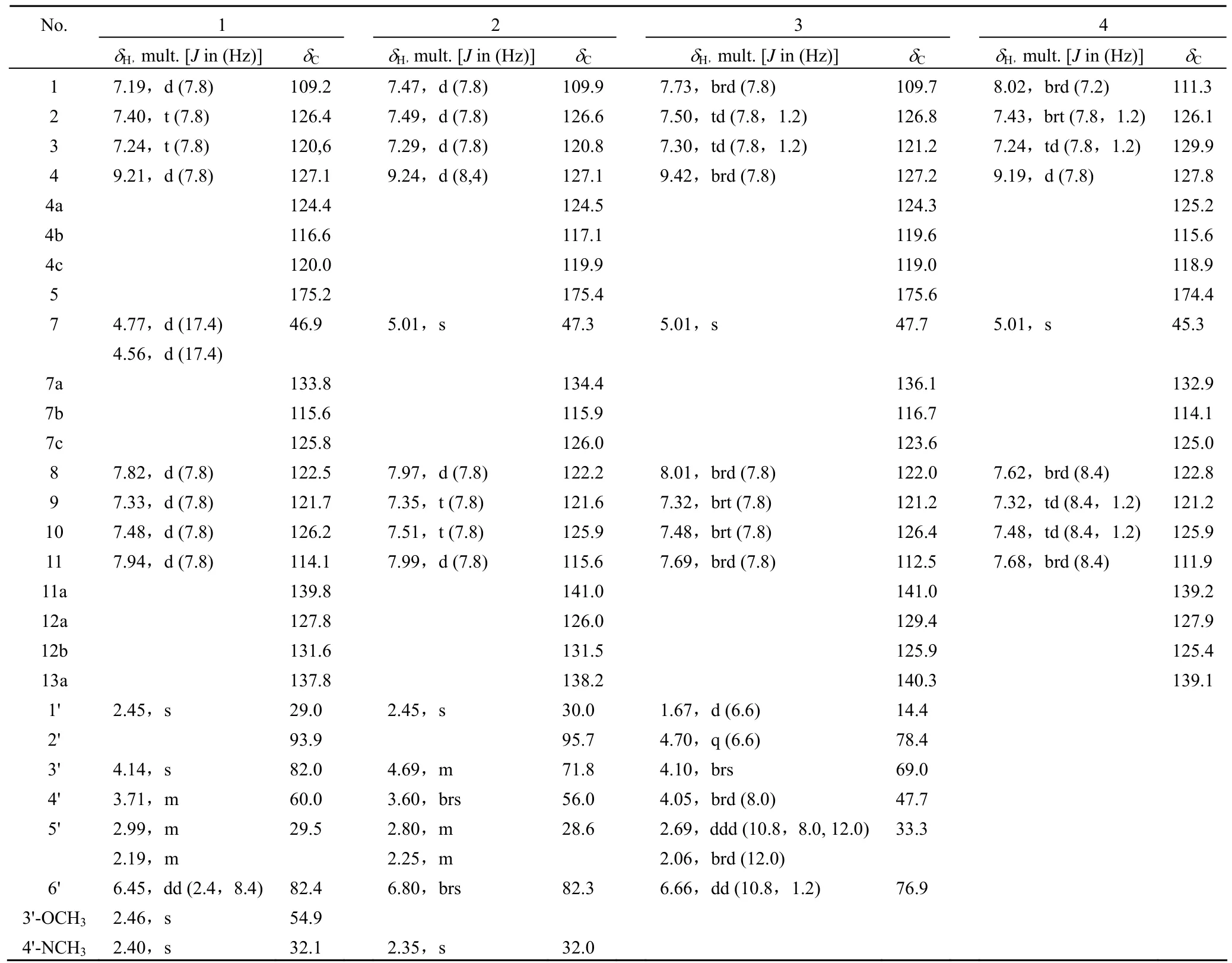
表2 化合物 1 ~ 4 的 NMR 数据*Table 2 The NMR spcetroscopic data for compounds 1 - 4*
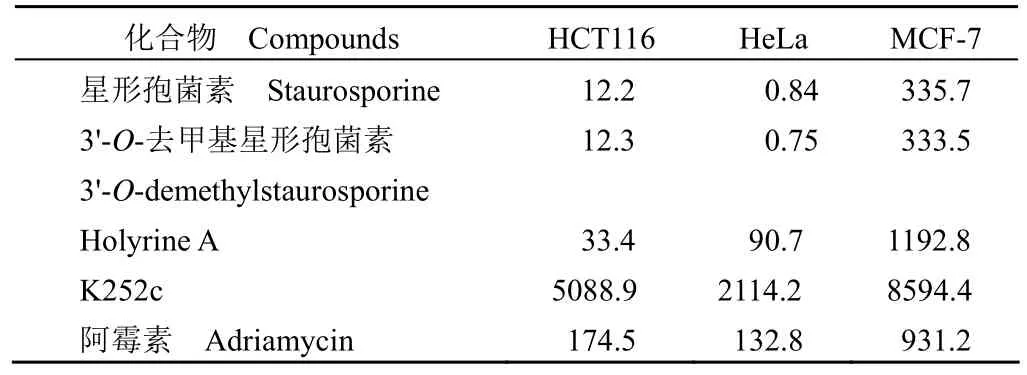
表3 化合物 1 ~ 4 的体外细胞毒活性(IC50,nmol/L)Table 3 In vitro cytotoxic activity of compounds 1 - 4(IC50, nmol/L)
3 讨论
本研究通过基因组生物信息学分析,在菌株IMB3-202 基因组中发现一条吲哚咔唑生物合成基因簇,进而通过发酵条件优化,最终从中分离并鉴定了 4 个吲哚咔唑类化合物。本研究结果表明,通过基因组学分析,可以在基因水平上预测产物结构,有助于快速识别特定类型的产物,对于微生物天然产物的发现具有重要的指导意义。
[1] Nakano H, Omura S. Chemical biology of natural indolocarbazole products: 30 years since the discovery of staurosporine. J Antibiot(Tokyo), 2009, 62(1):17-26.
[2] Sánchez C, Méndez C, Salas JA. Indolocarbazole natural products:occurrence, biosynthesis, and biological activity. Nat Prod Rep, 2006,23(6):1007-1045.
[3] Shaaban KA, Elshahawi SI, Wang X, et al. Cytotoxic Indolocarbazoles from Actinomadura melliaura ATCC 39691. J Nat Prod, 2015, 78(7):1723-1729.
[4] Kim ES. Midostaurin: first global approval. Drugs, 2017, 77(11):1251-1259.
[5] Wang Q, Zhang Y, Wang M, et al. Neo-actinomycins A and B, natural actinomycins bearing the 5H-oxazolo[4,5-b]phenoxazine chromophore, from the marine-derived Streptomyces sp. IMB094. Sci Rep, 2017, 7 (1):3591.
[6] Tan Y, Hu Y, Wang Q, et al. Tetrocarcins N and O, glycosidic spirotetronates from a marine-derived Micromonospora sp. identified by PCR-based screening. RSC Adv, 2016, 6(94):91773-91778.
[7] Gan M, Liu B, Tan Y, et al. Saccharothrixones A-D,tetracenomycin-type polyketides from the marine-derived actinomycete Saccharothrix sp. 10-10. J Nat Prod, 2015, 78(9):2260- 2265.
[8] Wu C, Tan Y, Gan M, et al. Identification of elaiophylin derivatives from the marine-derived actinomycete Streptomyces sp. 7-145 Using PCR-Based Screening. J Nat Prod, 2013, 76(11):2153-2157.
[9] Schupp P, Eder C, Proksch P, et al. Staurosporine derivatives from the ascidian eudistoma toealensis and its predatory flatworm pseudoceros sp. J Nat Prod, 1999, 62(7):959-962.
[10] Meksuriyen D, Cordell GA. Biosynthesis of staurosporine, 1. 1H- and 13C-NMR assignments. J Nat Prod, 1988, 51(5):884-892.
[11] Hoehn P, Ghisalba O, Moerker T, et al. 3'-Demethoxy-3'-hydroxystaurosporine, a novel staurosporine analogue produced by a blocked mutant. J Antibiot (Tokyo), 1995, 48(4):300-305.
[12] Williams DE, Bernan VS, Ritacco FV, et al. Holyrines A and B,possible intermediates in staurosporine biosynthesis produced in culture by a marine actinomycete obtained from the North Atlantic Ocean. Tetrahedron Lett, 1999, 40(40):7171-7174.
[13] Yasuzawa T, Iida T, Yoshida M, et al. The structures of the novel protein kinase C inhibitors K-252a, b, c and d. J Antibiot (Tokyo),1986, 39(8):1072-1078.
[14] Kreitlow S, Mundt S, Lindequist U. Cyanobacteria--a potential source of new biologically active substances. J Biotechnol, 1999, 70(1-3):61-63.
[15] Koeth LM, DiFranco-Fisher JM, McCurdy S. A reference broth microdilution method for dalbavancin in vitro susceptibility testing of bacteria that grow aerobically. J Vis Exp, 2015, 103:e53028.
[16] Gan M, Zheng X, Gan L, et al. Streptothricin derivatives from Streptomyces sp. I08A 1776. J Nat Prod, 2011, 74(5):1142-1147.
[17] Weber T, Blin K, Duddela S, et al. antiSMASH 3.0-a comprehensive resource for the genome mining of biosynthetic gene clusters. Nucleic Acids Res, 2015, 43(W1):W237-W243.
[18] Onaka H, Taniguchi S, Igarashi Y, et al. Cloning of the staurosporine biosynthetic gene cluster from Streptomyces sp. TP-A0274 and its heterologous expression in Streptomyces lividans. J Antibiot (Tokyo),2002, 55(12):1063-1071.
[19] Sánchez C, Butovich IA, Braña AF, et al. The biosynthetic gene cluster for the antitumor rebeccamycin: characterization and generation of indolocarbazole derivatives. Chem Biol, 2002, 9(4):519-531.
[20] Ryan KS. Biosynthetic gene cluster for the cladoniamides, bis-indoles with a rearranged scaffold. PLoS One, 2011, 6(8):e23694.
[21] Kim SY, Park JS, Chae CS, et al. Genetic organization of the biosynthetic gene cluster for the indolocarbazole K-252a in Nonomuraea longicatena JCM 11136. Appl Microbiol Biotechnol,2007, 75(5):1119-1126.
[22] Chang FY, Ternei MA, Calle PY, et al. Targeted metagenomics:finding rare tryptophan dimer natural products in the environment.J Am Chem Soc, 2015, 137(18):6044-6052.
[23] Groom K, Bhattacharya A, Zechel DL. Rebeccamycin and staurosporine biosynthesis: insight into the mechanisms of the flavin-dependent monooxygenases RebC and StaC. Chembiochem,2011, 12(3):396-400.
[24] Salas AP, Zhu L, Sánchez C, et al. Deciphering the late steps in the biosynthesis of the anti-tumour indolocarbazole staurosporine: sugar donor substrate flexibility of the StaG glycosyltransferase. Mol Microbiol, 2005, 58(1):17-27.
[25] Omura S, Iwai Y, Hirano A, et al. A new alkaloid AM-2282 of Streptomyces origin. Taxonomy, fermentation, isolation and preliminary characterization. J Antibiot (Tokyo), 1977, 30(4):275-282.
