低聚异麦芽糖调节肠道菌群及润肠通便作用的研究
2018-04-26刘重慧范誉川高兆兰
刘重慧,张 静,范誉川,高兆兰,魏 涛
(北京联合大学生物化学工程学院,生物活性物质与功能食品北京市重点实验室,北京 100191)
低聚异麦芽糖(isomaltooligosaccharide,IMO)又称为异麦芽低聚糖、异麦芽寡糖、分枝低聚糖等,是淀粉糖的一种,主要成分为葡萄糖分子间以α-1,6糖苷键结合的异麦芽糖(Isomaltose)、潘糖(Panose)、异麦芽三糖(Isomaltotriose)等[1]。
低聚异麦芽糖具有良好的生理功能,能促进肠道有益菌的增殖和所占比例,抑制肠道有害菌及腐败物质形成,低聚异麦芽糖可促进益生菌产生短链脂肪酸[2-3]和短链有机酸,可降低肠道pH,促进肠蠕动,改善便秘[4-5],增加维生素含量;促生的有益菌双歧杆菌能够产生B族维生素和烟酸、叶酸等人体必需的维生素,而肠道中短链脂肪酸的大量积累促进了矿物质如钙、铁、镁等矿质元素的吸收,提高机体免疫力[6]。低聚异麦芽糖还可调节人体脂类代谢,对总胆固醇、甘油三脂、低密度脂蛋白的降低作用明显[7]。低聚异麦芽糖还可预防直肠癌等癌症的发生[8]等诸多功能。低聚异麦芽糖抗龋齿性甚佳,可以有效地保护牙齿。低聚异麦芽糖中潘糖对阻碍齿垢形成的效果也极为明显[9]。低聚异麦芽糖是公认的有发展前景的益生元,在食品、动物饲料等方面已得到了极大的关注。但目前研究报道中涉及低聚异麦芽糖最佳含量的内容较少。
本文旨在研究不同含量低聚异麦芽糖在体外对益生菌的生长影响,对小鼠体内肠道菌群的影响以及低聚异麦芽糖对便秘小鼠润肠通便的作用,同时研究了低聚异麦糖不同含量对益生菌的影响。以期为功能性食品开发,动物饲料添加剂的开发,医药领域及低聚异麦芽糖分子水平作用机制的研究提供参考,同时为低聚异麦芽糖作用的最佳含量提供指导。
1 材料与方法
1.1 材料与仪器
低聚异麦芽糖 山东百龙创园生物科技有限公司;复方地芬诺酯 常州康普药业有限公司;实验动物 选用二月龄的BALB/C 二级雌性小鼠,中国医学科学院动物中心繁殖场,体重在22~28 g之间共110只;长双歧杆菌(Bifidobacteriumlongum)、嗜酸乳杆菌(Lactobacillusacidophilus) 北京联合大学食品科学系微生物实验室,长双歧杆菌培养以BBL培养基进行培养,嗜酸乳杆菌以MRS培养基进行培养;EMB培养基;叠氮钠-结晶紫-七叶苷琼脂培养基;LBS琼脂培养基。
BBL培养基:蛋白胨15.0 g/L,酵母粉2.0 g/L,葡萄糖20.0 g/L,可溶性淀粉0.5 g/L,氯化钠5.0 g/L,5%半胱氨酸10.0 mL/L,西红柿浸出液400.0 mL/L,吐温801.0 mL/L,肝提取液80.0 mL/L,琼脂 20.0 g/L,pH7.0,121 ℃灭菌15 min。
MRS培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母浸出液5.0 g/L,K2HPO42.0 g/L,葡萄糖20.0 g/L,乙酸钠5.0 g/L,MgSO4·7H2O 0.58 g/L,吐温80 1.0 mL/L,硫酸锰0.25 g/L,琼脂20 g/L,pH6.2~6.4,121 ℃灭菌15 min。
EMB培养基:蛋白胨10.0 g/L,乳糖10.0 g/L,K2HPO42.0 g/L,2%伊红Y溶液20 mL/L,0.65%美蓝溶液10 mL/L,琼脂17 g/L,pH7.1(将蛋白胨,磷酸盐和琼脂溶解于蒸馏水中,调整pH,分装,121 ℃灭菌15 min。临用时加入乳糖并加热溶化琼脂,冷却至50~55 ℃,加入伊红和美蓝溶液,摇匀倒平板)。
叠氮钠-结晶紫-七叶苷琼脂培养基:多价胨10.0 g/L,酵母浸膏5.0 g/L,氯化钠5.0 g/L,K2HPO44.0 g/L,KH2PO41.5 g/L,叠氮化钠0.5 g/L,七叶苷1.0 g/L,0.05%结晶紫水溶液0.4 mL,柠檬酸铁铵0.5 g,琼脂20 g/L,pH8.0,121 ℃灭菌15 min。
LBS培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母粉2.0 g/L葡萄糖20.0 g/L,吐温801.0 mL/L,K2HPO42.0 g/L,乙酸钠5.0 g/L,枸橼酸三氨2.0 g/L,MgSO4·7H2O 0.2 g/L,硫酸锰0.05 g/L,琼脂2,5 g/L,pH6.0~6.5,121 ℃灭菌15 min。
JA2103N天平 北京东南仪诚实验室设备有限公司;ZSD-1160多功能生化培养箱 TOKYO RIKAKIKAI CO.LTD;BX41显微镜 OLYMPUS;825-A型厌氧罐 沈阳市第五人民医院;灌胃针 上海邦耀生物科技有限公司;微量加样器 Eppendorf公司;GI54DWS高压灭菌锅 zealway公司。
1.2 实验方法
1.2.1 低聚异麦芽糖培养基设置 以上述BBL培养基、MRS培养基为基础,除葡萄糖成分外,其余成分含量均与BBL培养基、MRS培养基相同,葡萄糖以表1内的糖替代。

表1 低聚异麦芽糖在糖含量中所占的比例Table 1 The percentage of maltose in sugar content
1.2.2 活菌数的测定 取含有上述不同浓度低聚异麦芽糖的BBL、MRS液体培养基10 mL于20 mL试管中,将纯化后的母种以5%的接种量分别接种,37 ℃培养,长双歧杆菌置于厌氧罐中,培养16~24 h。嗜酸乳杆菌采用稀释平板法计数,长双歧杆菌采用液封法计数[10]。
1.2.3 体内实验设置 所选用的小鼠均按体重随机分组,肠道菌群实验设正常对照组、低剂量组、高剂量组,每组10只,润肠通便和小鼠小肠推进率实验分别设阴性对照组、模型对照组、低剂量组、高剂量组,每组10只。
受试样品及饲喂剂量:低聚异麦芽糖的饲喂剂量采用0.5、1.0 g/(kg·bw)(人体推荐量5~10倍)作为低、高剂量[11]。采取灌胃法,每日灌胃一次,每次灌胃0.2 mL/(10 g·bw)。灌胃14 d,空白对照组和模型对照组灌胃等量蒸馏水[10]。
肠道微生物的采集与处理:实验中,给予受试物之前以及最后一次给予受试物后24 h,无菌条件下采取小鼠粪便,将其放入已灭菌的装有3 mL稀释液的试管中,称重,振荡混匀,待粪便完全均质于稀释液后,采取10倍系列稀释。选择合适的稀释度分别接种在BBL培养基、EMB培养基、叠氮钠-结晶紫-七叶苷琼脂培养基及LBS琼脂培养基上。37 ℃培养24或48 h后,通过观察菌落形态,革兰氏染色镜检并计数菌落[12],计算每克粪便中的双歧杆菌、大肠杆菌、肠杆菌及乳杆菌的数量,取对数后进行统计处理。
小肠推进实验:在连续给予受试物21 d后,各组小鼠禁食24 h。实验开始前各剂量组给予对应受试物,正常对照组及模型对照组给予等量蒸馏水。30 min后,除正常对照组外,其余各组灌喂复方地芬诺酯50 mg/(kg·bw)。20 min后,各组灌喂15%碳黑墨水0.5 mL/只。经过20 min后,颈椎脱臼处死动物,立即取出自幽门至盲肠部的整段小肠,不加牵引平铺成直线。测量小肠全长和幽门至墨水运动前沿位移,计算小肠推进率[10]。
小肠推进率(%)=墨水移动距离(cm)/小肠全长(cm)×100
小鼠排便实验:在连续给予受试物21 d 后,各组小鼠禁食24 h。除正常对照组外,其余各组灌胃复方地芬诺酯10 mg/(kg·bw)。将小鼠放入鼠笼单独饲养,正常饮水进食。1 h后给各组小鼠灌胃15%碳黑墨水0.5 mL/只(实验组碳黑墨水含相应剂量的受试物)。观察记录每只小鼠自灌胃复方地芬诺酯起的首黑便时间以及6 h内排便重量[10]。
1.3 数据处理
2 结果与分析
2.1 不同浓度梯度低聚异麦芽糖在体外对肠道菌群增殖的影响
2.1.1 对长双歧杆菌的影响 由表2可以看出,体外实验中采用不同浓度低聚异麦芽糖与葡萄糖培育长双歧杆菌,单位体积内活菌数量发生变化。以50%、75%和100%低聚异麦芽糖替代葡萄糖培养,与100%葡萄糖培养相比,单位体积内长双歧杆菌Log CFU/mL显著增加(p<0.05),分别增加5%、6%和8%。结果提示,50%、75%、100%低聚异麦芽糖在体外实验中对长双歧杆菌的增殖作用显著。而25%低聚异麦芽糖替代葡萄糖,与100%葡萄糖培养相比对长双歧杆菌的生长没有显著影响,出现此结果的原因可能是由于低聚异麦芽糖的含量过低导致对长双歧杆菌的作用影响不大,由数据结果可推测低聚异麦芽糖对长双歧杆菌的增殖作用可能呈现剂量效应。
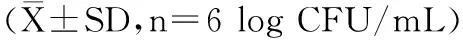
表2 不同浓度低聚异麦芽糖在体外对长双歧杆菌的增殖作用Table 2 The effect of different concentrations of isomaltooligosaccharideon the proliferation of Bifidobacterium longum in log CFU/mL)
2.1.2 低聚异麦芽糖对嗜酸乳杆菌的影响 由表3可以看出,体外实验中采用不同浓度低聚异麦芽糖与葡萄糖培养嗜酸乳杆菌,单位体积内活菌数量发生变化,以50%,75%和100%低聚异麦芽糖替代葡萄糖培养,与100%葡萄糖培养相比,单位体积内嗜酸乳杆菌Log CFU/mL分别增加5%(p<0.05),5.6%(p<0.05)和12.5%(p<0.01)。结果提示,50%,75%,100%低聚异麦芽糖在体外实验中对嗜酸乳杆菌的增殖作用显著。而25%低聚异麦芽糖替代葡萄糖,与100%葡萄糖培养相比对嗜酸乳杆菌的生长没有显著影响,出现此结果的原因可能是由于低聚异麦芽糖的含量过低导致对嗜酸乳杆菌的作用影响不大,由数据结果可推测低聚异麦芽糖对嗜酸乳杆菌的增殖作用可能呈现剂量效应。

表3 不同浓度低聚异麦芽糖在体外对嗜酸乳杆菌的增殖作用Table 3 The effect of different concentrations of aisomaltooligosaccharide on the proliferation of Lactobacillus acidophilus in CFU/mL)
2.2 低聚异麦芽糖对小鼠体重的影响
由表4可见,灌胃低、高剂量的低聚异麦芽糖后,与空白对照组相比,小鼠的体重变化没有统计学意义,说明低聚异麦芽糖对生物体体重的增长没有明显的作用效果,这与王少光[13]等的研究结果是一致的。

表4 低聚异麦芽糖对小鼠体重的影响Table 4 Effect of isomaltooligosaccharide on body weight in
2.3 低聚异麦芽糖对小鼠肠道菌群的影响
由表5可知,在灌胃前肠道菌群无差异的小鼠,连续给与低剂量组(0.5 mg/(kg·bw))、高剂量组(1.0 g/(kg·bw))低聚异麦芽糖14 d后,与对照组相比,高剂量组肠杆菌及肠球菌数量并无显著变化,低剂量组肠球菌也没有显著变化,低剂量组肠杆菌则显著降低。低,高剂量组乳杆菌及双歧杆菌数量均有显著提高,其中低剂量组肠杆菌减少6%(p<0.05),乳杆菌增长5%(p<0.01),双歧杆菌增长9%(p<0.01);高剂量组的乳杆菌增长9%(p<0.01),双歧杆菌增长11%(p<0.01)。灌胃前后自身的比较中,空白对照组肠球菌显著增加14%(p<0.05),乳杆菌增长10%(p<0.01);低剂量组肠杆菌减少14%(p<0.05),乳杆菌增长12%(p<0.05),双歧杆菌增长15%(p<0.01);高剂量组乳杆菌增长21%(p<0.01),双歧杆菌增长19%(p<0.01)。说明低聚异麦芽糖可促进乳杆菌,双歧杆菌等肠道有益菌的增长,同时抑制肠球菌等有害菌的增长,对肠道菌群具有较强的良性调节作用,但低、高两个剂量组对肠道菌群的影响差别不大。

表5 低聚异麦芽糖对小鼠肠道菌群的影响Table 5 Effect of isomaltooligosaccharide on intestinal flora in CFU/g)
粪便中双歧杆菌与肠杆菌数量的比值(B/E值)可作为肠道微生物定植抗力的指标应用于临床,该指标能从正反两个方面来评价肠道菌群结构的状况,B/E值1以上表示肠道定植抗力正常,B/E值<1表示肠道定植抗力降低[14]。由表6可见,在饲喂受试物前后,各组小鼠的B/E值均大于1,说明小鼠肠道定植力正常。在饲喂前,各组小鼠B/E值无显著差异。服用低聚异麦芽糖14 d后,对照组的B/E值与饲喂前没有差异,低、高剂量组与饲喂前相比分别提高23%(p<0.05)和32%(p<0.01);与对照组相比,分别提高10%(p<0.05)和19%(p<0.01)。表5,表6的结果提示,低、高剂量的低聚异麦芽糖具有可以改善肠道菌群结构的功能。

表6 低聚异麦芽糖对小鼠肠道菌群B/E的影响Table 6 Effect of isomaltooligosaccharide on intestinal flora B/E in
2.4 对小鼠小肠推进率的影响
由表7可以看出,连续给与受试物21 d后,阴性对照组的小肠推进率高于模型对照组90%(p<0.01),说明造模成功。与模型对照组相比,低、高剂量组的小肠推进率分别提高83%(p<0.01)和98%(p<0.01)。结果提示:低、高剂量低聚异麦芽糖具有极显著改善小鼠小肠推进率的功能。说明低聚异麦芽糖在促进肠道活动方面发挥积极作用。

表7 低聚异麦芽糖对小鼠小肠推进率的影响Table 7 Effects of isomaltooligosaccharide on intestinal propulsion in
2.5 对小鼠排便功能的影响
由表8可知,在连续给予受试物21 d之后,与阴性对照组比较,模型对照组的首次排黑便时间增加186.7%(p<0.01),6 h内排黑便重量减少76.2%(p<0.01),说明造模成功。与模型对照组相比,低、高两个剂量组首次排黑便时间分别降低83%(p<0.01)和86%(p<0.01);6 h内排黑便重量分别提高79.4%(p<0.05)和126%(p<0.01),结果提示:低、高剂量的低聚异麦芽糖具有明显改善便秘小鼠通便的功能,可有效缓解便秘,有通便的作用。

表8 低聚异麦芽糖对小鼠排首粒黑便时间,黑便重量的影响Table 8 Effects of isomaltooligosaccharide on the time of head and stool,the weight of feces in
3 结论
本文结果提示,低聚异麦芽糖可以有效增加小鼠肠道内双歧枝菌与乳杆菌的数量,改善肠道菌群结构,治疗便秘,无论体外还是在体内肠道环境中都有利于益生菌的生长。体外结果显示低聚异麦芽糖的作用可能呈现剂量效应。
4 讨论
目前,低聚异麦芽糖的需求逐渐增大,多年来,对其功能特性和生产方法[15-16]的研究已经成为热点[17]。低聚异麦芽糖由于其自身良好的物理和生物特性,在食品中可发挥良好的应用[18]。目前低聚异麦芽糖已被应用在饲料中[19-20],在保健品、饮料、乳制品、糖果、饼干小食品及焙烤食品中也逐渐得到了应用,同时也作为新资源食品开始应用[21]。本文研究提示低聚异麦芽糖在改善肠道菌群结构,治疗便秘等方面有非常积极的影响。低聚异麦芽糖作为保健品、食品、饲料添加剂以及在医药方面将有良好的应用前景,低聚异麦芽糖是一种非常有研究价值和发展潜能的益生元。本实验的不足之处是体内实验只设置了低、高两个剂量组,差异不显著,可设置多个剂量组进行进一步的低聚异麦芽糖含量对肠道菌群作用的研究。
[1]林琳,卢永胜. 功能性低聚异麦芽糖的研究[J]. 兽药与饲料添加剂,2009,14(3):13-14.
[2]连晓蔚. 肠道菌群利用几种膳食纤维体外发酵产短链脂肪酸的研究[D].广州:暨南大学,2011.
[3]Toward R,Montandon S,Walton G,et al. Effect of prebiotics on the human gut microbiota of elderly persons[J]. Gut Microbes,2012,3(1):57.
[4]车夏宁,林海龙,赵永武,等. 低聚异麦芽糖理化功能特性及生产方法研究进展[J]. 中国酿造,2014(7):20-23.
[5]Wang S,Zhu H,Lu C,et al. Fermented milk supplemented with probiotics and prebiotics can effectively alter the intestinal microbiota and immunity of host animals[J]. Journal of Dairy Science,2012,95(9):4813.
[6]Wang Y,Zeng T,Wang S E,et al. Fructo-oligosaccharides enhance the mineral absorption and counteract the adverse effects of phytic acid in mice[J]. Nutrition,2010,26(3):305-311.
[7]Yen C H,Tseng Y H,Kuo Y W,et al. Long-term supplementation of isomalto-oligosaccharides improved colonic microflora profile,bowel function,and blood cholesterol levels in constipated elderly people-A placebo-controlled,diet-controlled trial[J]. Nutrition,2011,27(4):445-450.
[8]杨静,朱元民,刘玉兰. 益生菌与结直肠癌发病的关系[J].胃肠病学,2012(4):242-244.
[9]王良东. 低聚异麦芽糖性质、功能、生产和应用[J]. 粮食与油脂,2008(4):43-47.
[10]中华人民共和国卫生部. 保健食品检验与评价技术规范[Z].2003:159-162.
[11]黄婧,辛修锋. 低聚异麦芽糖的食用安全性及法规[J].精细与专用化学品,2009,17(16):28-30.
[12]国家卫生和计划生育委员会,国家食品药品监督管理总局GB 4789.2-2016. 食品微生物学检验菌落总数测定[S]. 北京:中国标准出版社,2017.
[13]王少光,张晓峰,韩萍,等 . 低聚异麦芽糖对小鼠肠道菌群及其代谢产物的影响[J]. 河南工业大学学报(自然科学版),2012,33(5):75-78.
[14]吴仲文,李兰娟,马伟杭,等. 肠道微生物定植抗力的新指标B/E值[J]. 浙江预防医学,2000(7):4-5.
[15]许宏贤,张晓萍,段钢. 益生菌乳酸发酵法生产高纯度低聚异麦芽糖[J]. 食品与生物技术学报,2016,35(11):1219-1223.
[16]孙鲁,崔静,罗希韬,等. 酶法生产低聚异麦芽糖及酵母分离纯化研究[J]. 中国食品添加剂,2016(3):111-115.
[17]崔静,罗希韬,邱学良,等. 低聚异麦芽糖生产及应用研究进展[C].中国食品添加剂和配料协会甜味剂专业委员会2015年行业年会,2015.
[18]严晓娟,陈朋,胡先望,等. 低聚异麦芽糖生产工艺研究[J]. 现代生物医学进展,2013(24):4794-4797,4776.
[19]陈国旺,黄大鹏. 谷氨酰胺和低聚异麦芽糖对断奶仔猪生长性能和肠道微生物的影响[J]. 饲料工业,2016,37(6):47-50.
[20]陈玉龙. 低聚异麦芽糖和复合益生菌制剂对繁殖母猪生产性能的影响[D].南宁:广西大学,2016.
[21]食品伙伴网.澳新拟批准低聚异麦芽糖作为新资源食品[EB/OL].http://news.foodmate. net/2017,05/429202.html,2017-5-17.
